铕掺杂的一维钛氧簇合物Ti4Eu2O4(OOCC6H5)14的制备、晶体结构及表征
2020-11-11吴念念赵明明刘胜军
吴念念 赵明明 刘胜军*,,2 刘 波*,
(1中国科学技术大学化学与材料学院,合肥 230026)
(2安徽工业大学化学与化工学院,马鞍山 243032)
0 引言
钛氧簇合物作为一种新兴的晶态纳米团簇,可以看作是TiO2半导体材料的分子结构模型。凭借多样化的结构和优异的性能,钛氧簇合物在阳极材料和光催化剂等领域具有广泛的应用价值,因此,近年来钛氧簇的设计和合成引起了越来越多的关注[1-6]。在最近的报道中,Wright和Coppens课题组报道并详细阐述了钛氧簇中的各种配位模式以及金属离子掺杂[6-11],Zhang和合作者近期报道了目前最大尺寸的{Ti52}钛氧簇和类富勒烯结构的{Ti42}钛氧簇[12-14],丰富了钛氧簇的结构类型。目前报道的大部分钛氧簇都有末端烷氧基(-OR),其在水溶液或者在空气水分中容易水解,会导致单晶结构的坍塌。金属与烷氧基之间的配位键作用力远小于金属与羧基之间的作用。为了解决钛氧簇稳定性差的问题,可以采用完全羧基配位策略来提高钛氧族的稳定性[9]。目前报道的钛氧簇光吸收范围只在紫外部分[15-16],然而紫外光部分仅占太阳光的5%,因此,窄的光吸收限制了钛氧簇的实际应用,而通过金属离子的掺杂可以拓展钛氧簇的光吸收范围[11,17-18]。金属离子中的镧系金属离子具有独特的发光特性,荧光寿命长,发光量子产率高,特别是当钛离子与镧系金属离子通过氧桥连接时,因为发生能量转移,所以镧系-钛氧簇通常具有很好的光学性质[19-21]。近期,Long课题组报道的一系列具有不同配位模式(如六配位、八配位和九配位)的铕元素掺杂钛氧簇合物[20,22-23],Kong课题组报道的镧元素掺杂钛氧簇合物[24],都具有较好的荧光性质。除此之外,最近我们课题组报道的铟和铬掺杂钛氧簇合物,可以同时提高其稳定性和扩展光吸收范围[5,14]。然而到目前为止,兼具稳定性和优越光吸收或者发光性质的钛氧簇还处于起步阶段,其单晶的制备具有很大的挑战性。因此,合成稳定的镧系掺杂钛氧簇合物在荧光检测和光催化等方面都有很大的发展前景。
我们采用同时完全羧基配位和铕离子掺杂策略来提高钛氧簇的稳定性和荧光性质。通过溶剂热法合成单晶Ti4Eu2O4(OOCC6H5)14(记为POTi4Eu2),其具有较好的热稳定性和良好的荧光性质。利用元素分析、热重分析、固态紫外可见光谱、红外光谱等技术对POTi4Eu2进行表征,通过荧光光谱和荧光寿命等技术来研究其光学性质。
1 实验部分
1.1 试 剂
所有的药品和溶剂都是通过商业渠道购买并未经过特殊处理而直接使用。异丁氧基钛、乙酸铕(Ⅲ)水合物(99.99%,metal basis)购买于Alfa Aesar公司。苯甲酸(AR,99.5%)购买于Aladdin公司。乙腈购买于上海国药集团化学试剂有限公司。醋酸购买于麦克林公司。
1.2 实验仪器
单晶中Ti与Eu的原子比是由电感耦合等离子体(inductively coupled plasma spectrometer,ICP)Optima 7300 DV(PerkinElmer)光谱仪测得。元素分析(C、H、N)由Vario EL Cube测得。热重分析数据(thermogravimetric analysis,TGA或TG)是在空气气氛中以升温速率10℃·min-1在25~700℃范围内由Q500综合热分析工作站测试所得。紫外-可见吸收光谱(ultraviolet-visible absorption spectrum,UV-Vis)是将收集后的样品粉末在DUV-3700光谱仪上测得。傅立叶变换红外光谱(Fourier transform infrared spectrum,FTIR)是将样品与氯化钾压片后在4 000~400 cm-1的波长范围内由SHIMADZU IR红外光谱仪测得。荧光光谱 (fluorescence spectra)在SpectraMax M5荧光谱仪上室温状态下测得。荧光寿命是在单光子计数控制器FluoroHub(Horiba Scientific)上测得。
1.3 钛氧簇单晶的制备
将异丁氧基钛(216 mg,0.53 mmol)、乙酸铕(Ⅲ)水合物(185.57 mg,0.53 mmol)、苯甲酸(567 mg,4.77 mmol)、醋酸(10 μL)和乙腈(10 mL)按顺序加入到 25 mL的聚四氟乙烯反应釜中并搅拌20 min,之后将聚四氟乙烯内衬封装到反应釜中。在180℃烘箱中反应15 h后,自然冷却到室温,收集得到无色单晶。单晶样品用乙腈润洗干净后,在50℃的烘箱中干燥,最终将其保存在干燥密闭的环境中。
1.4 单晶结构的测定
挑选大小适中的晶体样品将其装配在玻璃纤维上,使用Bruker D8 Quest CMOS单晶衍射分析仪,选用石墨单色化的MoKα射线(λ=0.071 073 nm),在293(2)K的温度下收集衍射数据。通过SADABS程序[25]对实验所得数据进行经验吸收校正,用直接法解出晶体结构,并且使用SHELXTL-97程序包通过基于F2的全矩阵最小二乘法进行精修[26]。所有氢原子通过理想化几何以及各向同性位移参数确定精确位置。晶体结构数据列于表1。CCDC:1997261。
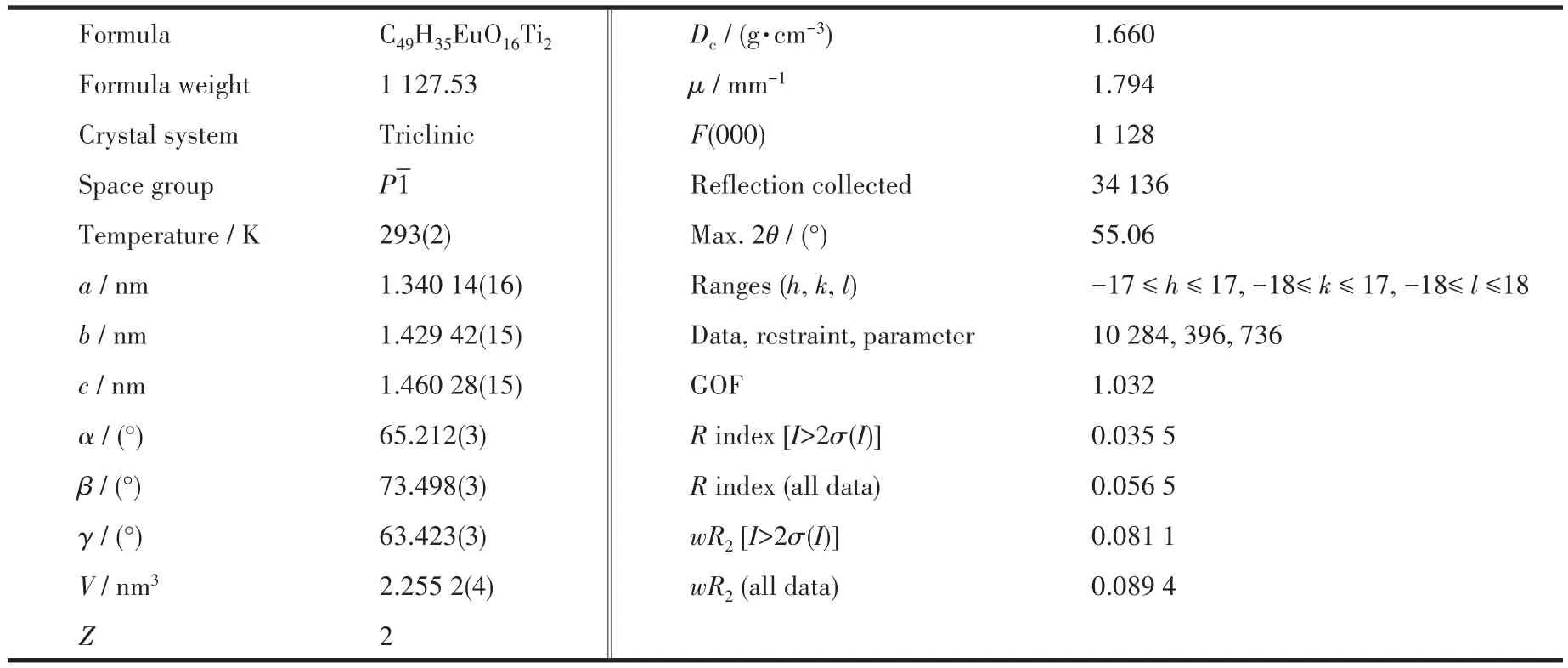
表1 POTi4Eu2晶体结构数据Table 1 Crystallographic data of POTi4Eu2
2 结果与讨论
2.1 晶体结构
通过溶剂热法制备得到无色块状钛氧簇单晶POTi4Eu2。单晶测试结果表明POTi4Eu2属于三斜晶系P空间群(a=1.340 14(16)nm,b=1.429 42(15)nm,c=1.460 28(15)nm),根据ICP测试结果可得Ti与Eu的原子比为1.82∶1,该结果和晶体学分析基本是一致的。分子尺寸约为1.58 nm×1.46 nm×1.17 nm。1个EuO8通过氧桥与2个TiO6形成最小的不对称单元(图1a)。POTi4Eu2结构包含4个TiO6八面体、2个EuO8十二面体和14个桥联的二齿苯甲酸配体(图1b和1c)。簇核Ti4Eu2是由14个苯甲酸配体稳定的,14个苯甲酸配体均采用双齿桥配位,分布于钛氧簇的核簇四周,相邻的簇之间通过苯甲酸配体共价桥联,形成一维链结构。如图2a所示,[Eu2Ti4(μ3-O)4]14+的金属氧核心由2个三角形[EuTi2(μ3-O)]9+通过2个μ3-O2-原子连接的三环单元组成。每个Eu原子与5个苯甲酸和3个μ3-O氧原子八配位形成三角正十二面体结构(图2b)。与已报道的钛氧簇合物Eu2Ti4的Eu均为八配位相比,Eu5Ti4中的Eu表现出六配位、八配位、九配位等3种配位模式[20],而EuTi6和EuTi7中的Eu原子均是九配位[24],这些工作丰富了Eu掺杂钛氧簇体系。在已报道的六核钛氧簇文献中,钛原子主要表现为五配位和六配位2种配位模式[1,15,27]。杂核单晶POTi4Eu2中每个Ti原子是六配位并表现出八面体构型,与六核钛配合物对比发现,此单晶由于八配位Eu的存在,表现出更强的配位能力,能结合更多的苯甲酸配体,在核簇周围占据更多的空间位阻,因此结构更加稳定,在热重分析中也有所体现[28-30]。Ti-O和Eu-O键的键长分别为0.171 6~0.214 1 nm和0.234 6~0.256 1 nm,接近文献报道的键长值[20,23],详细的键长、键角值列于表2。
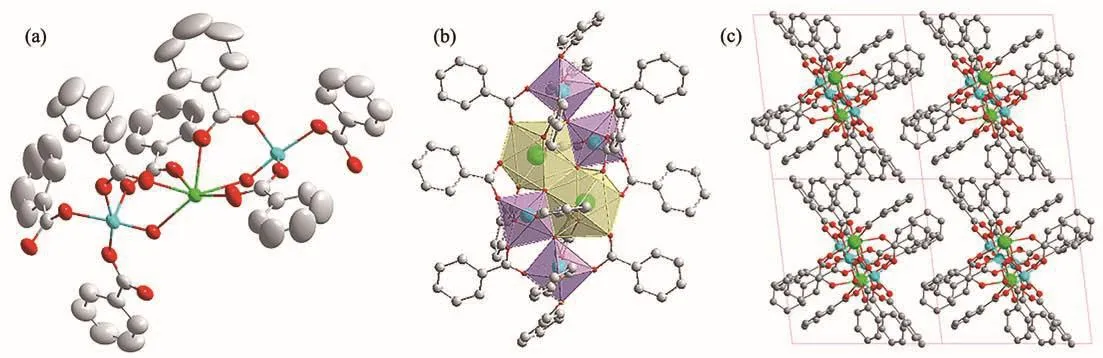
图1 (a)POTi4Eu2的非对称结构图,热椭球以50%的概率水平给定;(b)POTi4Eu2金属与氧多面体的晶体结构图;(c)POTi4Eu2晶体的堆积结构图Fig.1 (a)Asymmetric structure diagram of POTi4Eu2 with thermal ellipsoids given at 50% probability;(b)Crystallographic structure diagram of metal and oxygen polyhedron POTi4Eu2;(c)Packing structure diagram of POTi4Eu2

图2 (a)组装[Eu2Ti4(μ3-O)4]14+金属-氧核心的球棍视图;(b)POTi4Eu2中Eu3+的配位构型Fig.2 (a)Ball-and-stick view of the assembly of the metal-oxo core of[Eu2Ti4(μ3-O)4]14+;(b)Coordination configuration of Eu3+for POTi4Eu2

表2 POTi4Eu2簇的部分键长(nm)以及键角(°)Table 2 Selected bond distances(nm)and angles(°)of POTi4Eu2 cluster
2.2 单晶POTi4Eu2的表征
图3显示的是单晶POTi4Eu2的红外谱图。图中显示出该晶体的特征振动峰,在1 400~1 600 cm-1处的吸收峰是苯甲酸配体的特征振动峰;400~800 cm-1处的吸收峰归属于金属氧键M-O(M=Ti、Eu)的特征振动峰;在1 650~1 750 cm-1处无游离态的羧基振动峰说明羧基均已配位;3 500 cm-1附近的峰是水分子振动引起的宽泛特征值[5,14,31]。热重分析数据显示单晶POTi4Eu2的结构在空气中256℃以内可以保持稳定,随后随着温度的升高,晶体结构开始分解,直到564℃分解完全(图4),热重分析质量损失了67.3%。与文献报道的钛氧簇能在220℃以内保持结构稳定[32]相对比,我们制备的单晶POTi4Eu2具有更好的热稳定性,其较好的热稳定性归因于羧基和Ti/Eu核簇之间有很强的配位键。

图3 POTi4Eu2的红外光谱Fig.3 Infrared spectrum of POTi4Eu2

图4 POTi4Eu2的热重曲线Fig.4 TG curve of POTi4Eu2
2.3 单晶POTi4Eu2的光学性质
POTi4Eu2的固态紫外吸收光谱图是在室温下测试得到,该光谱表明了POTi4Eu2在紫外可见区域(200~600 nm)具有良好的光吸收能力(图 5),并且显示出延伸至可见区域的吸收带。400 nm以下的吸收光谱是因为苯甲酸配体和TiO6、EuO8之间的配体金属电荷转移造成的,POTi4Eu2在可见光区域的吸收峰,是由于钛氧簇的Eu掺杂效应产生的[33]。图6显示了POTi4Eu2在水溶液中的荧光光谱。样品受280 nm的激光激发后,在550~750 nm范围间内产生一系列发射峰,其5D0→7F0发射峰波长为580 nm,5D0→7F1发射峰波长为591 nm,5D0→7F2发射峰波长为615 nm,5D0→7F3发射峰波长为651 nm,5D0→7F4发射峰波长为698 nm。5D0→7F1跃迁为磁偶极跃迁,并且与Eu3+的配位环境无关,5D0→7F2跃迁是一个电偶极跃迁,它与Eu3+周围的局部对称性有关[20]。5D0→7F2发射峰最强,5D0→7F1发射峰较强,其他3个发射峰都比较弱,而且没有观察到苯甲酸配体的发射峰,可以进一步证明镧系-钛氧簇中发生了苯甲酸配体到Eu3+的有效分子内能量转移[20,23,34-36]。固态紫外吸收带与苯甲酸配体的吸收带相近,进一步证实了从苯甲酸配体到Eu(Ⅲ)离子中心的能量转移[22]。文献报道的丙烯酸酯铕三元配合物的发射光谱中,在294 nm紫外光的激发下,该配合物也呈现出Eu3+离子的特征发射,在578、592、615、651和699 nm处的发射峰分别对应 Eu3+离子的5D0→7F0、5D0→7F1、5D0→7F2、5D0→7F3和5D0→7F4电子跃迁。单晶 POTi4Eu2与它们对比,所需激发光源的波长有所减少,但是发射峰的位置与它们基本保持一致[37]。单晶POTi4Eu2的固态荧光寿命谱图如图7所示,单晶POTi4Eu2的衰减曲线可以很好地拟合成双指数函数:I(t)=A1exp(-t/t1)+A2exp(-t/t2),根据公式:t=(A1t12+A2t22)/(A1t1+A2t2)[20,38-39],可以计算出单晶 POTi4Eu2的平均荧光寿命为1.63 ms,而文献报道的钛氧簇平均荧光寿命基本小于1.5 ms[20,22-23],这说明单晶POTi4Eu2具有良好的荧光性质[40-41]。

图5 POTi4Eu2的固态紫外光谱图Fig.5 Solid-state UV-Vis spectrum of POTi4Eu2
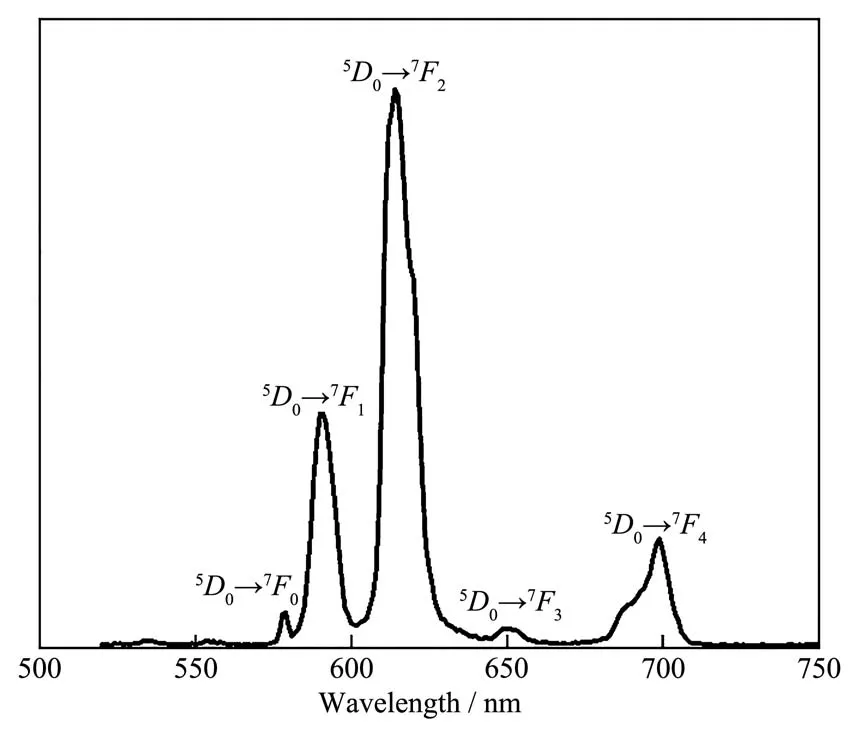
图6 POTi4Eu2水溶液的荧光光谱图Fig.6 Fluorescence spectra of POTi4Eu2 solution

图7 POTi4Eu2的固态荧光寿命图Fig.7 Solid-state fluorescence lifetime of POTi4Eu2
3 结论
采用溶剂热法,通过完全羧基配位和同时镧系金属离子掺杂策略合成钛氧簇单晶,克服了钛氧簇单晶结构较差的稳定性和有限的光吸收等主要缺点。采用该策略对铕掺杂的钛氧簇合物进行深入的研究,发现通过用全羧基配位可显著提高钛氧簇合物稳定性,并且镧系金属铕离子掺杂可将钛氧簇单晶的光吸收范围红移至可见光区且具有良好的荧光性质。因此制备的单晶POTi4Eu2在光催化和荧光检测等领域具有潜在的应用。
