超分辨率图像重构与CI 反卷积共聚焦成像技术对蒿草样本荧光成像的分析研究
2020-11-11吴伟全李元歌唐金凤王思捷杨腾吴平
吴伟全,李元歌,唐金凤,王思捷,杨腾,吴平
(广东医科大学附属医院,广东 湛江 524001)
普通荧光显微镜和普通共聚焦显微镜系统能采集生物组织样本的荧光图像[1-4],但它们都没有超分辨成像功能,不可以获取超分辨率荧光图像。随着显微镜系统的不断发展,出现新型的超分辨率共聚焦系统,具有超分辨率图像重构(Super-Resolution Image Reconstruction,SR)与 CI 反卷积(Constrained Iterative Deconvolution)成像新技术,但由于超分辨率图像重构及CI 反卷积成像技术处于起步阶段,类似研究罕见,因此需进一步探索其使用价值。 本实验拟用超分辨率图像重构共聚焦成像技术对蒿草样本的荧光图像进行采集,并使用其软件cellSens 的CI 反卷积功能处理图像,分析超分辨率图像重构与CI 反卷积共聚焦成像技术检测生物组织样本超分辨率荧光图像的使用价值。
1 材料与方法
1.1 主要仪器和相关样本 DMI3000B 荧光倒置显微镜(德国莱卡公司);TCS SP5 II 共聚焦显微镜系统(德国莱卡公司);新型FV3000 共聚焦显微镜系统(日本奥林巴斯公司),配有OSR 超分辨图像重构及CI 反卷积模块。蒿草样本(德国莱卡公司),为DAPI、FITC 及TRITC 荧光染色后固定在载玻片上。
1.2 实验分组 根据不同显微镜类型及成像技术分为四组:1 组:荧光倒置显微镜采集蒿草样本荧光图像;2 组: 普通共聚焦系统采集蒿草样本荧光图像;3 组: 新型共聚焦系统超分辨率图像重构技术采集蒿草样本超分辨率荧光图像;4 组: 新型共聚焦系统CI 反卷积功能处理蒿草样本超分辨率荧光图像。 每组重复3 次。
1.2 荧光倒置显微镜采集蒿草样本荧光图像 使用德国Leica DMI3000B 荧光倒置显微镜, 分别用紫外光、 蓝光和绿光为激发光激发DAPI、FITC 及TRITC 三染色的蒿草样本,物镜为40 倍镜,采集荧光图像。
1.3 普通共聚焦系统采集蒿草样本共聚焦荧光图像 使用德国Leica TCS SP5 II 共聚焦显微镜系统,分别用 405nm、488nm 和 543nm 波长激发 DAPI、FITC 及 TRITC 三染色的蒿草样本, 物镜为 40 倍镜,采集共聚焦荧光图像。
1.4 新型共聚焦系统超分辨率图像重构成像采集蒿草样本的超分辨率荧光图像 使用新型日本奥林巴斯 FV3000 共聚焦显微镜系统, 分别用405nm、488nm 和 561nm 波长激发 DAPI、FITC 及TRITC 三染色的蒿草样本,物镜为60 倍油镜,采集超分辨荧光图像。
1.5 新型共聚焦系统CI 反卷积功能处理蒿草样本的超分辨率荧光图像 新型日本奥林巴斯FV3000共聚焦系统采集超分辨率荧光图像后, 启动软件cellSens 的CI 反卷积功能,处理蒿草样本超分辨率荧光图像,获得相关样本的超分辨率反卷积图像。
1.6 统计学处理 各组荧光图像荧光强度值由软件LAS X3.0 采集,数据资料经SPSS 17.0 统计软件统计分析,数值用±s 表示。数据分析用方差分析,多样本均数比较选用 LSD 法、Dunnett 法。 P<0.05被认为差异有统计学意义。
2 结果
2.1 荧光倒置显微镜采集的蒿草样本荧光图像蒿草样本经DMI3000B 荧光倒置显微镜采图,DAPI染色为蓝色的荧光图像;FITC 染色为绿色的荧光图像;TRITC 染色为红色的荧光图像; 另外可得三色叠加的荧光图像(见图1A、1B、1C 和 1D)。 DAPI染色荧光图像荧光值为31.40±0.09;FITC 染色荧光图像荧光值为15.47±0.25;TRITC 染色荧光图像荧光值为 40.93±0.02。 见表1。

图1 DMI3000B 荧光倒置显微镜采集的蒿草样本荧光图像(400×)
2.2 普通共聚焦系统采集的蒿草样本共聚焦荧光图像 蒿草样本经TCS SP5 II 共聚焦显微镜系统采图,DAPI 染色为蓝色的共聚焦荧光图像;FITC染色为绿色的共聚焦荧光图像;TRITC 染色为红色的共聚焦荧光图像;另外可得三色叠加的共聚焦荧光图像;与荧光倒置显微镜组(1 组)的比较,相同倍数共聚焦荧光图像图像清晰度高,可以清晰显示蒿草样本切片的整体切面结构(见图2A、2B、2C 和2D)。 DAPI 染色荧光图像荧光值为 39.49±1.23;FITC 染色荧光图像荧光值为 20.65±0.13;TRITC染色荧光图像荧光值为47.58±0.15;相同倍数不同染料染色荧光图像荧光强度分别与荧光倒置显微镜组(1 组)的比较,荧光图像更亮,荧光值增高,有统计学意义(P<0.05)。 见表1。
2.3 新型共聚焦系统超分辨率图像重构采集的蒿草样本超分辨率荧光图像 蒿草样本经FV3000 共聚焦显微镜系统超分辨率图像重构采图,DAPI 染色为蓝色的超分辨率荧光图像;FITC 染色为绿色的超分辨率荧光图像;TRITC 染色为红色的超分辨率荧光图像;另外可得三色叠加的超分辨率荧光图像;与普通共聚焦系统组(2 组)的比较,可以获取高倍数的蒿草样本超分辨率荧光图像 (见图3A、3B、3C 和 3D)。DAPI 染色荧光图像荧光值为 7.11±0.02;FITC 染色荧光图像荧光值为 14.11±0.09;TRITC 染色荧光图像荧光值为 13.12±0.10。 见表1。
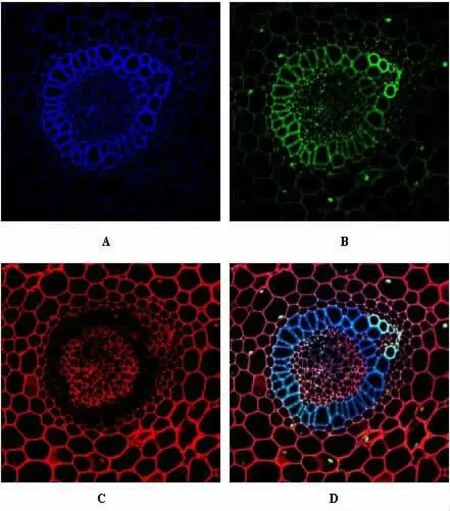
图2 TCS SP5 II 共聚焦显微镜系统采集的蒿草样本共聚焦荧光图像(400×)
2.4 新型共聚焦系统CI 反卷积功能处理的蒿草样本超分辨率反卷积图像 新型FV3000 共聚焦系统采集超分辨率荧光图像后,再使用软件cellSens 的CI 反卷积功能处理,分别获得其超分辨率反卷积图像(见图4A、4B、4C 和 4D)。 与新型共聚焦系统超分辨率图像重构技术组(3 组)的比较,可更清晰观察到蒿草样本切片的细微结构(见图4D 中箭头指示部分)。 DAPI 染色荧光图像荧光值为17.35±0.23;FITC 染色荧光图像荧光值为 15.86±0.07;TRITC 染色荧光图像荧光值为16.09±0.24;相同倍数不同染料染色超分辨率反卷积图像荧光强度分别与新型共聚焦系统超分辨率图像重构技术组(3组)的比较,图像更亮,荧光值增高,有统计学意义(P<0.05)。 见表1。
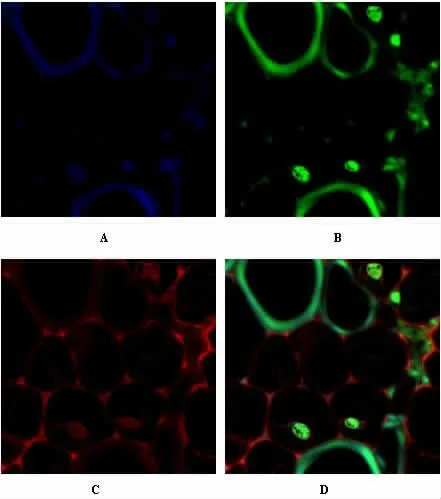
图3 新型FV3000 共聚焦系统超分辨率图像重构采集的蒿草样本超分辨率荧光图像(3000×)
3 讨论
荧光(fluorescence)是指利用一定波长的光致发光的发光现象[5]。 荧光显微镜是生物组织样本荧光成像的重要仪器,可以采集生物组织样本荧光图像,但由于是普通光源,获取荧光图像效果一般,有一定局限性[6,7]。本实验的荧光图像结果也体现了这个局限性。
共聚焦显微镜系统是使用激光光源结合共聚焦技术一种显微镜,得到的共聚焦荧光图像克服了荧光显微镜荧光图像效果不佳的缺点,因而其荧光图像效果较好[8-10]。 与荧光倒置显微镜的荧光图像比较,本实验结果也显示相同倍数共聚焦荧光图像图像清晰度更高,可以清晰显示蒿草样本切片的整体切面结构,荧光图像更亮,荧光值增高,有统计学意义,说明共聚焦荧光图像效果更好,与相关实验研究结果类似。
近年新型的共聚焦系统推出超分辨率成像功能,使用超分辨率图像重构成像新技术[11]。 超分辨率图像重构是指通过硬件结合软件方法,采集分析一系列低分辨率的图像来得到一幅高分辨率的图像过程,其是提高成像系统分辨率的一类技术[12,13]。CI 反卷积技术是一种图像处理及图像恢复的新技术,通过使用专业限制迭代算法,对于提高图像的分辨率非常有效[14,15]。 本实验显示新型的超分辨率共聚焦系统可以准确获取超分辨率图像,与普通共聚焦系统相比,可获取高倍数的蒿草样本超分辨率荧光图像。 使用软件cellSens 的CI 反卷积功能处理,可获得超分辨率反卷积图像,与新型共聚焦系统超分辨率图像比较,图像更亮,荧光值增高,有统计学意义,可更清晰观察到蒿草样本切片的细微结构。
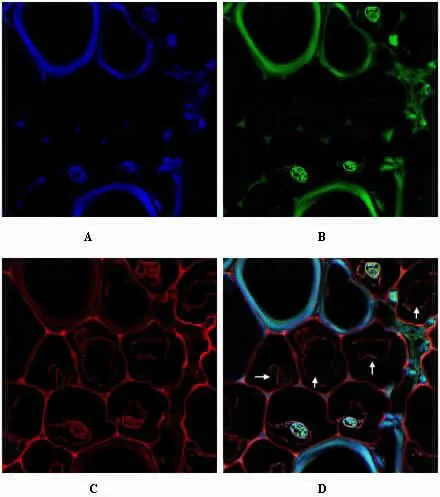
图4 新型FV3000 共聚焦系统CI 反卷积获取的蒿草切片超分辨率反卷积图像(3000×)
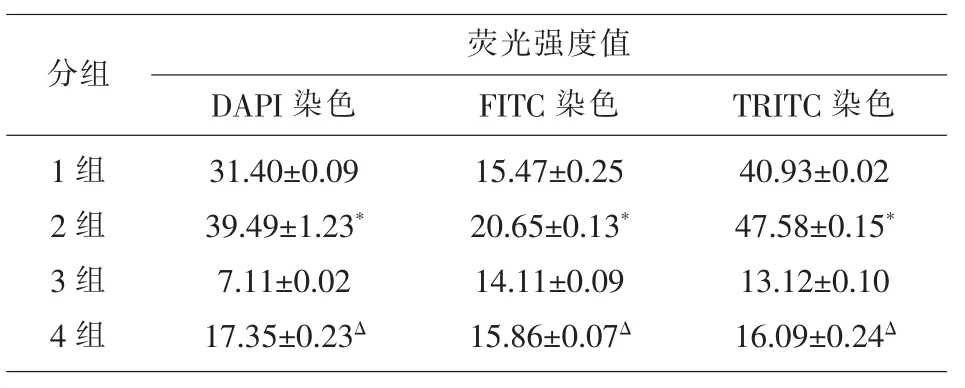
表1 四组蒿草样本不同染料染色荧光图像荧光强度比较
本实验采用样本截面结构清晰的蒿草样本[16],使用超分辨率图像重构与CI 反卷积共聚焦成像技术对蒿草样本的荧光成像进行分析研究,结果表明超分辨率图像重构与CI 反卷积共聚焦成像技术检测生物组织样本,采集超分辨率荧光图像具有较高的使用价值。
