藏红花素通过PGC-1α/SIRT3信号通路抑制慢性阻塞性肺疾病模型大鼠的气道炎症
2020-11-10谢圆媛杨丹芬王莉
谢圆媛 杨丹芬 王莉
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种可预防、可治疗的肺部疾病,其特征是持续气流受限和不完全的可逆性[1]。COPD现已成为严重威胁人类健康的常见疾病,预计到2020年将成为全球第三大死亡原因[2]。成人COPD的患病率随年龄增长而增加,目前,全世界40岁以上成年人的COPD患病率已达到9%~10%[3]。香烟烟雾被认为是造成COPD的主要原因,可直接损害支气管上皮细胞的功能,而支气管上皮细胞作为抵抗有害气体的第一个解剖学气道屏障,损害后将会产生过度炎症反应,导致COPD出现许多异常的结构变化[4-5]。
藏红花素是番红花中的一种水溶性类胡萝卜素,也是藏红花的主要成分之一[6]。作为一种有效的抗氧化剂,藏红花素具有多种药理活性,主要包括抗凋亡、抗炎,保护神经和心脏等[7-8]。有研究表明,口服藏红花素可显著降低细胞损伤以及组织坏死的生物标志物,如乳酸脱氢酶活性和肾脏中NO含量,并增加过氧化氢酶活性[9]。而藏红花素在COPD中的作用却几乎未见报道,因此,探索其在COPD发生过程中的作用及探讨其机制,对于寻找COPD治疗新靶点及新型药物有着重要意义。
资料与方法
一、仪器与试药
藏红花素(纯度≥99.9%)、10%水合氯醛与脂多糖(美国 Sigma 公司),过滤嘴香烟(焦油含量为19 mg,尼古丁含量为 1.2 mg,南宁卷烟厂生产),酶联免疫吸附试剂盒、BCA蛋白测定试剂盒与ECL显色液(中国碧云天生物技术研究所),TUNEL检测试剂盒(美国Maxim BIO公司),Trizol 试剂盒(美国Santa Cruz公司),Primescript RT reagent kit with gDNA Eraser试剂盒与SYBR Premix Ex Taq Ⅱ试剂盒(日本Takara公司),RIPA 裂解液(美国Invitrogen 公司),HE染色试剂盒(北京索莱宝科技公司),抗β-actin、抗PGC-1α、抗SIRT3以及HRP标记山羊抗兔 IgG抗体(英国Abcam公司)。
二、动物
60只健康雄性SPF级SD大鼠,体质量(200±20)g,由延安大学医学院动物研究中心提供,许可证号为SCXK(陕)2019-0001。
三、方法
1 动物饲养与分组 将所有大鼠在温度(22±3)℃,相对湿度在50%~70%的环境中分笼饲养,期间自由饮水与摄食,适应性饲养7d后开始实验。将60只SD大鼠随机分为4组,每组15只,分别为:(1)正常对照组,(2)COPD组,(3)COPD+藏红花素低剂量组(10 mg/kg),(4)COPD+藏红花素高剂量组(50 mg/kg)。藏红花素剂量参考以往研究[10]并结合实验具体情况施用。(2)、(3)、(4)组大鼠通过香烟熏吸加气道内注入脂多糖(LPS)的方法建立COPD 大鼠模型。
2 COPD大鼠模型制备与给药 参考文献方法[11]来构建COPD大鼠模型。将SD大鼠放于自制玻璃熏烟箱内,每次放10只,并点燃10根香烟,烟熏15 min 后打开箱子顶盖,散去烟雾5 min,接着重复上述步骤两次,每日进行一次,在实验结束后将大鼠转移至正常环境下饲养,实验连续30 d。在实验期间第1 d和第15 d,使用10%水合氯醛腹腔注射麻醉大鼠,固定于固定板上,暴露其气管,在气管内快速注入100 μL LPS(1 mg/mL),旋转固定板,使LPS尽可能均匀分布于大鼠两肺。正常对照组大鼠于第1 d和第15 d气管内注入生理盐水(2 mL/kg),其余时间均进行正常培养。使用生理盐水将藏红花素配制为5 g/L的溶液,藏红花素低剂量组、高剂量组分别于连续熏烟3 d 后,于第4 天熏烟前1 h,分别腹腔注射藏红花素溶液10 mg/kg、50 mg/kg,每日一次,直至造模结束。造模完成24 h后,对各组大鼠进行肺功能检测,抽取动脉血并收集肺泡灌洗液,摘取肺组织,一部分固定在10%福尔马林溶液中,一部分保存于-80 ℃冰箱中。
3 肺功能评估 使用10%水合氯醛腹膜内麻醉大鼠。固定四肢及头部,颈部消毒,钝性逐层分离颈部皮下组织至暴露气管,将气管插管并连接到动物肺功能检测仪(FGC-A+型全自动肺功能测试仪),记录大鼠相关肺功能指标,包括呼气峰流量(peak expiratory flow,PEF)、吸气峰流量(peak inspiratory flow,PIF)及0.3秒用力呼气容积与用力肺活量比值(FEV0.3/FVC)。
4 肺泡灌洗液收集 使用10%水合氯醛腹腔注射麻醉大鼠,将大鼠四肢及头部固定,消毒后打开胸腔暴露大鼠气管,在气管下端横纵切一小“T”形切口,将插管沿着此切口插入,成功插入后立刻结扎固定。采用注射器吸取2 mL预热的生理盐水,通过导管缓慢注入大鼠肺部进行灌洗,轻柔按摩大鼠胸前区,30 s后缓慢抽回灌洗液,再将抽回的灌洗液缓慢注入肺内,如此重复此步骤,直到可见乳白色泡沫状液体表示灌洗成功,收集灌洗液。
5 ELISA检测 将抽取的大鼠动脉血于室温下静置1 h,2000 r/min离心20 min,分离出血清。将肺支气管肺泡灌洗液(BALF)置于离心管,2000 r/min 离心5 min,取上清液。用酶联免疫吸附法(ELISA)检测血清和BALF中IL-1β、IL-6与TNF-α的含量,所有操作步骤均严格按照ELISA试剂盒说明书进行。
6 HE染色 将固定好的大鼠肺组织,经脱水、常规石蜡包埋后,切成5 μm厚度的石蜡切片,进行苏木精-伊红(HE)染色。依次滴加苏木精,染色5 min后流水冲洗,接着滴加伊红染色3 min,再次流水冲洗,使用乙醇进行脱水,自然晾干后,置于二甲苯中透明10 min,中性树胶封片,于显微镜下观察肺组织病理形态改变并拍照。
7 TUNEL 大鼠肺组织的石蜡切片常规脱蜡后,滴加20 μg/mL不含DNase 的蛋白酶K,室温孵育30 min,PBS洗涤3次,3%H2O2溶液处理10 min,PBS 洗涤3次,滴加50 μL TUNEL检测液于样品上,在湿盒中37℃孵育1 h,PBS洗涤3次后,加100 μL streptavidin标记HRP(1 ∶500)30 min,用PBS浸洗3 次。接着滴加100 μL DAB显色溶液,室温孵育10 min,PBS再次洗涤3次,苏木素复染细胞核后立即用自来水冲洗。采用梯度酒精脱水,二甲苯透明2 次,每次1 min,中性树胶封片。于光镜观察并分析结果,阳性凋亡细胞表现为细胞质凝集,分布于细胞核周边,胞核固缩且呈深褐色。计算肺组织中凋亡细胞的表达情况。
8 实时定量PCR 将大鼠肺组织研磨匀浆,使用Trizol试剂提取肺组织总RNA,分光光度计检测RNA的纯度及浓度。Primescript RT reagent kit with gDNA Eraser试剂盒说明书进行逆转录合成cDNA,qRT-PCR按照SYBR Premix Ex Taq Ⅱ试剂盒说明书检测PGC-1α、SIRT3 mRNA表达水平,GAPDH作为内参基因。反应条件为:95 ℃预变性3 min,95 ℃变性20 s,60 ℃退火15 s,72 ℃ 延45 s,循环40 次,实验重复3次。引物由上海生工生物有限公司合成,具体序列为:PGC-1α上游引物:5′-GTGCAGCCAAGACTCTGTATGG-3′,下游引物:5′-GTCCAGGTCATTCACATCAAGCAAGTT-3′,SIRT3上游引物:5′-CCCAATGTCGCTCACTACTTCC-3′,下游引物:5′-CGTCAGCCCGTATGTCTTCC-3′,GAPDH上游引物:5′-TTCCTACCCCCAATGTATCCG-3′下游引物:5′-CATGAGGTCCACCACCCTGTT-3′。采用2-ΔΔCt 法计算各基因mRNA相对表达量。
9 Western blot 在大鼠肺组织加入预冷的RIPA裂解液研磨裂解肺组织,以12000 r/min离心5 min,获得上清液。按照BCA试剂盒说明测定总蛋白浓度。取25 μg总蛋白上样,通过10%SDS-聚丙烯酰胺凝胶电泳分离,并将分离蛋白转移至聚偏二氟乙烯膜上。TBST洗涤3次,5%脱脂奶粉室温封闭2 h,然后加入一抗PGC-1α(1 ∶1000),SIRT3(1 ∶500)和β-actin(1 ∶1000)抗体,在4 ℃下孵育过夜。次日TBST洗膜3次,加入辣根过氧化物酶标记山羊抗兔IgG(1 ∶1000)为二抗,在室温下孵育2 h。再次TBST洗涤3次,滴加ECL发光液进行显影,采用Image J图像分析软件统计各条带灰度值并计算各蛋白表达水平。
四、统计学处理
结 果
一、藏红花素改善 COPD 大鼠肺功能指标
大鼠肺功能检测结果显示,与空白对照组比较,COPD组、COPD+低剂量藏红花素组及COPD+高剂量藏红花素组的肺功能指标PEF、PIF、FEV 0.3/FVC均显著下降(P<0.01);与COPD组比较,COPD+低剂量藏红花素组与COPD+高剂量藏红花素组PEF、PIF及FEV 0.3/FVC均显著升高(P<0.01),且COPD+高剂量藏红花素组PEF、PIF、FEV 0.3/FVC显著高于COPD+低剂量藏红花素组(P<0.01)(见表1)。
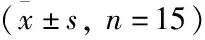
表1 各组大鼠相关肺功能指标检测结果
二、藏红花素抑制 COPD 大鼠肺组织病理损伤
各组大鼠肺组织HE染色结果(见图1)所示,空白对照组大鼠肺组织的肺泡结构清晰,间隔正常,肺泡壁完整,无明显炎细胞浸润、充血、渗出等现象。COPD组肺组织中可见肺泡结构破坏,断裂,相邻肺泡腔相互融合成肺大疱,出现大量炎性细胞浸润。COPD+低剂量藏红花素组与COPD+高剂量藏红花素组大鼠肺组织肺泡破裂融合以及炎性细胞浸润等情况较COPD组大鼠有所改善,且COPD+高剂量藏红花素组大鼠病理损伤改善更为明显。
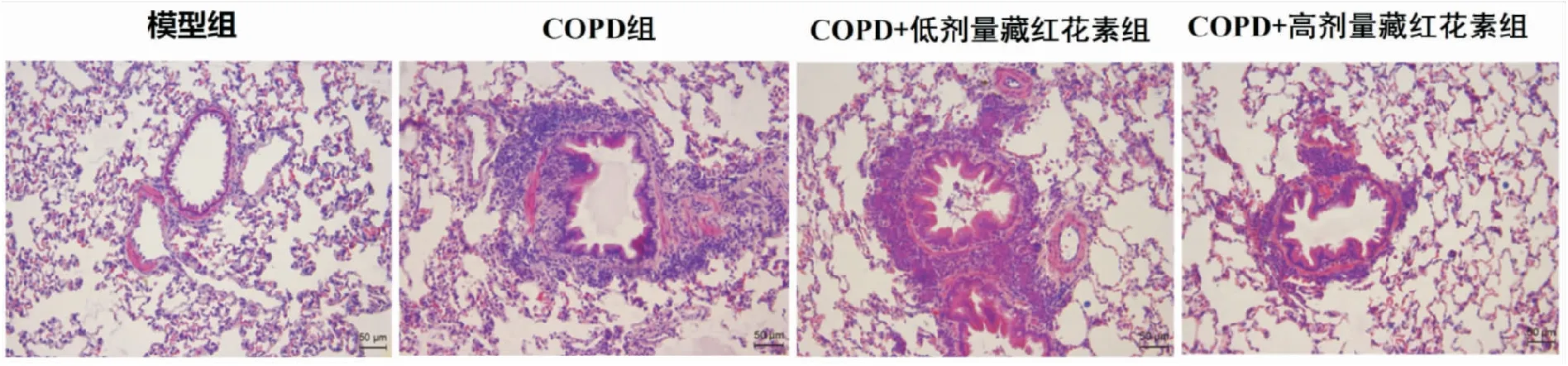
图1 HE染色观察各组大鼠肺组织病理损伤情况(×400)
三、藏红花素降低COPD 大鼠血清和BALF中炎症因子表达
各组大鼠血清和BALF中炎症细胞因子检测结果显示,与空白对照组比较,COPD组、COPD+低剂量藏红花素组、COPD+高剂量藏红花素组,大鼠血清和BALF中IL-1β、IL-6、TNF-α含量显著增加(P<0.01);与COPD组比较,COPD+低剂量藏红花素组与COPD+高剂量藏红花素组,血清和BALF中IL-1β、IL-6、TNF-α含量显著下降(P<0.01);而COPD+高剂量藏红花素组血清及BALF中IL-1β、IL-6、TNF-α含量较COPD+低剂量藏红花素组显著下降(P<0.01)(见表2、3)。
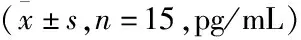
表2 各组大鼠血清中炎症细胞因子表达情况
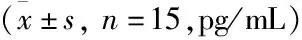
表3 各组大鼠BALF中炎症细胞因子表达情况
四、藏红花素抑制大鼠肺组织肺泡上皮细胞凋亡
各组大鼠肺组织TUNEL染色结果显示,COPD组、COPD+低剂量藏红花素组、COPD+高剂量藏红花素组肺组织肺泡上皮细胞中出现较多棕黄色着色的细胞,细胞凋亡率较空白对照组均显著上升(P<0.01);与COPD组比较,COPD+低剂量藏红花素组与COPD+高剂量藏红花素组肺泡上皮细胞凋亡率显著下降(P<0.01);且COPD+高剂量藏红花素凋亡细胞率较COPD+低剂量藏红花素组下降更为明显(P<0.01)(见图2,表4)。
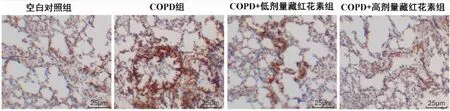
图2 TUNEL染色检测各组大鼠肺组织肺泡上皮细胞凋亡情况(×400)

表4 各组大鼠肺组织肺泡上皮细胞凋亡情况
五、藏红花素激活PGC-1α/SIRT3信号通路
qRT-PCR和Western blot分别检测大鼠肺组织中PGC-1α、SIRT3 mRNA与蛋白的表达水平,结果显示,与空白对照组比较,COPD组、COPD+低剂量藏红花素组、COPD+高剂量藏红花素组肺组织中PGC-1α、SIRT3 mRNA与蛋白表达量均显著下调(P<0.01);与COPD组比较,COPD+低剂量藏红花素组中PGC-1α mRNA和蛋白表达量均显著上调(P<0.01),而SIRT3在mRNA水平中表达上调(P<0.01),其蛋白水平无统计学差异,COPD+高剂量藏红花素组肺组织中PGC-1α、SIRT3 mRNA与蛋白表达量均显著上调(P<0.01);且COPD+高剂量藏红花素肺组织中PGC-1α、SIRT3 mRNA与蛋白表达量较COPD+低剂量藏红花素组显著上调(P<0.01),(见表5、6,图3)。
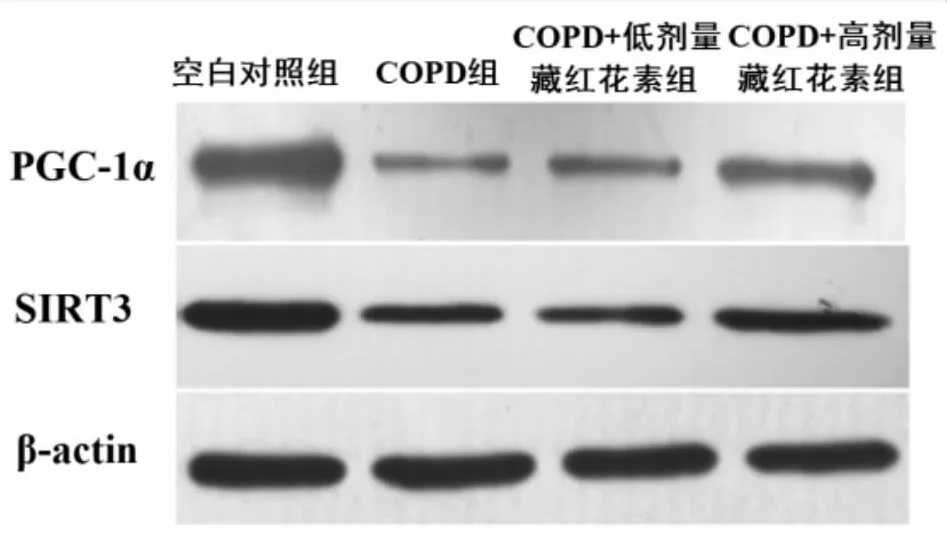
图3 Western blot检测各组大鼠肺组织中PGC-1α、SIRT3蛋白表达
表5 各组大鼠肺组织中PGC-1α、SIRT3 mRNA表达水平比较
讨 论
COPD通常是由于接触有害气体或颗粒引起的,伴有咳嗽、咯痰、气喘、胸闷以及呼吸困难等症状,COPD现已成为呼吸道疾病较高死亡率和发病率的主要病因[3,5]。长期向COPD患者使用固定药物治疗剂(例如抗生素)可能会丧失此类药物的功效,并产生不良的副作用[12],因此,在现有的各种治疗策略中,仍需不断探索新的药物来治疗COPD。
表6 各组大鼠肺组织中PGC-1α、SIRT3 蛋白表达水平比较
COPD的发病机理复杂,主要包括氧化应激,蛋白酶和抗蛋白酶失衡,组织纤维化以及炎症、上皮等结构性细胞在COPD发病过程中共同释放炎性介质等,而异常炎症反应与COPD病情进展密切相关[13]。越来越多的研究表明,炎症因子在COPD的气道炎症反应中起着重要作用[14]。本实验采用烟熏联合气道内注射脂多糖的方法建立COPD大鼠模型,经检测发现大鼠肺组织出现肺泡结构破坏、大量炎性细胞浸润等明显病理改变,说明COPD大鼠模型构建成功。进一步研究结果显示,COPD大鼠血清和BALF中IL-1β、IL-6、TNF-α含量明显增加。而在不同剂量藏红花素干预的大鼠中,肺组织中肺泡破裂、炎性细胞浸润等情况较COPD大鼠有所改善,并抑制了血清和BALF中IL-1β、IL-6、TNF-α含量的增加,且高剂量藏红花素的作用效果更优。这一结果提示藏红花素可以降低COPD的炎症反应,并改善肺组织的病理损害。
正常的肺泡上皮细胞参与宿主防御,并具有修复损伤肺泡细胞的功能,在许多肺部疾病的肺泡重塑中起着至关重要的作用,肺泡上皮细胞的大量凋亡会导致肺泡-上皮屏障的破坏,并导致富含肺泡蛋白的肺水肿形成[15-16]。因此,改善或抑制肺泡上皮细胞凋亡也是治疗COPD的有效措施。在本研究中,COPD组大鼠肺组织中细胞核内含有大量棕褐色颗粒,表明肺泡上皮细胞凋亡数目较多,而使用不同剂量藏红花素干预后可明显降低肺泡上皮细胞的凋亡,同样,高剂量藏红花素抑制作用更为明显。这表明藏红花素可抑制肺泡上皮细胞凋亡,延缓COPD的进展。
常见的细胞凋亡途径分内源性途径与外源性途径,内源性途径又称线粒体途径[17]。过氧化物酶体增殖物激活受体γ辅助激活物1-α(PGC-1α)是一小类转录调节因子的成员,可调控与线粒体代谢、氧化应激等相关基因的表达[18]。去乙酰化酶3(SIRT3)作为PGC-1α的下游靶基因,主要位于线粒体基质中,并通过可逆酶脱乙酰作用调节线粒体脂肪酸的氧化,研究表明,PGC-1α可通过上调SIRT3表达,来增加去乙酰化酶活性,从而参与线粒体氧化代谢、细胞凋亡和信号调节等过程[19-20]。在本研究中,高剂量的藏红花素明显抑制了COPD大鼠肺组织中PGC-1α、SIRT3 mRNA与蛋白表达水平的下调,由此推测藏红花素可能通过PGC-1α/SIRT3通路参与COPD保护机制,这为藏红花素的临床应用提供了实验依据。但是,藏红花素在体内发挥功能的信号通路比较复杂,仍需进一步明确其相关信号转导机制并选择关键靶点。本课题后续将继续探讨藏红花素是否通过其它途径参与到COPD的病理改变中,此外,藏红花素与其他药物的联合应用对于COPD的作用尚缺乏研究,有待后续进行深入的探索,以期为精准治疗COPD提供指导。
综上所述,藏红花素对COPD大鼠具有一定的保护作用,可抑制炎症反应及降低肺泡上皮细胞的凋亡率,其机制可能与激活PGC-1α进而上调SIRT3表达有关。
