高分辨胸部CT定量分析对哮喘-慢阻肺重叠的应用研究
2020-11-10周凡周哲慧沈夏平邹海峰张景熙白冲
周凡 周哲慧 沈夏平 邹海峰 张景熙 白冲
慢性阻塞性气道疾病(Chronic obstructive airway diseases,COADs)是以固定性气流受限为特征的一组气道疾病的总称,除了代表性疾病慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)外,还见于存在气流受限哮喘(Asthma with airflow limitation, Asthma FL+)及哮喘-慢阻肺重叠症(Asthma-COPD overlap,ACO)患者,这些疾病不仅是呼吸科常见病、多发病,更日益成为患者呼吸健康的严重威胁,甚至危及生命,给个人社会带来沉重负担。已有研究认为,这三种疾病临床症状、肺功能改变具有一定相似性,但疾病进展和治疗手段及其预后等方面存在一定差异,目前鉴别手段较为有限。高效、快速、正确地识别三种疾病有助于临床医师正确采取针对性治疗,尽快缓解症状、改善患者预后。高分辨率计算机断层扫描(High resolution computed tomography,HRCT)实现了从影像学上对肺结构进行详细的解剖分析,具有无创安全、操作易行、不受患者主观因素影响等优点,是临床上广泛使用的肺病疾病检查手段。目前有关上述三种疾病中HRCT的影像特征差异,报道较少,本研究通过自动定量分析技术对上述三类患者的HRCT影像学特征进行测定,并比较彼此之间的异同,以期为临床上对这三种不同亚型的慢性阻塞性气道疾病进行鉴别诊断寻找有效、方便、无创的影像学指标提供帮助,报道如下。
资料与方法
一、一般资料
回顾性分析2018年1月~2019年6月于长海医院呼吸内科及上海交通大学附属第九人民医院黄浦分院内科门诊就诊并诊断COPD、Asthma FL+及ACO等93例慢性阻塞性气道疾病患者的临床资料。纳入标准:1、单纯慢阻肺(COPD):(1)明确慢阻肺病史(Global Initiative for Chronic Obstructive Lung Disease,GOLD);(2)存在气流受限[吸人支气管扩张剂后第1秒用力呼气容积(forced expiratory volume in the first second,FEVl)/FVC<0.7]、FEV1的改善<200 ml和<12%;(3)无哮喘或花粉热史。2、存在气流受限的哮喘(Asthma FL+):(1)患者既往有明确的哮喘病史和临床症状(Global Initiative for Asthma,GINA)(2)支气管扩张剂吸入后FEV1/FVC<0.7。(3)无吸烟史或有害烟雾暴露史。3、ACO:需符合3项主要标准及至少1项次要标准。主要标准:①40岁以上,有持续气流受限(支扩剂后FEV1/FVC<0.7或正常值下限)。②吸烟史至少10包年 或 与之相当的有害烟雾暴露史。③40岁之前确诊哮喘 或 支扩剂后 FEV1改善>400ml;次要标准:①明确的过敏史或过敏性鼻炎病史。②至少两次支扩剂后FEV1改善≥200ml及12%。③外周血嗜酸性粒细胞≥300/ul[1-2]。排除标准:(1)有其他呼吸道疾病史,如肺癌、气胸、胸水、支气管扩张,囊性纤维化、免疫缺陷、肺结核后遗症或肺破坏;(2)胸部畸形或肺切除;(3)CT检查前后4周内有感染或慢性阻塞性肺病加重的迹象;(4)支气管扩张剂使用后FEV1/FVC≥0.7[3]。按照肺功能和既往病史对符合纳入标准将患者分为三组:COPD组(n=36)、Asthma FL+组(n=23)及ACO组(n=34)。采集三组患者年龄、性别、吸烟史、实验室检查和影像学资料。
二、研究方法
1 计算机断层扫描和图像分析
CT扫描均在Philips Brilliance 128排256层iCT上进行,患者取仰卧位,在最大吸气末扫描整个肺野。扫描条件为120KV和自动毫安秒,扫描床速度146.4mm/s,旋转时间0.5s,扫描准直128×0.625mm,螺距0.915,FOV为35×35cm。低KV图像的扫描层厚为3-5mm,重建层厚1mm,用standard算法重建;放大靶扫描图像扫描层厚为1mm,同时用sharp-Y算法重建。CT图像分析:(1)气道参数测量:邀请2位影像科医师独立利用自动图像分析软件(富士胶片公司 Synapse 3D软件,日本东京)进行[4-5]。选择右肺上叶尖段支气管为测量目标,软件自动识别并将目标支气管重建成多平面图像,根据气道分叉区分第三级、第四级和第五级支气管。以各级气道的长轴中点为中心,以2mm为间隔截取5张垂直于气道长轴的横截面图,用图形切割法提取气道内外轮廓,并自动计算气道管壁面积百分比(WA%)、气道壁厚百分比(WT%),取其平均值为目标气道参数的最终结果。如果在自动提取气道轮廓时出现错误,则采用手动方法进行纠正。(2)肺气肿严重程度测量:利用Synapse 3D软件重建肺实质,自动进行低密度区的体积测算,根据每个双侧肺野的低衰减区(low attenuation area,LAA)面积计算哥达德指数(Goddard)[6]:0分,LAA ≤ 5%;1分,5% < LAA ≤ 25%;2分,25% < LAA ≤ 50%;3分,50% < LAA ≤ 75%;4分,75% < LAA,总肺气肿评分在0到24之间(图1、图2)。
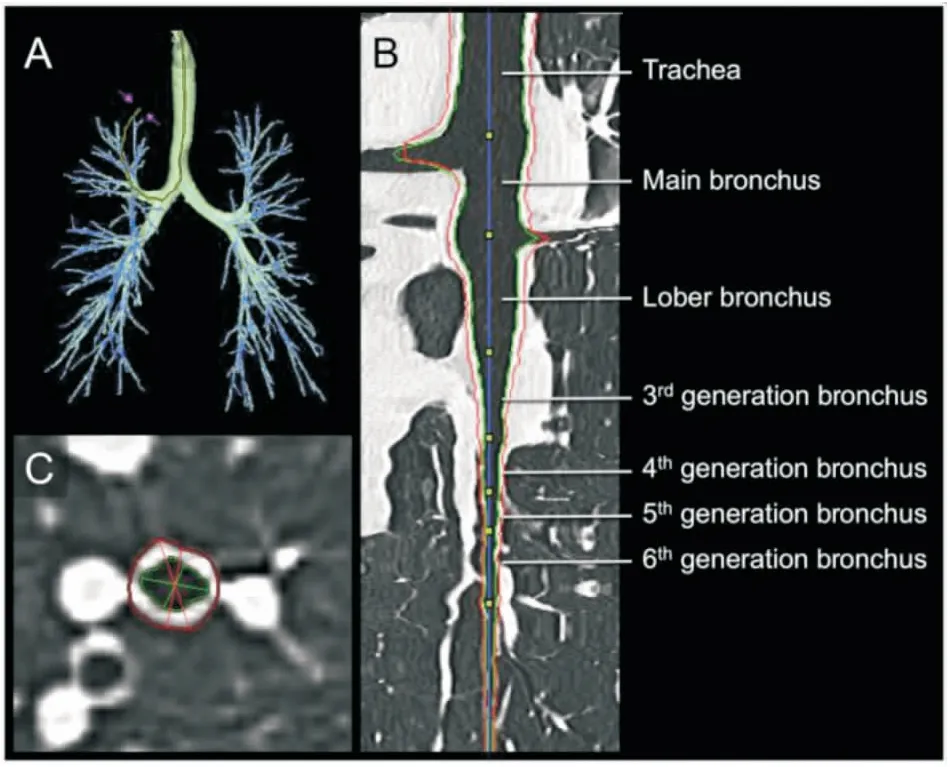
图1 Synapse 3D 自动重建及分析气道参数图示

图2 COPD、Asthma FL+及ACO三组患者Synapse 3D 自动分析图示
2 肺功能测定
采用美国森迪斯(SensorMedics)Vmax22肺功能仪对所有患者进行肺功能检查。(1)肺通气功能指标:用力肺活量(FVC)、第1秒最大呼气量(forced expiratory volume in the first second,FEV1)、1秒率(forced expiratory volume in the first second/forced vital capacity,FEV1/FVC);(2)支气管舒张试验:吸入万托林 400 μg 后 15 min 进行肺通气功能检查。记录 FVC 改变量(△FVC)、FVC 变化率(△FVC%)、FEV1改变 量(△FEV1)及 FEV1变化率(△FEV1%)。以吸入支气管舒张剂后 FEV1增加 200 mL,FEV1占预计值的百分比增加 12%为舒张试验的阳性标准。
3 观察指标
对比经图像后处理软件获得的三组患者的CT定量参数(气道参数、肺气肿指数)分析其差异性,通过差异显著指标鉴别COPD、Asthma FL+、ACO 患者的价值进行受试者工作特征曲线(Receiver operator characteristic curve,ROC 曲线)分析;同时分析肺功能指标和CT定量参数的相关性;
三、统计方法
结 果
一、三组患者基线资料对比
各组患者的年龄、病程和基础肺功能指标等一般资料比较,差异无统计学意义(P>0.05);三组患者中都是男性占多数,COPD组、ACO组与Asthma FL+组患者的性别比通过χ2检验有统计学差异(P<0.001),COPD组与ACO组患者的性别比相比无统计学差异;COPD组年龄较ACO组及Asthma FL+大。COPD组吸烟量较ACO组吸烟量偏高,差异有统计学意义(P=0.019),ACO组FEV1/FVC值低于COPD组及Asthma FL+组,各组间差异无统计学意义(见表 1)。
表1 三组患者基线资料对比
二、三组间气道参数分析及比较
1 各组WA%比较
Asthma FL+组第3级(3 rd)与COPD组、ACO组相比,差异具有统计学意义(P=0.029、0.047);COPD组与ACO组比较差异无统计学意义(P=0.832);Asthma FL+ 组第4级(4th)与COPD组比较,差异有统计学意义(P=0.019);COPD组与ACO组比较,差异无统计学意义(P=0.173),Asthma FL+组与ACO组差异无统计学意义(P=0.256);Asthma FL+组第5级(5th)与COPD组、ACO组比较,差异有统计学意义(P=0.002;、0.004),COPD组与ACO组差异无统计学意义(P=0.846)。各组WT%比较:Asthma FL+组第3级(3rd)与COPD组、ACO组比较,差异有统计学意义(P=0.041、0.032),COPD组与ACO组比较差异无统计学意义(P=0.878);Asthma FL+组第5级(5th)与COPD组及ACO组比较,差异有统计学意义(P=0.009、0.040),COPD组与ACO组比较差异无统计学意义(P=0.524)(见表2)。
2 通过气道参数鉴别Asthma FL+与ACO
通过3rd-5th WT%鉴别ACO与气流受限哮喘,ROC曲线下面积分别为0.685、0.557 和 0.668,3rd WT%指标具有较好的诊断价值(AUC=0.685,95%CI:0.545~0.826,P=0.018),从图中得出最佳界值为33.7%(灵敏度 87% 特异度 52.9%,约登指数为0.340)(见图 3)。
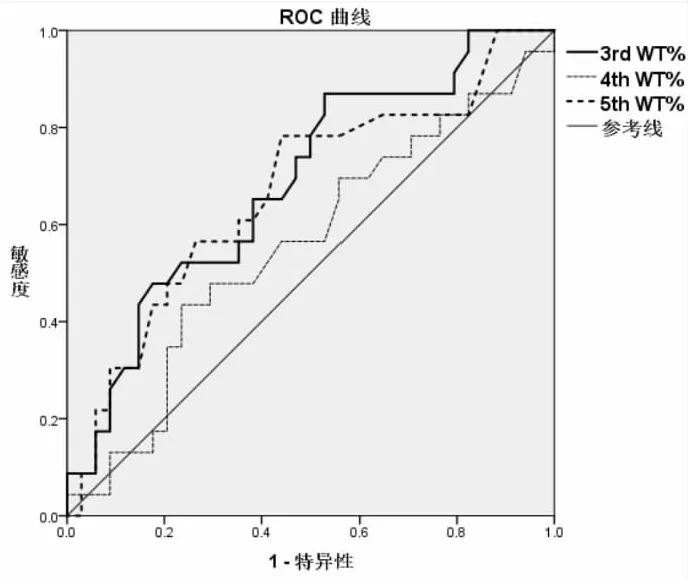
图3 3rd WT%鉴别气流受限哮喘与ACO的ROC曲线
通过3rd-5thWA%鉴别ACO与气流受限哮喘,ROC曲线下面积分别为0.672、0.562 和0.682,5th WA%指标具有较好的诊断价值(AUC=0.682,95%CI:0.536~0.827,P=0.021),最佳界值为63.5%(灵敏度 43.5% 特异度 88.2%,约登指数为 0.317)(见图 4);通过3rdWT%联合5thWA%鉴别ACO与气流受限哮喘,ROC曲线下面积为0.744,95%CI:0.608~0.880,P=0.002(敏感度 82.4% 特异度 60.9%,约登指数为 0.432)(见图5)。
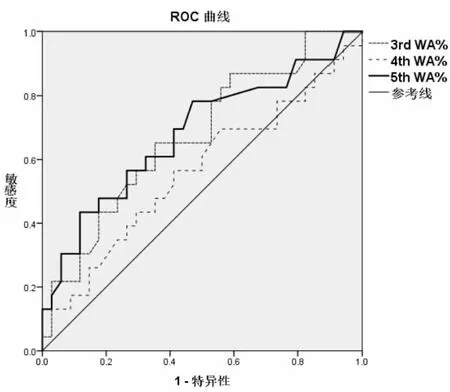
图4 5th WA% 鉴别气流受限哮喘与ACO的ROC曲线

图5 3rdWT%联合5thWA%鉴别气流受限哮喘与ACO的ROC曲线
三、三组间肺气肿指数比较
1 COPD组、ACO组及Asthma FL+组哥达德指数(Goddard)评分分别为12.36±2.03、9.26±3.31、8.17±2.61,COPD组哥达德指数高于ACO组、Asthma FL+组,差异均有统计学意义(P<0.001);ACO组 与Asthma FL+组比较无统计学意义(P=0.137)。
2 通过肺气肿指数鉴别COPD与ACO 哥达德指数评分ROC曲线下面积为(0.777,95%CI:0.663~0.890(P<0.001),得出最佳界值为9.5(灵敏度 92.7% 特异度 55.9%,约登指数为 0.531)(见图 6)。
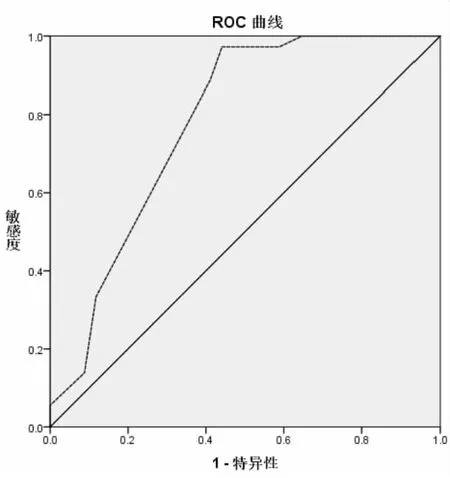
图6 哥达德评分鉴别COPD与ACO的ROC曲线
四、肺功能指标与定量CT参数相关性分析
将三组患者的气道参数、肺气肿指数与肺功能行Spearman相关性分析,COPD、ACO、Asthma FL+患者的4th(WA%、WT%)与FEV1/FVC呈负相关,相关性无统计学意义;COPD 5th(WA%、WT%)指标与FEV1/FVC呈负相关,相关性有统计学意义(r=-0.514,P=0.001;r=-0.499,P=0.002);ACO 5th(WA%、WT%)指标与FEV1/FVC呈负相关,相关性有统计学意义(r=-0.402,P=0.019;r=-0.358,P=0.038);Asthma FL+ 5th(WA%、WT%)与FEV1/FVC呈负相关,相关性有统计学意义(r=-0.454,P=0.030;r=-0.489,P=0.018);三组患者的Goddard评分与FEV1/FVC呈负相关,且ACO患者的Goddard评分与FEV1/FVC相关性有统计学意义(r=-0.393,P=0.022)(见表3)。

表3 COPD、Asthma FL+及ACO三组患者肺功能指标与定量CT参数相关性分析
讨 论
本研究在筛选哮喘病人时未纳入吸烟者。既往研究表明[7]长期吸烟的哮喘患者的肺功能及气道特征与ACO患者相比无明显统计学差异,且将吸烟的气流受限哮喘患者归入ACO组,将这部分患者排除可以更好的了解ACO与气流受限哮喘病程进展中的气道差异。
气道重塑被认为参与气流受限的发生发展,其机制包括黏液分泌增加、上皮增生和平滑肌肥大等导致管腔狭窄[8]。早期的研究发现COPD的气道重塑以中性粒细胞、巨噬细胞、CD8+T淋巴细胞浸润为主,气道活检表现炎症细胞浸润表层上皮,导致气管壁损伤和修复反复发生,病变主要在远端小气道。哮喘的气道重塑以嗜酸粒细胞肥大细胞和CD4+T淋巴细胞浸润为主,气道活检标本表现为杯状上皮细胞纤毛倒伏、脱落、坏死,黏膜腺增生,基底膜增厚,平滑肌增生,支气管壁增厚等,病变主要在近端气道[9]。近期有研究发现ACO患者的气道重塑同时存在中性粒细胞、嗜酸性粒细胞浸润[10-11]。不同的重塑模式反映了这三种慢性阻塞性气道疾病炎症过程的根本性差异,并可能影响气流受限的可逆性。直径小于等于2 mm的远端气道是气流受限的常见部位[12],然而,远端气道的图像很难获得。研究表明[13]近端气道的测量可用于粗略评估和间接反映远端小气道的病变。且通过定量CT气道参数(如WT%、WA%)可以评价气道重塑的严重程度及气流受限程度[14-15]。
Kitaguchi[6]等人通过视觉评估方法证明了气流受限哮喘患者气道壁增厚较COPD、ACO更加明显,我们的研究结果与其一致;Fabbri[16]等人通过支气管镜活检发现,气流受限哮喘患者的气道的基底膜为6.6-9.7μm,而COPD则为4.2-6.2μm,提示气流受限哮喘患者的气道壁增厚与基底膜平滑肌肥大增厚有关。在本次研究中,我们通过自动定量分析软件测量ACO组的4th、5th气道WA%、WT%较COPD组更大,但差异无统计学意义,而asthma FL+组与COPD、ACO组相比3rd、5th级气道WA%、WT%数值更大,差异有统计学意义。这说明asthma FL+组患者的近端气道壁增厚更明显,从影像学的角度证明了其气道重塑主要位于近端气道,这也可能是导致其气流受限不可逆的原因之一。ACO与COPD患者则影像学上的近端气道特征类似,两者的气道重塑程度可能有共同特点。
本研究同时对这三组患者进行了肺气肿指数的测量。肺气肿是指远端气道弹性减退,过度膨胀、充气和肺容积增大或同时伴有气道壁破坏的病理状态。本次研究我们使用了Synapse 3D软件通过自动分析低密度区占正常肺实质的比例,计算出哥达德评分来比较三组患者的肺气肿严重程度。我们观察到三组患者均存在一定程度的肺气肿情况,ACO患者的肺气肿指数低于COPD患者,两者的差异明显;而与气流受限哮喘相比肺气肿指数偏高,但两者的差异不明显,这与既往的研究类似[6],GAO Y[17]等人在比较单纯COPD与ACO发现,两组患者均有明显的肺气肿但ACO的肺气肿指数较低。ACO患者在吸烟指数较低的情况下之所以肺气肿程度比单纯COPD组轻,其可能机制为哮喘患者气道自幼年起即可出现炎性改变、气道重塑及气道狭窄,吸入烟雾无法抵达更深远的微小气道或肺泡,所以对肺泡破坏性较少有关,而此类患者通常表现为支气管炎型的临床表型。临床上所见到支气管炎型患者通常对吸入性糖皮质激素反应较好[18],这一现象也可能与此型患者其实是ACO表型有关。
此外,我们还分析了气道参数与肺气肿指数对三组患者的鉴别诊断价值,通过ROC曲线我们发现3rd WT%+5th WA%联合鉴别气流受限哮喘与ACO的价值更高,哥达德肺气肿指数对于鉴别COPD与ACO有一定的价值。然而临床医生很难直接从患者的肺部CT图像获取这些数据,既往的很多研究都是凭借影像科医师进行人工测量及视觉评估来获取患者的气道参数和肺气肿严重程度从而进一步分析阻塞性气道疾病的差异,我们使用自动定量分析软件(Synapse 3D)使这一过程更简便, 避免了人为测量及图像质量造成的干扰因素,使得到的数据更可靠,更可信[19]从而更加方便的对ACO患者进行鉴别。
将三组患者的定量CT参数与肺功能指标进行相关性分析后发现。COPD、ACO、Asthma FL+的气道参数4th、5th(WT%、WA%)与FEV1/FVC呈负相关,且5thWT%、5thWA%与FEV1/FVC相关性明显,且有统计学意义,这与既往的研究类似[20-22]。COPD、Asthma FL+患者的哥达德肺气肿指数也与FEV1/FVC呈负相关,但相关性无统计学意义,既往有研究发现气道阻塞性疾病如COPD、哮喘患者的肺气肿严重度与FEV1/FVC相关性不明显,FEV1/FVC的原理是通过测定整个呼吸道特别是近端气道(包括口腔、气管、支气管)的气流量来间接反映肺功能状况。而影响肺气肿指数的解剖部位是终末细支气管远端(包括呼吸细支气管、肺泡管、肺泡囊及肺泡)的气道弹性减退、肺容积增大、过度充气和膨胀、同时伴随肺泡壁的破坏。两项指标所反映的解剖部位不同,故可能相关性不明显。在本次研究中发现 ACO患者的哥达德肺气肿指数与FEV1/FVC相关性明显且有统计学意义,说明ACO患者的气道重塑对肺功能的影响较另外两种疾病更复杂,其远端气道重塑后的改变影响到了近端气道的功能,使两者出现了一定的相关性。我们没有将CT气道测量值与吸入支气管舒张剂后的FEV1变化值关联并进一步讨论,因为既往已有研究证明近端气道壁厚度(WT)、气道壁面积百分比(WA%)都与FEV1变化值相关[23],而且我们在选取研究对象时已经明确了三组患者的FEV1改善率有明显差异。
本研究有以下几个局限性。首先,这项研究是回顾性的,参与这项研究的患者数量相对较少。确认我们的结果有必要进行大样本的前瞻性研究。第二,本项研究没有进行组内的病情严重度的评估,只讨论了三种疾病的整体差异。是否需要考虑每组内的病例互相之间也有差异,ACO也有其异质性,是否也有不同的表型特点,这可能影响到整体的比较。第三、气道参数的测量我们借助CT图像的自动分割和处理软件进行,缺乏支气管活检数据进一步的分析气道病理差异,也未对远端气道的破坏、缺失,进一步分析,这将是我们未来进一步研究的重点。第四,与大多数评估气道结构的研究一样,每一次CT扫描都是在完全吸气的情况下进行的。呼气CT成像可能揭示呼吸困难和气道结构之间的进一步相关性。
综上所述,慢性阻塞性肺疾病、存在气流受限哮喘及哮喘-慢阻肺重叠三组患者高分辨胸部CT表现存在一定差异,ACO患者的近端气道参数、肺气肿指数与肺功能的相关性更显著且独特,3rdWT%联合5thWA%及肺气肿指数的自动定量测定有助于慢性阻塞性气道疾病亚型的鉴别,对于那些无法完成肺功能检测的患者评价其气流受限严重程度具有潜在的临床预测价值。
