荧光染色法检测γ-环糊精DNA残留量方法验证研究
2020-11-10陈凌王永智雷高新邱文娜乔正鲍丽董达文
陈凌,王永智,雷高新,邱文娜,乔正,鲍丽,董达文
作者单位:225300 江苏,泰州医药高新技术产业园区疫苗工程中心(陈凌、王永智、雷高新、邱文娜、乔正、鲍丽);225300 泰州,扬子江药业集团有限公司(董达文)
γ-环糊精(γ-cyclodextrin,γ-CD)是环糊精糖基转移酶作用于淀粉、糖原、麦芽、寡聚糖等葡萄糖聚合物后形成的,由 8 个 D-吡喃葡萄糖基以 α-1,4-糖苷键首尾连接成的环形低聚糖[1]。由于极性羟基基团存在,环糊精具有内疏水外亲水的特性,可通过氢键、疏水作用等分子间作用力与多种有机化合物形成包合物,以此增加包合物的稳定性,改变包合物的溶解度、释放速度、气味等理化性质,因此 γ-环糊精广泛应用于食品及医药等领域[2-4]。但是 γ-环糊精生产过程中环糊精糖基转移酶主要从软腐芽孢杆菌、嗜碱芽孢杆菌等微生物中获得,其生物安全性备受关注,特别是外源 DNA 残留量的检测尤为重要[5]。
《中国药典》三部(2015 版)《外源性 DNA 残留量测定法》收录的 DNA 残留量测定方法有 DNA 探针杂交法和荧光染色法[6]。荧光染色法是应用双链 DNA 荧光染料与双链 DNA 特异性结合形成复合物,在波长 480 nm 激发下产生荧光信号,可用荧光酶标仪在波长 520 nm 左右进行检测,在一定的 DNA 浓度范围内以及在该荧光染料过量的情况下,荧光强度与 DNA 浓度成正比,根据检测样品的荧光强度,对 DNA 进行定量测定。该方法比起 DNA 探针杂交法,操作简单、干扰因素少、周期短,并且能定 量分析[7-8]。所以本实验应用荧光染料 PicoGreen 试剂,对 γ-环糊精 DNA 残留量进行检测并进行方法验证的研究。
1 材料与方法
1.1 材料
γ-环糊精由江苏某制药公司提供,批号:20171005;Quant-iT™ PicoGreen®dsDNA Assay Kit、含 DNA 标准品(100 μg/ml)、双链 DNA 荧光染料、20 × TE buffer 均购自美国 Life Technologies 公司;多功能酶标仪 Thermo Varioskan Lux 由美国 Thermo 公司生产;96 孔黑色酶标板由美国 Corning 公司生产;Denver Instrument TP-202 型电子天平由美国丹佛仪器公司生产;移液器由德国 Eppendorf 公司生产。
1.2 方法
1.2.1 样品配制 无菌注射用水稀释 20 × TE buffer(1:20),γ-环糊精适量,用稀释后的 1 × TE buffer 溶解配成 200 mg/ml 的样品溶液。
1.2.2 标准曲线建立 DNA 标准品用 1 × TE 缓冲液配成 125、25、5、1、0.2、0.04、0 μg/ml 系列浓度 DNA 标 准溶液。取 100 μl DNA 标准溶液加入 96 孔酶标板,加入等体积 PicoGreen 染料试剂混匀,室温静置 5 min,用荧光酶标仪在激发波长 480 nm、发射波长 520 nm 处测得荧光强度。以 DNA 标准品溶液的浓度(ng/ml)对其相应的荧光强度(A)绘制标准曲线,求得回归方程。
1.2.3 专属性 本实验所用 DNA 荧光染料对 dsDNA 具有较强的特异性,故本实验中对 γ-环糊精溶液的溶剂 1 × TE 缓冲液进行了考察,按照 1.2.2 方法检测 DNA 浓度。
1.2.4 准确度 γ-环糊精样品加入 DNA 标准品,制成含 DNA 标准品终浓度分别为 100、50、10 ng/ml 的γ-环糊精溶液。其中,γ-环糊精溶液的终浓度为 200 mg/ml。精密吸取上述溶液各 100 μl 加入 96 孔酶标板(n = 3),各孔加入荧光染料溶液 100 μl,按 1.2.2 方法测得的溶液 DNA 浓度(ng/ml),计算回收率和相对标准偏差。
回收率(%)=(实测加标样品浓度-样品浓度)/加入对照品浓度 × 100%
1.2.5 重复性 精密吸取浓度为 50 ng/ml 的 DNA 标准品溶液 100 μl 至 96 孔黑色酶标板(n = 6),分别加入 dsDNA 荧光染料溶液 100 μl,混匀制得终浓度为 25 ng/ml的重复性测定用溶液,按照 1.2.2 方法测得的溶液 DNA 浓度,计算 RSD,考察方法的重复性。
1.2.6 耐用性 考察溶解时间对样品 DNA 残留量的影响,称取 γ-环糊精样品 200 mg,以 1 × TE 缓冲液进行溶解配成 200 mg/ml 的样品溶液,37 ℃ 分别放置 0、1、2、3、4、5 h 后按照 1.2.2 方法测得的溶液 DNA 浓度,计算测定结果 RSD,考察样品溶液的稳定性。
2 结果
2.1 线性和灵敏度
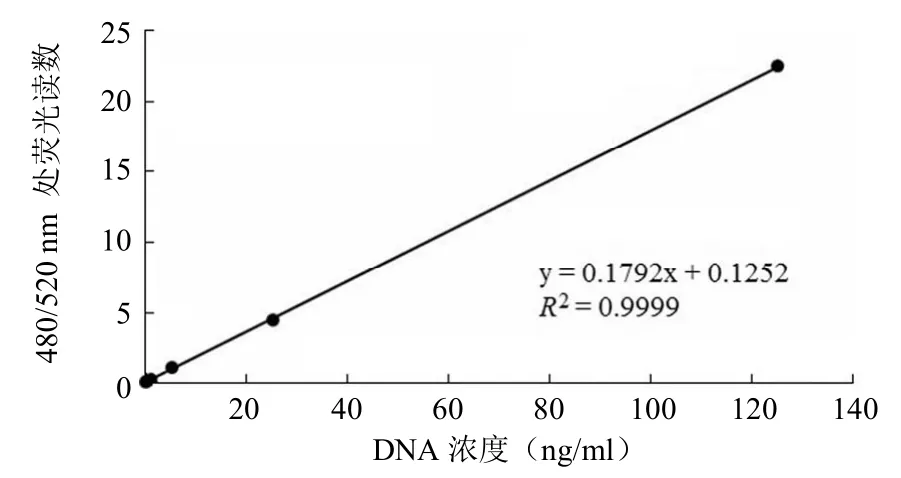
图1 DNA 标准曲线
复孔检测结果显示,当 DNA 浓度为 0.04 ng/ml 时,其荧光强度与空白溶剂基本相当;而当 DNA 浓度为 0.2 ng/ml 时,荧光强度较高,能明显检出,因此该法的最 低检出限定为 0.2 ng/ml,根据绘制得到标准曲线线性方 程 y = 0.1792x + 0.1252,R2= 0.9999,表明该法在 0.2 ~ 125 ng/ml 范围内线性较好(图 1)。
2.2 专属性
DNA 荧光染料 PicoGreen 对 dsDNA 具有较强的特异性,所以本实验中对 γ-环糊精溶液的溶剂 1 × TE 缓冲液进行了考察,按照 1.2.2 方法对其检测 DNA 浓度,计算得到 TE 溶剂平均浓度为 0.005 ng/ml(n = 6),SD 为 2.38%,表明溶剂对该法测定无干扰。
2.3 准确度
γ-环糊精高、中、低 3 种不同 DNA 加标浓度样品 回收率在 90% ~ 110% 范围内(表 1),表明该法准确性 良好。
2.4 重复性
6 个重复样品检测值之间的 RSD 为 2.32%,小于 10%(表 2),表明该方法重复性良好。
2.5 耐用性
不同处理时间,样品 DNA 残留浓度分别为 3.05、2.98、3.25、2.75、2.84、3.05 ng/ml,RSD 为 5.95%,样品具有良好的稳定性(表 3)。
3 讨论
关于外源性 DNA 残留量检测,各国药典收录的附录方法不尽相同,《中国药典》收录了杂交法和荧光染色法,《美国药典》收录了定量 PCR 法,而《欧洲药典》仅收录了 DNA 杂交法[9]。杂交法利用固定在膜上的变性宿主细胞 DNA 与标记酶、生物素、放射性同位素或地高辛等标记的 DNA 序列进行杂交[10],其灵敏度很高,可达到 10 pg 左右,但杂交法操作费时费力,无法进行定量分析[11]。荧光定量 PCR 法(简称 qPCR)是近年来最受关注的 DNA 检测方法,其原理是在 PCR 反应体系中加入荧光基团,利用荧光信号积累实时监测整个 PCR 进程,最后通过标准曲线对未知模板进行定量分析的方法[9]。qPCR 所使用的荧光物质可分为两种:荧光探针和荧光染料,其中荧光探针法检测下限可达到 10 fg[12]。作为 DNA 检测的最新技术,qPCR 法操作相对简单、特异性高、灵敏度很高,相信在不久的将来会得到更广泛的应用。
本研究采用的荧光染色法,应用荧光染料与双链 DNA 特异性结合形成复合物,根据检测样品的荧光强度,对 DNA 进行定量测定。此方法与 qPCR 相比,存在特异性差,灵敏度低的不足,但是本实验通过验证,该方法线性、特异性、准确度、耐用性和重复性都很好,可以快速、精准地定量 γ-环糊精中残留 DNA 含量。

表1 γ-环糊精样品加标回收率
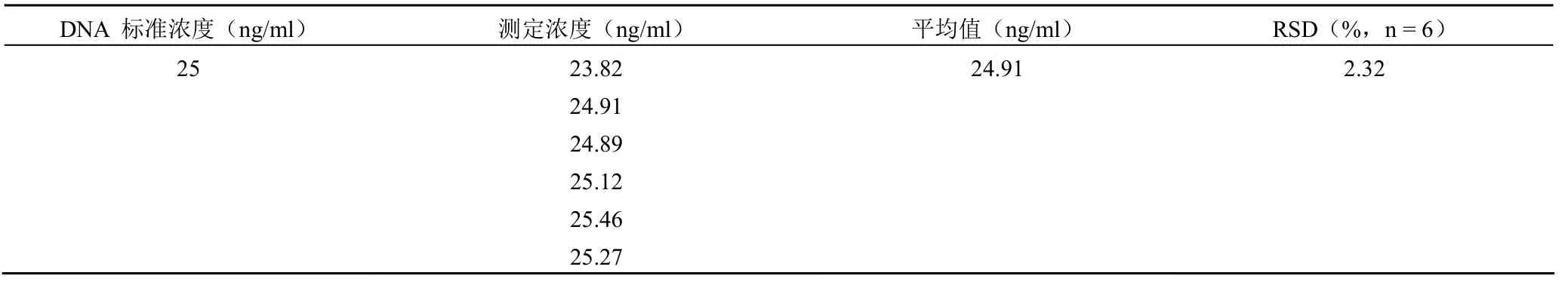
表2 方法的重复性试验结果

表3 样品溶液稳定性考察结果
另外值得注意的是,虽然荧光染色法操作更简单、周期短、成本低、效益更高,但在实际的使用过程中荧光染色法容易受盐类物质如氯化钠、醋酸钠以及蛋白类物质如白蛋白、IgG 的影响,所以不适用大剂量蛋白样品的检测,一般适宜用于含小剂量蛋白(如疫苗)或几乎不含蛋白(如 γ-环糊精)制品 DNA 含量的快速检测。
