人脂肪间充质干细胞条件培养基冻干粉促进皮肤成纤维细胞迁移、细胞外基质合成和抑制巨噬细胞炎症
2020-11-10陈应炉宋晓乐雷继刚任程洁戴成祥
陈应炉,宋晓乐,雷继刚,任程洁,戴成祥
间充质干细胞(mesenchymal stem cells,MSCs)是一类能够自我更新和具有多向分化潜能的多能干细胞,广泛存在于全身多种组织中,如骨髓、脐带、胎盘、外周血和脂肪等,间充质干细胞能治疗心肌梗死、大脑和脊髓损伤、脑卒中、糖尿病、软骨和骨骼损伤、克罗恩病和移植物抗宿主病等多种疾病[1],全球已经有多款间充质干细胞产品获批上市[2]。研究发现间充质干细胞在缓解疾病方面的作用被归因于它们的细胞因子分泌和免疫调节,而不是它们分化成所需细胞的能力[3-4]。间充质干细胞因为出厂有效期较短,同时需要冷链运输,在使用时并不方便。间充质干细胞分泌条件培养基中包含多种生长因子、细胞因子、趋化因子、血管生成因子和外泌体,以及外泌体微囊泡包裹的蛋白、脂类、miRNA、lncRNAs 等,这些物质更容易制造、冷冻干燥、包装和运输[1,5],其在促进细胞的迁徙、增殖和抗炎中有显著效果[6-9]。此外,因为它没有细胞,不需要匹配供体和受体来避免排斥问题,使用相对安全。因此,干细胞条件培养基在再生医学中具有广阔的应用前景[10]。近年来,间充质干细胞及相关产品在化妆品行业应用也越来越广泛。
随着年龄的增加,皮肤老化是一个不可避免的进程[11]。这主要与皮肤再生能力的下降和重塑能力降低有关[12]。随着时间的推移,皮肤真皮层中的胶原蛋白和弹性蛋白的总量也会减少,导致的组织成 分发生质的退化[13]。这些过程导致面部皮肤松弛、褶皱和表面变化,包括皮肤粗糙和干燥病。条件培养基中的细胞因子、生长因子和外泌体等在促进胶原蛋白和弹性蛋白合成中有显著效果[8,14],尤其是人脂肪间充质干细胞分泌的 TGF-β1、bFGF、EGF、PDGF-BB、HGF 和 VEGF 等在促进皮肤损伤修复、胶原蛋白和透明质酸合成中起重要作用[15]。但是条件培养基常温保存容易失效,而且容易滋生细菌造成污染,运输和使用不便。因此,将条件培养基冻干能显著增加其稳定性,延长有效期[16]。人脂肪间充质干细胞条件培养基冻干粉(human adipose-derived mesenchymal stem cells conditioned medium lyophilized powder,hADMSCs-CMLP)是一个很好的选择,其生物材料取材方便、来源丰富、安全效果好、无伦理争议、容易大规模生产、易存储和运输。本文以人脂肪间充质干细胞条件培养基冻干粉为原料,以人成纤维细胞和小鼠巨噬细胞为模型,探讨了冻干粉水化后在细胞模型中对细胞迁移、细胞外基质合成影响和抗炎作用。
1 材料与方法
1.1 材料
1.1.1 试剂与耗材 人皮肤成纤维细胞 HFF-1 购自中国科学院典型培养物保藏委员会细胞库;小鼠单核巨噬细胞白血病细胞 Raw264.7 购自武 汉普诺赛生命科技有限公司;FITC-CD73、PerCP/Cy5.5-CD90 、 APC-CD105 、 PE-CD34 、FITC-HLA-DR、FITC Mouse IgG1、PE Mouse IgG1、APC Mouse IgG1、PerCP/Cy5.5 Mouse IgG1 购自美国 Biolegend 公司;基因引物购自美国 Invitrogen 公司;灭菌注射用水购自山东华鲁制药有限公司;RNA 小量提取试剂盒购自美国 Qiagen 公司;胰蛋白酶、α-MEM、DMEM 和反转录试剂盒购自美国 Thermo Fisher 公司;EliteGro 血清替代物购自 EliteCell 公司;成骨、成脂、成软骨诱导分化试剂盒 购 自 Sciencell 公司;Radius™24-Well Cell Migration Assay 购自美国 Cell Biolabs 公司;Transwell 小室购自美国 BD 公司;脂多糖(LPS)、CellTiter-Lumi™Plus 发光法细胞活力检测试剂盒、mouse IL-6 ELISA kit 和 mouse TNF-α ELISA kit 检测试剂盒购自碧云天生物技术公司。qRT-PCR 基因探针引物 COL1A1(ID:Hs00164004_m1)、FN1(ID:Hs01549976_m1)、ELN(ID:Hs00355783_m1) 和 MMP1(ID:Hs00899658_m1)均购自美国 Thermo Fisher 公司。
1.1.2 仪器 1374 型 II 级生物安全柜、Quant StudioD 实时荧光定量 PCR 仪、自动细胞计数仪和 ST-16R 低温离心机为美国 Thermo 公司产品;酶标仪为 Bio-Rad 产品;MCO-20AIC 型 CO2培养箱为日本三洋公司产品;1800 系列-190 气相液氮罐为美国 MVE 公司产品;FACS Calibur 流式细胞仪为美国 BD 公司产品;Celldiscoverer 7 活细胞工作站为德国蔡司公司产品;LYO-0.5 型冻干机为上海东富龙科技股份有限公司产品。
1.2 方法
1.2.1 人脂肪间充质干细胞培养和表面标志物鉴定 待 P3 代 hADMSCs 细胞长满 80% 左右,用 0.25% 胰酶消化 3 min,离心收集细胞,用 PBS 调整细胞密度为 6 × 106个/ml,取 1 ml 细胞,分别加入鼠抗人单克隆标记抗体 FITC-CD73、PerCP/Cy5.5-CD90、APC-CD105、PE-CD34、FITC -HLA-DR,以鼠抗人的 IgG1-FITC、IgG1-PE、IgG1-APC、IgG1-PerCP/Cy5.5 作为同型对照,室温避光孵育 30 min,离心清洗后,经流式细胞仪上样检测。
1.2.2 人脂肪间充质干细胞三向分化检测 将 P3 代 hADMSCs 接种于六孔板中,接种细胞密度为 1 × 104个/ml,2 ml/孔,置于 37 ℃、5% CO2中培养,待细胞融合度达到 70% ~ 80% 时,弃去原培养基,分别更换为成脂和成骨诱导分化培养基,成软骨置于 15 ml 离心管培养,每 3 天更换一次培养基。成脂、成骨诱导 21 d 后,分别用油红 O 染液、茜素红 S 染液染色,成软骨诱导 28 d 后,成软骨的软骨小球先固定切片后用阿利新蓝染色,在倒置相差显微镜下观察 MSCs 的成脂、成骨、成软骨分化水平。所有操作均按照成脂、成骨和成软骨诱导试剂盒说明书进行。
1.2.3 人脂肪间充质干细胞条件培养基冻干和再水化 将 P3 代对数生长期 hADMSCs 接种于 T175 培养瓶中,按细胞密度为 1 × 104个/cm2接种,待细胞融合度达 80% 左右,换无血清培养基,24 h 后收集条件培养基上清,将收集的条件培养基上清按 1 ml/瓶分装至西林瓶中进行冻干操作。冻干步骤:预冻温度 -45 ℃,设定时间 45 min,持续时间 150 min。一次干燥的第一阶段温度 -5 ℃,设定时间 60 min,持续时间 600 min,设定真 空 0.01 mbar,第二阶段设定温度 10 ℃,设定时间 60 min,持续 120 min,设定真空 0.01 mbar。干燥 设定温度 30 ℃,设定时间 60 min,持续时间 240 min,设定真空 0.001 mbar。冻干完成后存储于 -20 ℃,使用时用蒸馏水按 1 ml/瓶水化溶解。
1.2.4 冻干粉浓度筛选(细胞划痕实验) 成纤维细胞(HFF-1)按(0.15 ~ 0.3)× 106个/ml 添加到 6 孔板,每孔添加 2 ml DMEM + 10% FBS, 待细胞完全长满,吸去培养基。用 1 ml 移液枪 头从中间进行划痕。划痕后用 PBS 2 ml 进行清 洗,洗去漂浮的细胞。分成 4 组(DMEM,15% hADMSCs-CMLP,50% hADMSCs-CMLP,100% hADMSCs-CMLP),每组 3 个复孔。0、16、24 h 分别在 10 × 镜下观察拍照。
1.2.5 成纤维细胞迁徙实验 在加细胞之前先将 Radius™ 迁移板加预制胶溶液处理 20 min,然后加洗涤液洗涤,洗涤后 HFF-1 按(0.15 ~ 0.3)× 106/ml,每孔添加 500 μl,培养 24 h,待细胞长满后,去除凝胶,吸掉培养基,对照组加入完全培养基,实验组添加含 50% 冻干粉溶解液的培养基,放入活细胞工作站中培养 24 h,观察细胞生长和 迁移情况并统计细胞迁移面积。细胞迁移实验详 见 Radius™24-Well Cell Migration Assay 试剂盒说明书。另按相同方法接种于 96 孔板,用 CellTiter-Lumi™Plus 发光法细胞活力检测试剂盒检测细胞增殖情况。Transwell 观察细胞迁徙情况: 24 孔板加入含 50% 冻干粉溶解液的培养基 600 μl(下层小室),HFF-1 细胞按 3 × 104/200 μl 无血清 DMEM 培养基加入 transwell 的上层小室,置于 37 ℃,5% CO2培养箱中培养 24 h,取出 transwell 小室,用棉签将小室内膜上未迁移细胞擦除,然后将朝下一侧的膜反转,置于新的 24 孔培养板中,加入 600 μl 4% 多聚甲醛固定 20 min,用 0.1% 结晶紫染色液染色 3 min。PBS 漂洗 3 次,除去未结合的结晶紫,棉签轻轻擦去小室侧壁的结晶紫染料,适当风干。将每个小室置于新的 24 孔板中,置于倒置显微镜下(10 ×),随机拍摄 6 个视野,并统计分析其迁移细胞数。
1.2.6 qRT-PCR 检测细胞外基质基因 mRNA 表达 将 HFF-1 细胞按 5 × 104个/cm2接种六孔板,对照组每孔加 2 ml 完全培养基,实验组每孔加 2 ml 含 15% 冻干粉的完全培养基,每组设置 3 个平行,置于 37 ℃,5% CO2培养箱中培养 48 h。提取细胞总 RNA,反转录为 cDNA,-20 ℃ 保存。qRT-PCR 测定细胞外基质相关蛋白 I 型胶原蛋白(collagen I)、MMP-1、弹性蛋白(elastin)、 纤维粘连蛋白(fibronectin)mRNA 表达。PCR 扩增条件:50 ℃ 保持 2 min,95 ℃ 预变性 10 min,95 ℃ 变性 15 s,60 ℃ 退火 1 min,循环 40 次。
1.2.7 基于 LPS 刺激巨噬细胞的抗炎功效评 估 以小鼠的 Raw264.7 巨噬细胞为模型,采用 LPS 诱导其发生炎症反应,研究人源脂肪间充质干细胞条件培养基冻干粉的抗炎作用。Raw264.7 巨噬细胞接种量按 1 × 105个/孔接种于 12 孔培养板中,每孔加入 1 ml 完全培养基,分四组:control、脂多糖(LPS)、LPS + Dex 和 LPS + 50% hADMSCs-CMLP。加药浓度为 LPS(100 ng/ml)、Dex(5 μg/ml)、50% CMLP(冻干粉 1 ml 蒸馏水稀释后与完全培养基 1:1 混匀),置于 37 ℃,5% CO2培养箱中培养 24 h;收集细胞上清,用 IL-6 和 TNF-α ELISA 试剂盒检测细胞培养上清液中的细胞炎症因子(IL-6 和 TNF-α)水平,使用酶标仪检测 450 nm 吸光度值。
1.3 统计学处理
采用 FlowJo V10 软件分析流式检测结果,用 GraphPad Prism 6.0 软件进行作图、统计学分析,采用单因素方差分析 one-way ANOVA,当 P < 0.05 时表示差异有统计学意义,所得计量数据用± s表示。
2 结果
2.1 hADMSCs 表面抗原鉴定
流式细胞术检测 P3 代 hADMSCs 表面抗原标志物,结果显示 CD34+、CD45+、HLA-DR+阳性细胞数百分比分别为 0.19%、0.06%、0.72%,表达特异性抗原 CD73+、CD90+、CD105+阳性细胞百分比分别为 99.76%、99.46%、98.53%(图 1),符合国际细胞治疗协会定义的 MSCs 标志性抗原表达鉴定标准。表明本研究采用的 hADMSCs 具有很好的间充质干细胞生物学特性。
2.2 hADMSCs 分化能力鉴定
hADMSCs 经成脂诱导培养 21 d,油红 O 染色后于显微镜下观察到细胞的胞浆内出现大小不等的红色脂滴,随着诱导培养时间的延长,脂滴持续增大、增多,同时细胞形态从梭形、多角形向椭球形转变,表现出脂肪细胞特点;hADMSCs 经 成骨诱导培养 21 d,观察到单个细胞体积增大,开始形成多层结节状结构,经茜素红 S 染色后出现大量橘红色沉淀颗粒,有明显的“矿化”结节,提示细胞产生钙化基质沉积,具有成骨细胞特点; hADMSCs 成软骨诱导培养 28 d,观察 15 ml 离心管底部出现软骨小球,经固定切片和阿利新蓝染色后,软骨小球的黏多糖会被阿利新蓝染成湛蓝色,具有成软骨细胞样特点(图 2)。表明本研究获得的 hADMSCs 具有很好的成脂、成骨和成软骨分化潜能。
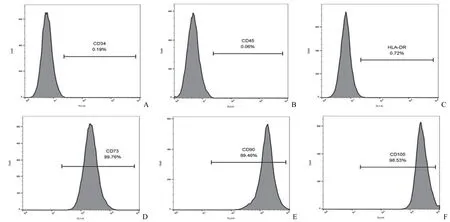
图1 hADMSCs 表面标志物流式鉴定结果(A ~ C 分别是CD34+、CD45+、HLA-DR+ < 2.00%;D ~ E 分别是 CD73+、CD90+、CD105+ > 95.00%)Figure 1 Results of flow cytometry identification of hADMSCs surface markers (A-C was CD34+, CD45+, HLA-DR+ < 2.00%; D-E was CD73+, CD90+, CD105+ > 95.00%, respectively)

图2 hADMSCs 成骨、成脂、成软骨分化潜能鉴定(A:阴性对照,正常 hADMSCs 细胞形态;B:成骨茜素红 S 染色;C:成脂油红 O 染色;D:成软骨小球切片阿利新蓝染色)Figure 2 Osteogenic, adipogenic, chondrogenic differentiation potency of hADMSCs (A: Negative control, normal hADMSCs cell morphology; B: Alizarin red S staining; C: Red O staining; D: Alcian blue staining of chondroblast sections)
2.3 hADMSCs 条件培养基冻干粉促进成纤维细胞迁移
HFF-1 长满后划痕,比较 0、16、24 h 镜检结果,发现 3 个实验组成纤维细胞迁移能力均高于阴性对照 DMEM,且死细胞少,划痕大部分已经修复,其中 50% hADMSCs-CMLP 的细胞修复能力最强(图 3)。
HFF-1 细胞按上述方法处理后,活细胞工作站培养观察 24 h,明显能看到细胞在加入 50% 的冻干粉后,实验组 HFF-1 基本长满圆形空白部分,对照组 HFF-1 还有很大空白(图 4B)。说明冻干粉能显著促进 HFF-1 细胞迁移。相同的处理方法接种于 96 孔板,培养 24 h 后,酶标仪检测显示添加 50% 的冻干粉,HFF-1 细胞 ATP 含量相对于对照组无明显增高,表明冻干粉对成纤维细胞是促进迁移,而非增殖(图 4A 和 C)。另外用 transwell 方法,可以观察到细胞向含有 50% hADMSCs-CMLP 培养基下层迁移,结晶紫染色明显能看到下层膜细胞变多,统计学差异显著(n = 3)(图 4D ~ F)。

图3 冻干粉浓度筛选(细胞划痕实验)(10 ×)Figure 3 Lyophilized powder concentration screening (cell wound healing test) (10 ×)
2.4 hADMSCs 条件培养基冻干粉对 HFF-1 细胞外基质基因表达的影响
hADMSCs 条件培养基冻干粉共培养下,利用 qRT-PCR 的方法,检测 HFF-1 的细胞外基质相关蛋白基因的 mRNA。结果显示,与对照组相比,共培养 48 h 时 HFF-1 的纤连蛋白、弹性蛋白、I 型胶原基因表达水平显著升高(图 5A ~ C);共培养 48 h,MMP-1 mRNA 表达显著降低(图 5D)。表明 hADMSCs 条件培养基冻干粉与 HFF-1 共培养能够显著促进体外细胞基质相关基因的表达。
2.5 hADMSCs 条件培养基冻干粉能抑制 Raw264.7 细胞炎症因子的分泌
为了研究 hADMSCs 条件培养基冻干粉的抗炎能力,以 LPS 诱导其炎症模型,加入 50% hADMSCs 条件培养基冻干粉共培养 24 h 后收集上清,检测其 TNF-α 和 IL-6 因子表达量,结果显示,条件培养基冻干粉抗炎效果极佳,能明显 抑制 TNF-α 和 IL-6 的分泌,抑制效果能达到地塞米松水平,差异均具有统计学意义。表明 hADMSCs 条件培养基冻干粉有很好的抗炎作用(图 6A 和 B)。
3 讨论
近年来,随着人们对 MSCs 认识的提高和技术的发展,越来越多的人对 MSCs 在体内是否分化为再生组织提出疑问,Caplan[17]提出,MSCs 定位于损伤或疾病部位,并分泌具有免疫调节和营养(再生)的生物活性因子,意味着这些细胞可以就地制造具有药用价值的治疗药物。原位新组织构建可能得益于外源供应 MSCs 分泌的生物活性因子,所以提出是否将 MSCs 翻译为药物信号细胞更为合适。脂肪间充质干细胞条件培养基冻干粉含有多种细胞因子、生长因子和趋化因子等;其中,VEGF 在脂肪间充质干细胞条件培养基冻干粉中表达显著高于其他来源的干细胞收集的条件培养基。研究证实,旁分泌因子 MCP-1 和 VEGF 在血管生成和细胞迁移过程中发挥重要作用[1,18],我们研究发现,脂肪间充质干细胞条件培养基冻干粉能显著促进细胞迁移。成纤维细胞在伤口愈合中起着关键作用,Saheli 等[19]研究表明,间充质干细胞条件培养基处理后的成纤维细胞,细胞活力、增殖和迁移情况显著提高。EGF 和 bFGF 基因表达水平上升,能够促进创伤愈合,PDGF 和 bFGF 表达上升能显著促进创伤部位细胞外基质的合成。尽管间充质干细胞在皮肤创面愈合中起着重要的作用,但有证据表明,由于细胞在损伤组织成活率低和干细胞归巢效应,移植的间充质干细胞在创面愈合中的原位贡献十分有限。
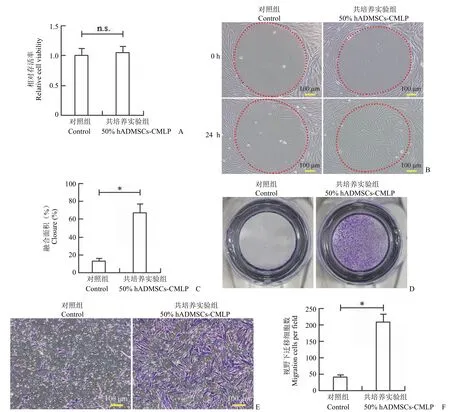
图4 hADMSCs-CMLP 对成纤维细胞迁移的影响的观察结果(A:冻干粉对细胞增殖无影响;B:成纤维细胞迁移在活细胞工作站中 24 h 观察图,50% hADMSCs-CMLP 明显能促进成纤维细胞迁移;C:细胞迁移统计图,有显著性差异,n = 3;D:Transwell 验证细胞迁移 24 h 观察图;E:Transwell 结晶紫染色;F:Transwell 验证细胞迁移统计图,n = 3;nsP > 0.05,*P < 0.001)Figure 4 Fibroblast migration observation (A: Conditioned medium lyophilized powder had no effect on cell proliferation; B: Fibroblast migration was observed in live cell imaging system for 24 h. 50% hADMSCs-CMLP significantly promoted fibroblast migration; C: Statistical graph of cell migration with significant difference, n = 3; D: 24 h of cell migration was verified by transwell. There was less cell migration in the control group, and the addition of 50% hADMSCs-CMLP fibroblast migration increased; E: Transwell crystal violet staining; F: Statistical graph of cell migration was verified by transwell, with significant difference, n = 3, nsP > 0.05,*P < 0.001)
外泌体是一种细胞主动分泌的大小均一、直径为 50 ~ 150 nm 的脂质双分子层结构囊泡,可由树突细胞、淋巴细胞、成纤维细胞、间充质干细胞和肿瘤细胞等多种不同类型细胞释放。外泌体含有多 种 RNA、蛋白质、脂质、DNA 等物质。脂肪干细胞可通过旁分泌途径分泌外泌体,在多种组织间起到信息传递作用,外泌体经冻干可长期保存,安全可靠[20]。脂肪干细胞条件培养基含大量外泌体和细胞因子,经干细胞条件培养基处理后的 HFF-1 细胞纤维粘连蛋白、弹性蛋白、I 型胶原蛋白显著升高,MMP-1 mRNA 水平表达显著降低。Deng 等[21]研究也证实脂肪干细胞条件培养基能促进细胞外基质的合成。早在 2016年国际细胞治疗协会就建议免疫功能检测作为间充质干细胞临床试验的放行标准[22]。现在普遍认为 MSC 类细胞药物的主要作用是由间充质干细胞的旁分泌及间充质干细胞驱动的内源性组织修复。间充质干细胞分泌的生长因子和细胞因子具有促炎和抗炎的作用,在治疗慢性炎症性疾病有巨大潜力。间充质干细胞条件培养基在治疗效果方面持续更长[23],其在系统性硬化症 和克罗恩病中具有抗炎、抗纤维化和促血管生成的潜力,这些功能可能与 MSCs 分泌的 IDO、PGE2、HLA-G、TGF-β、HGF、IL-10 和 IL-1β 有关[24]。Pacienza 等[25]证实间充质干细胞来源的外泌体有显著抗炎效果,能够显著抑制 LPS 刺激巨噬细胞分泌的 IL-6 和 TNF-α 细胞因子表达水平。我们提取的脂肪干细胞冻干粉也有相同的效果。
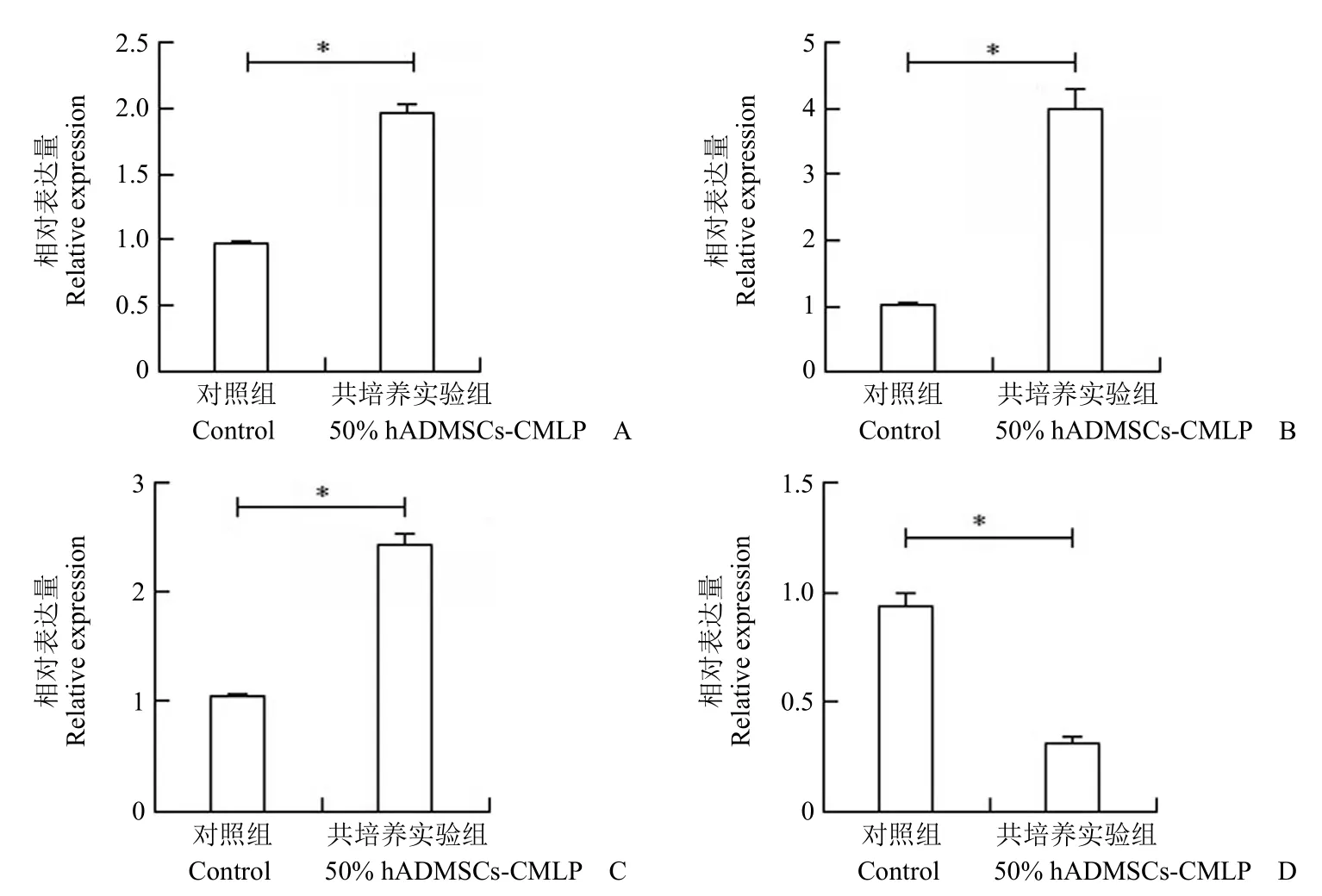
图5 HFF-1 细胞外基质相关蛋白基因表达检测结果(A:纤连蛋白;B:弹性蛋白;C:I 型胶原蛋白;D:基质金属蛋白酶-1;*P < 0.001)Figure 5 HFF-1 extracellular matrix related protein gene expression results (A: Fibronectin; B: Elastin; C: Collagen I; D: Matrix metalloproteinase-1; *P < 0.001)
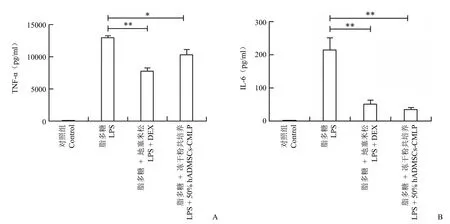
图6 hADMSCs 条件培养基冻干粉抑制 Raw264.7 细胞炎症因子的分泌检测结果(A:TNF-α 检测结果;B:IL-6 检测结果;*P < 0.01,**P < 0.001)Figure 6 hADMSCs conditioned medium lyophilized powder inhibited the secretion of inflammatory cytokines in Raw264.7 cells (A: TNF-α detection results; B: IL-6 detection results; *P < 0.01, **P < 0.001)
脂肪间充质干细胞条件培养基冻干粉在促进细胞迁徙、促进细胞外基质合成和抗炎方面有显著效果,并且安全性和便捷性要优于间充质干细胞本身,在皮肤创伤修复和慢性炎症性疾病中有广阔的应用前景。条件培养基受限于间充质干细胞的状态,其分泌物组分存在动态变化,其成分分析、组分动态变化、分子机制、条件培养基的制备等方面 的研究还有待深入[26],另外不同来源的外泌体具有多种活性,包括抗炎、抗免疫、抗凝血、促血管生成和致瘤,也需要进行一系列的检测[25]。
