Box-Behnken响应面法优化酶法制备α-环糊精及其分离纯化
2020-07-17
(漯河食品职业学院食品工程系,河南漯河462000)
环糊精是淀粉通过被芽孢杆菌属的某些种产生的葡萄糖基转移酶(α-cyclodextrin glycosyltransferase,α-CGTase)的作用形成的一类环状低聚糖[1]。比较常见的有α-环糊精、β-环糊精和γ-环糊精,分别由6、7个和8个葡萄糖基构成[2]。在环糊精的应用中,β-环糊精应用广泛,但在小分子化合物的包合性上,α-环糊精因其空腔更小而比β-环糊精更有优势。另外,α-环糊精化学性质稳定、有较高的溶解度及在体内代谢慢且无毒等优点,在食品中可作为一种新型的膳食纤维,还可应用于医药、化妆品、环保等领域[3-8]。目前,α-环糊精在国外已得到大规模使用,但产量十分有限,国内也基本没有规模化的生产,究其原因,除了缺少自有高活性的α-环糊精生产关键用酶之外,最主要的原因就是生产工艺的不稳定性及很难实现α-环糊精的有效分离。
王宁等[9]利用来源于Paenibacillus macerans的α-CGTase突变体Y89D制备α-环糊精,得到70%的淀粉转化率。Duan等、冉红艳等[10-11]将α-CGTase与异淀粉酶复配作用于马铃薯淀粉、木薯淀粉,分别得到84.6%和87.15%的α-环糊精转化率。陈晓彤等[12]采用无有机溶剂的酶法对海洋芽孢杆菌Y112产的α-CGTase制备α-环糊精的3个条件:底物浓度、温度和pH值进行了优化,得到α-环糊精的转化率为28.67%。Blackwood等[13]研究了在酶反应体系中加入适当的有机溶剂,可以提高α-环糊精的转化率。国内大多数研究主要集中在α-CGTase的开发和性质研究上,而α-环糊精的酶法制备及分离工艺却研究的很少。因此,继续研究α-环糊精的酶转化与制备分离工艺对推动α-环糊精的生产和应用具有十分重要的意义。本研究采用有机溶剂的酶法制备α-环糊精,以α-CGTase为催化剂,使其作用于马铃薯淀粉,分析不同条件对α-环糊精转化率的影响,采用响应面法对加酶量、底物浓度、反应时间3个反应条件进行优化,并通过水蒸气蒸馏法进一步分离纯化α-环糊精产物,经高效液相色谱法(high performance liquid chromatography,HPLC 对产物成分进行鉴定,为α-环糊精的规模化生产提供一定的参考依据。
1 试验材料与方法
1.1 试验材料与仪器设备
α-CGTase酶:日本Amano Enzyme公司;α-环糊精、乙腈(色谱纯):阿拉丁试剂(上海)有限公司;马铃薯淀粉:国药集团化学试剂有限公司;其他试剂均为分析纯:国药集团。
V-1800可见分光光度计:上海美谱达仪器有限公司;MS-100恒温混匀仪:杭州奥盛仪器有限公司;PHSJ-5型实验室pH计:上海仪电科学仪器有限公司;Waters600高效液相色谱仪:美国Agilent公司。
1.2 试验方法
1.2.1 α-CGTase酶活的测定
采用甲基橙法测定酶的环化活力。将酶液稀释一定倍数制成粗酶液,用pH 5.5的磷酸钠缓冲液将马铃薯淀粉隔水加热配制成1.0%的淀粉溶液。在2 mL的离心管中加入100 μL的粗酶液和900 μL的底物。放入恒温混匀仪中,40℃下反应10 min。取出后加入1 mL 1 mol/L的盐酸溶液,反应终止。再加入1 mL的50 mmol/L磷酸钠缓冲液配制的0.1 mmol/L甲基橙溶液。在20℃下静置20 min后,测定溶液在507 nm波长下的吸光度。酶活单位(U)的定义为1 min生成1 μmol的α-环糊精所需的酶量。
1.2.2 α-环糊精标准曲线的测定
取6支试管,编号0~5,加入1 mL 0.1 mmol/L甲基橙溶液(用50 mmol/L pH 5.5的磷酸缓冲液配制)和1 mL 1 mol/L 的盐酸,再依次加入 0、0.25、0.5、0.75、1.0、1.25、1.5 mL 1 mg/mL α-环糊精标准溶液(50 mmol/L pH 5.5的磷酸缓冲液配制),立即摇匀,定容至5 mL。16℃恒温水浴静置20min后,以0号管调零,在507nm波长下测定吸光度。以吸光度差值为纵坐标,α-环糊精含量为横坐标绘制标准曲线[14]。吸光度差值(ΔA)=空白溶液吸光度(A1)-样品吸光度(A2)。
1.2.3 α-环糊精的制备方法
称取适量的马铃薯淀粉加入50 mmol/L的磷酸钠缓冲液加热溶解制成一定浓度的底物溶液,冷却至25℃。在2 mL的离心管中加入100 μL的粗酶液和900 μL的底物,放入恒温混匀仪中进行反应。反应结束后,取出离心管置于沸水浴中灭酶10 min。将反应溶液转移至5 mL离心管中,加入1 mL 1 mol/L的盐酸溶液。再加入1 mL的50 mmol/L磷酸钠缓冲液配制的0.1 mmol/L甲基橙溶液。以相应pH值的磷酸钠缓冲溶液定容至5 mL,立即摇匀。16℃恒温水浴静置20 min后,以空白试剂调零,测定507 nm下的吸光度。
1.2.4 α-环糊精转化率的计算
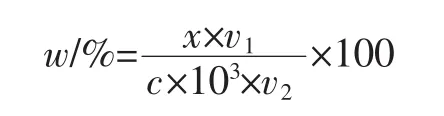
式中:w为α-环糊精转化率,%;x为根据吸光度计算出的α-环糊精的浓度,mg/mL;v1为反应体系溶液的体积,mL;c为反应底物淀粉的浓度,%;v2为反应底物淀粉溶液的体积,mL。
1.2.5 反应条件的优化
1.2.5.1 单因素试验设计
为系统地考察不同反应条件对α-环糊精转化率的影响,分别设置不同反应 pH 值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、不同反应温度(35、40、45、50、55、60℃),确定出最佳的相对酶活条件后,再以不同的底物浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、加酶量(50、100、150、200、250 U/g)、反应时间(8、10、12、14、16、18 h)和 2%不同的有机溶剂(乙醇、异丙醇、正丁醇、正癸醇)进行单因素试验。
1.2.5.2 响应面试验设计
在单因素试验基础上进行响应面分析,选取加酶量、反应时间、底物浓度为三因子,每个因素选择包括最佳水平在内的三水平,进行Box-Behnken中心组合试验。通过响应面分析结果找到最优的反应参数。因素与水平见表1。

表1 Box-Behnken设计试验因素与水平表Table 1 Factors and levels in Box-Behnken design
1.2.6 α-环糊精的分离纯化工艺及成分鉴定
反应液→加热灭酶→混合液过滤、包合物分离、沉淀收集→沉淀复水→水蒸气蒸馏→蒸发浓缩→晶体析出、过滤干燥→HPLC鉴定分析
经水蒸气蒸馏去除正癸醇后,获得α-环糊精溶液,溶液经过浓缩、结晶、干燥,得到α-环糊精产品。
HPLC鉴定环糊精产量及检测分析条件:将产物灭酶后于12 000 r/min条件下离心25 min,得到的上清液经0.45 μm超滤膜过滤,然后取20 μL上机分析。采用 Thermo Hypersil NH2色谱柱(4.6 mm×250 mm,5 μm APS-2 Hypersil微粒),Wasters示差折光检测器。检测条件:流动相为75%乙腈水溶液,流速1 mL/min,柱温30℃。
2 试验结果与分析
2.1 α-CGTase酶活的测定
通过分光光度法测定酶活,得到α-CGTase的酶活为607 U/g。
2.2 α-环糊精标准曲线的绘制
图1为α-环糊精的标准曲线。
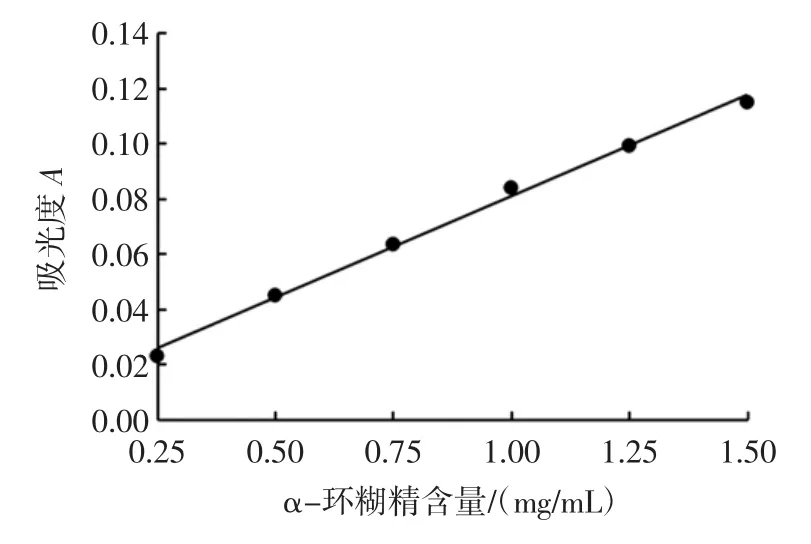
图1 α-环糊精标准曲线Fig.1 α-cyclodextrin standard curve
得到α-环糊精的一元线性回归方程:y=0.073 5x+0.007 3,R2=0.995 6,式中y为507 nm下测定的吸光度,x为浓度,结果表明吸光度与浓度在0.25 mg/mL~1.50 mg/mL之间呈良好的线性关系。
2.3 反应条件对α-环糊精转化率的影响分析
2.3.1 反应温度对α-环糊精转化率的影响
反应温度对α-环糊精转化率的影响见图2。

图2 反应温度对α-环糊精转化率的影响Fig.2 Effect of reaction temperature on α-cyclodextrin conversion
由图2可以看出,温度对α-环糊精的制备过程有很大影响,α-环糊精的转化率随温度的升高而增加,当达到50℃时转化率最高,为38.6%,继续升高温度则转化率急剧下降。这是因为温度过高,超过最适温度,α-CGTase部分失活,结构也随之发生变化,从而造成淀粉转化率降低。因此选用50℃为最适反应温度。
2.3.2 反应pH值对α-环糊精转化率的影响
反应pH值对α-环糊精转化率的影响见图3。
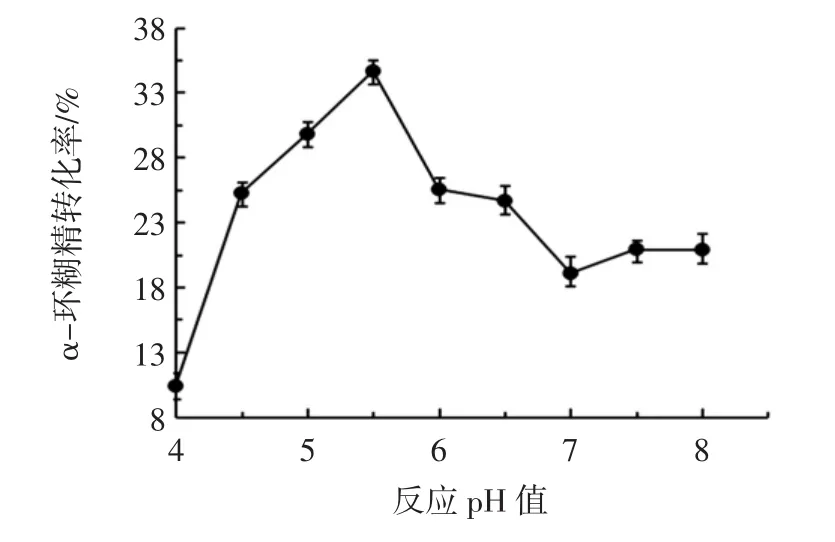
图3 反应pH值对α-环糊精转化率的影响Fig.3 Effect of reaction pH on α-cyclodextrin conversion
由图3可以看出,在pH 4.0~5.5之间,随着pH值的升高,生成的α-环糊精产量也大幅提高,当pH值为5.5时α-环糊精产量最高,为34.7%。随着pH值的继续升高,甚至到碱性时,α-环糊精的产量都有所下降。这表明在适宜的pH值下,对酶与底物的结合会有促进作用,导致生成反应的加快,有利于环糊精的产出。而当pH值不在最适范围内时,会影响酶的构象和结构,导致酶活降低甚至完全失活。因此选用pH 5.5为制备α-环糊精的最适pH值。
2.3.3 底物浓度对α-环糊精转化率的影响
底物浓度对α-环糊精转化率的影响见图4。

图4 底物浓度对α-环糊精转化率的影响Fig.4 Effect of substrate concentration on α-cyclodextrin conversion
从图4可看出,随着马铃薯淀粉浓度的增大,α-环糊精转化率呈现先上升后下降的趋势。当底物浓度为1.0%时,α-环糊精的转化率最高,为27.6%。当α-CGTase的活性部位逐渐被底物分子全部占据时,再增加底物浓度,会抑制酶促反应,导致环糊精的转化率降低[15]。因此综合考虑α-环糊精生产的转化率和环糊精的比例,选用1.0%作为生产α-环糊精的淀粉浓度。
2.3.4 加酶量对α-环糊精转化率的影响
加酶量对α-环糊精转化率的影响见图5。
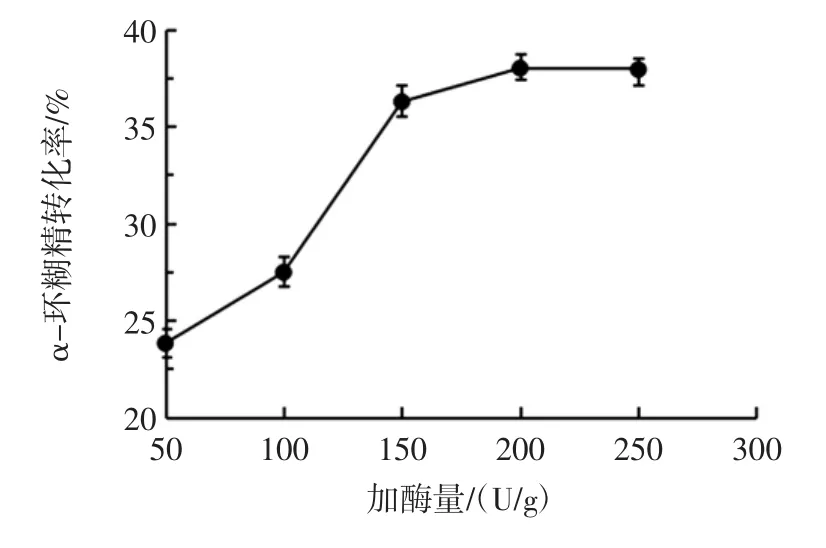
图5 加酶量对α-环糊精转化率的影响Fig.5 Effect of enzyme amount on α-cyclodextrin conversion
由图5可以看出,随着加酶量的增加,α-环糊精的转化率也不断提高,当加酶量达到200 U/g时,α-环糊精的转化率最高,为38.0%。随着加酶量的继续增加,α-环糊精的产量几乎不变。其原因是随着加酶量的增加,增强了α-CGTase的歧化、偶合反应能力,反应体系中的小分子糖浓度也随着增加,当小分子糖浓度比较高时会促进偶合反应的发生,导致β-环糊精的产量提高,而不利于α-环糊精的生成。因此综合考虑生产成本和α-环糊精的产量,加酶量选取200 U/g。
2.3.5 反应时间对α-环糊精转化率的影响
反应时间对α-环糊精转化率的影响见图6。
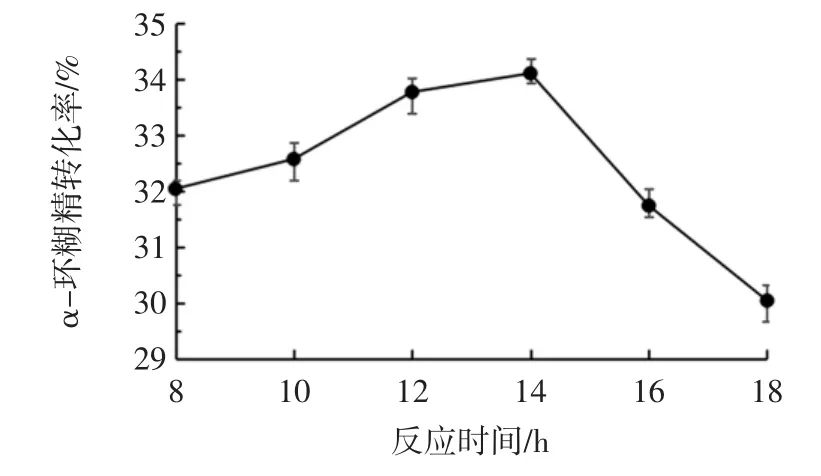
图6 反应时间对α-环糊精转化率的影响Fig.6 Effect of reaction time on α-cyclodextrin conversion
由图6可以看出,随着反应时间的延长α-环糊精的转化率先上升后下降,在反应14 h时,α-环糊精的转化率最高,为34.1%。14 h后,α-环糊精的转化率大幅降低,其原因可能是随着反应时间的延长,α-环糊精逐渐产生了分解。因此,选取14 h为最佳反应时间。
2.3.6 有机溶剂种类对α-环糊精转化率的影响
有机溶剂种类对α-环糊精转化率的影响见图7。
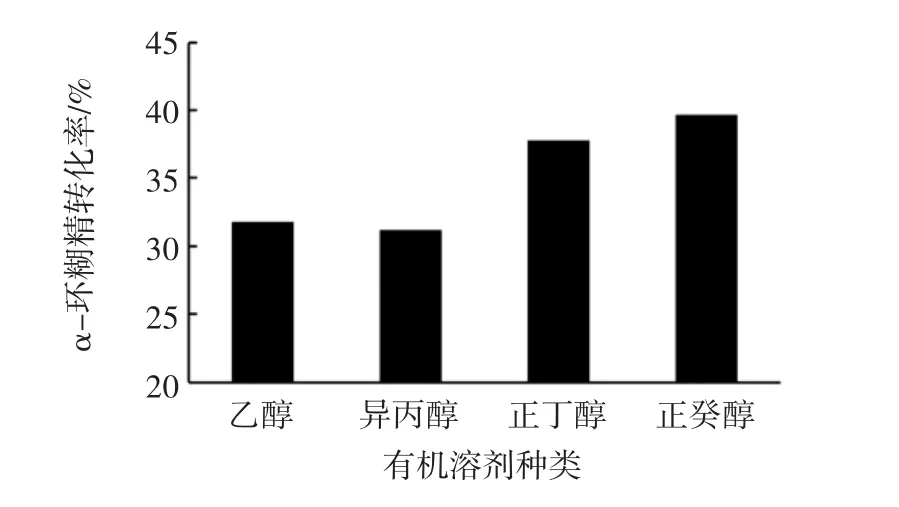
图7 有机溶剂种类对α-环糊精转化率的影响Fig.7 Effects of organic solvent types on α-cyclodextrin conversion
醇类与环糊精能够形成包合物沉淀,促进反应向生成环糊精的方向不断进行,加快反应速度,提高α-环糊精的转化率[16]。试验中分别加入了有机溶剂乙醇、异丙醇、正丁醇和正癸醇,从图7可以看出,反应体系中加入正癸醇后,α-环糊精的转化率最高,为39.7%。另外由于可溶的醇类会造成后期提取上的困难,因此综合分析,选用正癸醇作为生产α-环糊精的有机溶剂。
2.4 响应面结果与分析
2.4.1 回归方程的建立与分析
采用Box-Benhnken进行试验设计,以底物浓度、加酶量、反应时间为自变量,以α-环糊精的转化率为响应值,使用Design Expert8.0.6进行三因子三水平响应面分析。其试验设计及结果见表2,方差分析结果见表3。
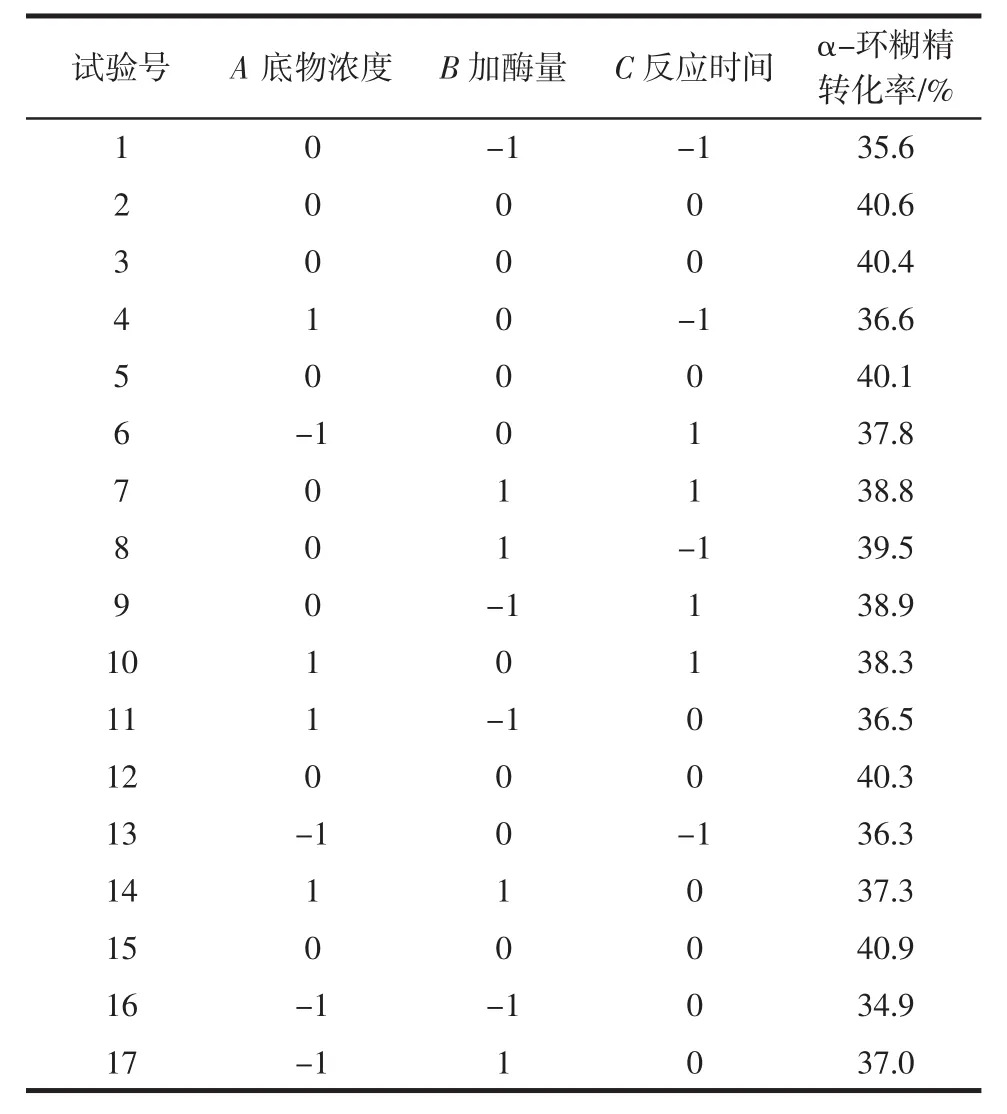
表2 Box-Benhnken试验设计及响应结果Table 2 Box-Benhnken design and response results values
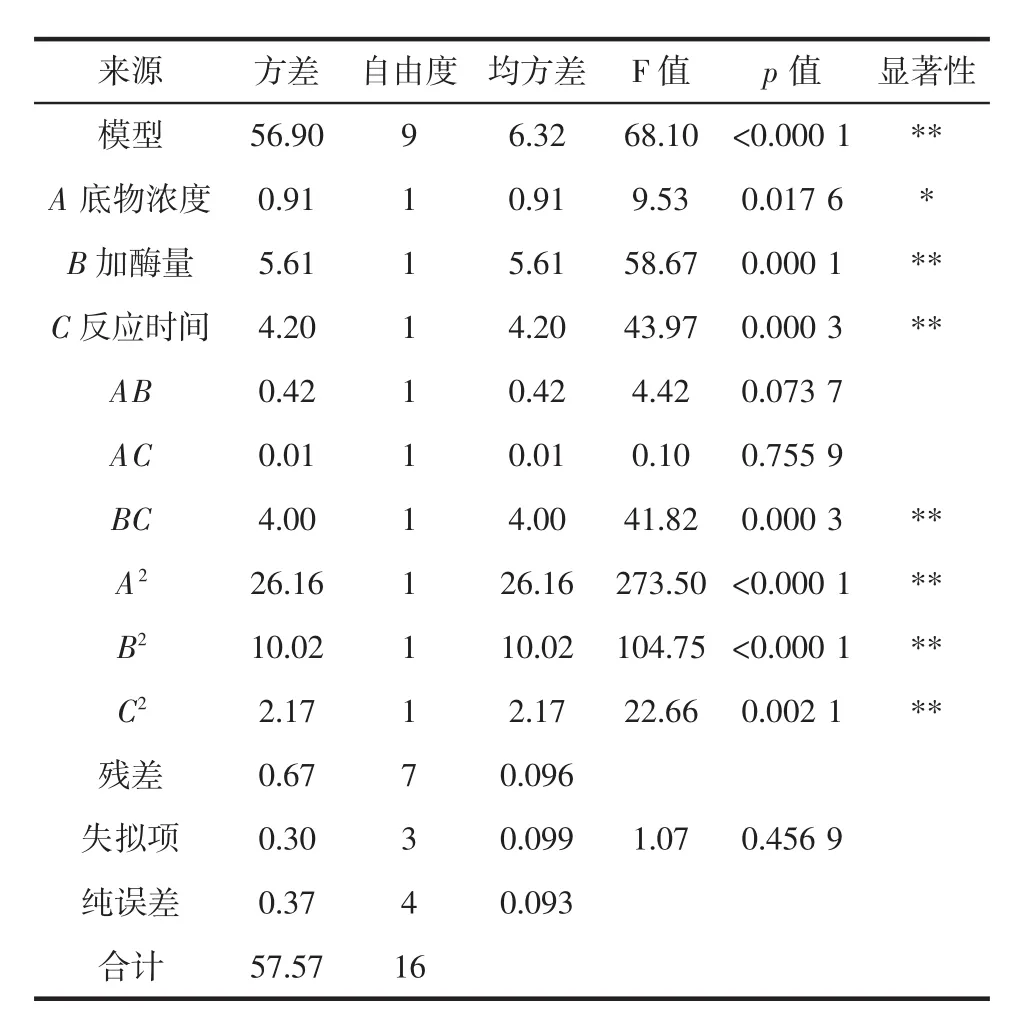
表3 回归模型方差分析Table 3 Analysis of variance in regression mode
由表3可以看出,该回归模型p<0.000 1,方程模型极显著。失拟项p=0.456 9>0.05不显著,对模型有利;该模型的 R2=0.988 4,R2Adj=0.973 4,CV=0.81%,以上参数说明该模型拟合性好,试验误差小。根据回归系数,得到α-环糊精转化率的二次多元回归方程为:

由表3中方差结果可知,对α-环糊精转化率影响的大小顺序为:B加酶量>C反应时间>A底物浓度。其中B加酶量、C反应时间达到极显著水平,A底物浓度达到显著水平。二次项A2、B2、C2均极显著。考察各因素间交互作用,BC存在交互作用,且达到极显著水平。
2.4.2 因素交互作用响应面分析
根据回归方程绘制响应面图,通过观察响应面的变化情况和稀疏程度可直观地反映各因素相互作用对α-环糊精转化率的影响,结果如图8所示。
由图8的3个图可知,加酶量、反应时间和底物浓度对α-环糊精转化率都有显著影响。通过对比,图8(c)的曲面最陡峭、等高线成马鞍形,表明加酶量B和反应时间C的交互作用对α-环糊精的转化率影响显著,与表3分析结果一致。
2.4.3 最佳条件的确定和模型的验证

图8 两因素交互作用对α-环糊精制备的响应面Fig.8 Response surface map of two factors interaction on αcyclodextrin preparation
运用软件对α-环糊精转化率的二次多项模型进行预测,选出α-环糊精制备的最佳工艺参数:底物浓度为1.03%、加酶量为206.48 U/g、反应时间为14.83 h,α-环糊精转化率理论值为40.676 2%。考虑实际情况和可操作性,将最优的工艺参数修正为:底物浓度1.0%、加酶量200 U/g淀粉、反应时间14 h,在此条件下进行3次验证试验,取其平均值,试验制得的α-环糊精转化率为40.6%,与预测值基本一致,说明了此响应面法得到的回归模型可靠。
2.5 α-环糊精产物的成分鉴定及分离纯化结果分析
α-CGTase作用马铃薯淀粉产物成分鉴定见图9。
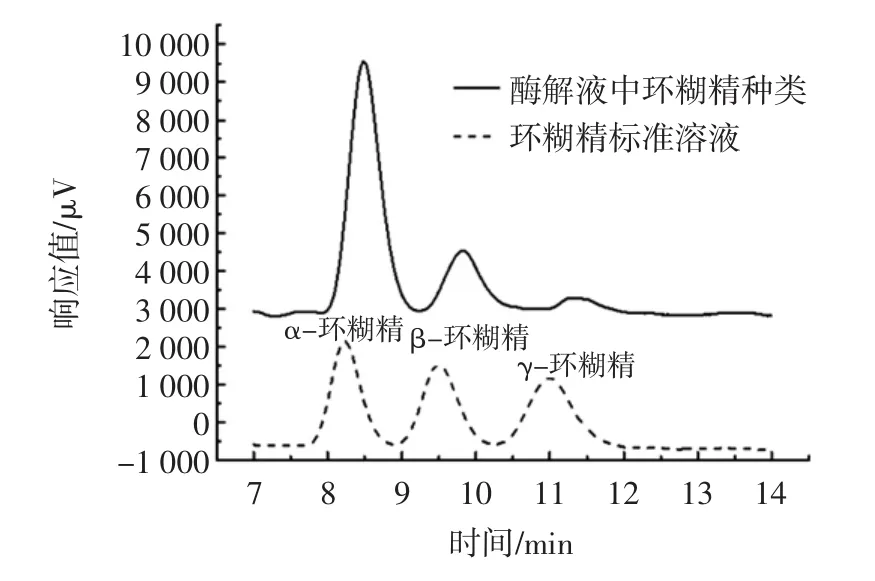
图9 α-CGTase作用马铃薯淀粉产物成分鉴定Fig.9 Identification of potato starch products by α-CGTase
如图9所示,α-环糊精、β-环糊精和γ-环糊精的保留时间分别为8.229、9.492、10.997 min。即当1.0%马铃薯淀粉为底物时,添加α-CGTase后得到了含有α-环糊精、β-环糊精和γ-环糊精3种环糊精混合物,其中主要产物为α-环糊精,约占环糊精总含量的75%。
在分离纯化中,通过水蒸气蒸馏法去除包合物沉淀中的正癸醇。经过分析计算,α-环糊精的提取率大致为20%~40%,经过HPLC鉴定产品纯度为75%。
3 结论
本文以α-CGTase为催化剂,研究其作用于马铃薯淀粉产出α-环糊精的酶法生产及分离工艺。通过单因素试验分析不同条件对α-环糊精转化率的影响。试验结果表明,当α-CGTase的反应温度为50℃,pH值为5.5时,α-CGTase呈现最好的酶活性质,α-环糊精的转化率最高。结合响应面法得出制备α-环糊精的最佳工艺参数:1.0%马铃薯淀粉,加酶量为200 U/g淀粉,反应时间为14 h,反应体系中加入有机溶剂正癸醇,在此条件下α-环糊精的转化率为40.6%。
通过水蒸气蒸馏法进一步分离纯化α-环糊精产物,经HPLC检测鉴定,转化率可达到20%~40%,纯度达到75%。本研究可为α-环糊精的规模化生产提供一定的参考依据。
