脂肪间充干细胞复合骨软骨一体化支架修复兔骨软骨缺损的实验研究
2020-11-10杰永生郑蕊陈磊靳少锋孙磊舒雄綦惠
杰永生,郑蕊,陈磊,靳少锋,孙磊,舒雄,綦惠
关节软骨损伤是临床上十分常见的病症,也是骨科和运动医学中公认的治疗难题之一。据统计,年龄范围 15 ~ 24 岁的年轻人中有 4% ~ 10%,年龄超过 55 岁的老年人中有高达 80% 的人出现软骨病变[1-2]。由于关节软骨是一种无血管、无神经的结缔组织,细胞代谢缓慢,一旦缺损其自发修复和再生能力很差。目前临床治疗软骨损伤的常用方法如关节腔灌洗清创、微骨折术、自体/异体骨软骨移植,旨在减轻关节疼痛和缓解症状,并不能有效地促进软骨组织的修复再生;且这些方法存在很大的局限性,如供体部位损伤,效果不持久,排斥反应等[3-5]。因此,寻找新型的、可有效促进软骨生理性再生修复的方法具有极其重要的临床意义。
近年来,组织工程学这一新型边缘交叉学科的出现为软骨缺损的修复提供了广阔的研究领域和应用前景。脂肪组织中分离出的脂肪间充质干细胞(adipose mesenchymal stem cells,ADSCs)表现出显著更高的增殖率,并且特异性呈三种谱系的分化:成脂肪、成骨和成软骨。与骨髓来源的间充质干细胞相比较,ADSCs 易于分离和大量获取,同时具有更好的分离重复性和更强的增殖能力,一直被认为是最适合临床应用的细胞[6-7]。此外,我们前期研究已成功构建脱细胞真皮基质/生物矿化胶原骨软骨一体化支架,具有良好的力学特征和生物相容性,有利于细胞的黏附与生长,易生物降解吸收[8]。本实验建立以 ADSCs 复合脱细胞真皮基质/生物矿化胶原骨软骨一体化支架修复新西兰兔的骨软骨缺损的动物模型,观察其在软骨缺损修复中的作用,为下一步临床提供相应的理论基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和设备 人脂肪组织来源于北京知音创美医疗美容门诊部吸脂者,女性,抽吸部位为腹部,已获得提供者知情同意,术后无菌保存。甲醛、苏木精、伊红购自北京索莱宝生物科技有限公司;I 型胶原酶、胰酶、Trizol 试剂、高糖 DMEM、低糖 DMEM 和胎牛血清(FBS)购自美国 Gibco 公司;抗兔 CD90、CD105、CD44、CD14、CD45 和 CD19 抗体购自美国 BD 公司;CO2细胞培养箱购自美国 Shellab 公司;往复式真空泵购自上海 益化真空设备有限公司;倒置相差显微镜购自日本 Olympus 公司;冷冻大容量离心机购自湖南湘仪;FACSCanto II 流式细胞仪购自美国 BD 公司。
1.1.2 实验动物 6 周龄,新西兰大白兔 18 只,体重 2.0 ~ 2.5 kg,雌雄各半,购买于北京金牧阳实验动物养殖有限责任公司,许可证号SYXK(京)2020-0002,饲养环境为普通级。
1.2 方法
1.2.1 一体化支架的制备 生物矿化胶原悬液作为一体化支架下层,脱细胞真皮基质作为一体化支架上层。首先将冷冻干燥脱细胞真皮基质放入聚丙烯圆筒形模具中(内径 5 mm;高 5 mm),将制备的生物矿化胶原悬液经脱气后,缓慢注入模具中。为使接触界面紧密,使悬液固化成型,即在 -80 ℃ 冰箱内维持 2 h,冷冻样品最终在冷冻干燥机内真空条件下冷冻干燥 48 h,脱模后成功取出支架。另将制作好的支架用 20 kGy60Co γ 射线辐照灭菌后,4 ℃ 条件下密封保存备用。
1.2.2 细胞分离及培养 无菌条件下取脂肪组织,将脂肪组织在 PBS 中清洗 3 次,彻底去除红细胞与组织碎片。加入预热的 0.1% I 型胶原酶 溶液,置 37 ℃ 水浴振荡消化 1 h。300 × g 离心 5 min,去除上层脂肪细胞与胶原酶溶液。加入适量含 10% BSA 的 DMEM 重悬细胞,经 100 μm 细胞筛过滤,调整细胞密度接种至细胞培养瓶,于 37 ℃、5% CO2培养箱中培养[7]。将获得细胞培养到 P3 备用。
1.2.3 动物实验分组及干预 新西兰兔仰卧于手术台上,四肢固定,耳缘静脉注射 0.1% 的戊巴比妥钠(40 mg/kg)麻醉,膝外侧切口,股骨内侧髁关节面做直径 4 mm 的圆形缺损,纵向钻入 2 mm,深达软骨下骨,造成骨软骨缺损模型。模型兔随机分成 3 组,每组 6 只,分别为空白对照组(仅作缺损,不进行任何处理)、支架组以及支架联 合 ADSCs 组,术后 6、12 周处死。所有动物实验方案均经北京积水潭医院伦理委员会批准。
1.2.4 主要观察指标
1.2.4.1 一般情况 动物模型制备后,观察 3 组新西兰兔存活及饮食等情况。
1.2.4.2 国际软骨修复协会组织学评分 6、 12 周取材后,按照国际软骨修复协会(ICRS)标准(表 1)进行大体评分。
1.2.4.3 大体观察创面愈合情况 动物模型制备后 6、12 周,3 组大体观察创面愈合情况。
1.2.4.4 HE 染色 10% 甲醛固定、30% 脱钙和石蜡包埋,垂直于缺损区进行切片,HE 染色 5 min 后,在光镜下观察。
1.2.4.5 番红 O-固绿染色 按照说明书进行。切片常规脱蜡至水,入新鲜配制的 Weigert 染液染色 5 min。酸性分化液分化 15 s。固绿染色液内浸染5 min,蒸馏水洗 1 min。Safranin O stain 内浸染 2 min,蒸馏水洗 1 min。用弱酸溶液洗涤切片 1 min,蒸馏水洗 1 min。分别用 95% 乙醇、无水乙醇脱水,二甲苯透明,光学树脂封固。

表1 软骨损伤修复的大体评分标准Table 1 ICRS macroscopic evaluation of cartilage repair
1.3 统计学处理
用 SPSS 13.0 统计软件进行数据处理,计量资料以± s表示,两组计量资料之间的比较采用 t 检验,P < 0.05 为差异有显著性意义。
2 结果
2.1 ADSCs 的分离和鉴定
细胞接种 24 h 后,圆形细胞下沉在瓶底呈圆形或多角形,48 ~ 72 h 细胞数量明显增加,排列密集(图 1)。5 ~ 7 d 时细胞明显增多,大多数细胞呈长梭形。传至第 3 代细胞流式细胞仪检测结果显示,脂肪间充质干细胞表型呈 CD34-、CD45-、HLA-DR-、CD73+、CD90+、CD105+(图 2)。
2.2 ICRS 评分
ICRS 评分显示,术后 6 周,一体化支架组与 ADSCs 复合一体化支架组的软骨修复程度显著优于对照组(P < 0.05),一体化支架组与 ADSCs 复合一体化支架组之间无显著差别;术后 12 周,ADSCs 复合一体化支架组的软骨修复程度显著优于对照组和一体化支架组(P < 0.05)(表 2)。
2.3 大体观
实验的新西兰大白兔于手术后 6、12 周处死,对照组缺损内无软骨修复组织,部分仅有少量修复,但修复组织数量较少,起不到填充作用。一体化支架组缺损处部分修复,表面欠平整,凸凹不平,交界区界限明显。ADSCs 复合一体化支架组缺损处几乎填充完全,修复组织色泽、质地同正常关节软骨,表面光滑,与周围正常软骨组织界限模糊,结合紧密(图 3)。
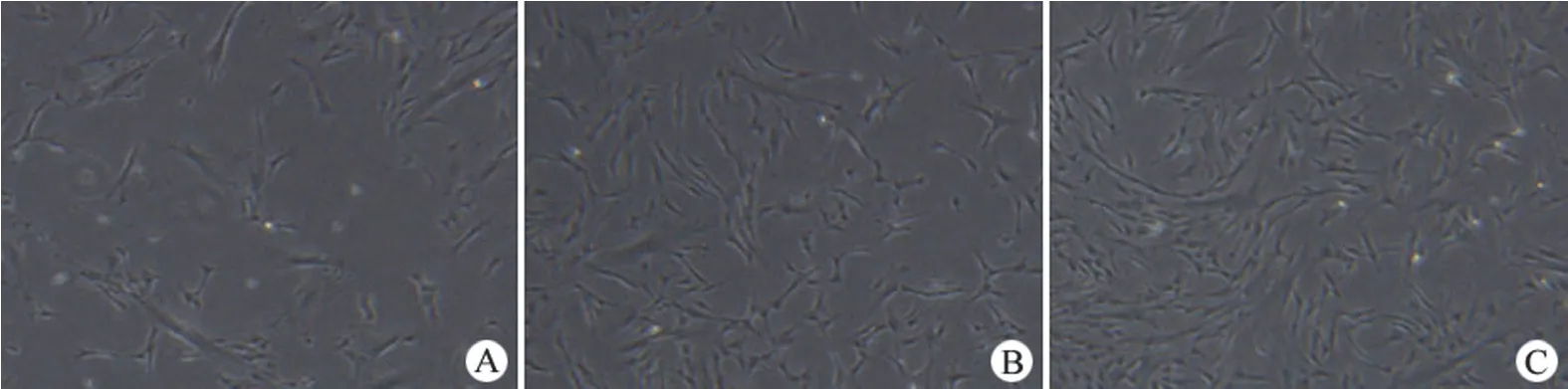
图1 ADSCs 形态学观察(倒置相差显微镜 × 40)(A:24 h;B:48 h;C:72 h)Figure 1 Morphology observation of the ADSCs (Inverted phase contrast microscope × 40) (A: 24 h; B: 48 h; C: 72 h)
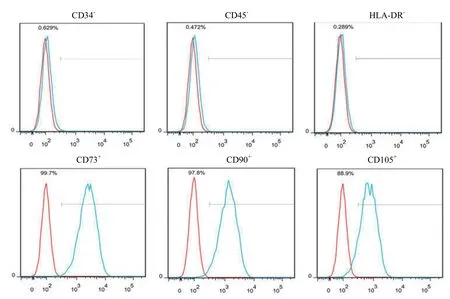
图2 ADSCs 表面特异性蛋白检测Figure 2 Phenotype analysis of ADSCs

表2 ICRS 组织评分结果与比较Table 2 Histological scoring results and comparison
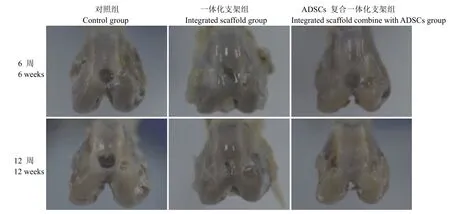
图3 三组术后 6、12 周大体观察Figure 3 General observation of wounds in three groups at 6, 12 weeks after operation
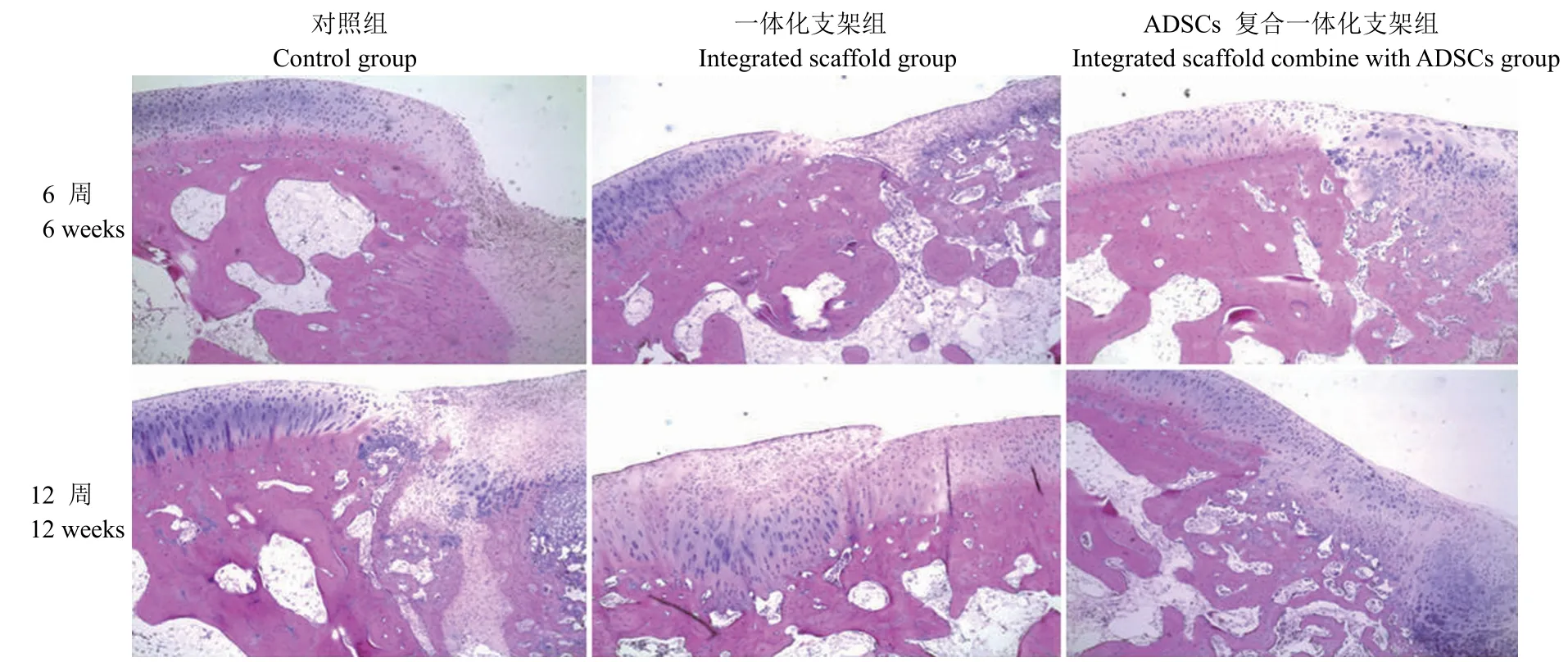
图4 术后 6、12 周 HE 染色观察(× 40)Figure 4 The HE observation in three groups at 6, 12 weeks after operation (× 40)
2.4 组织学染色
HE 染色显示术后 6 周,对照组的缺损区域凹陷明显,与周边正常区域界限明显;一体化支架组的缺损区域表面修复不平,纤维组织修复较为明显;ADSCs 复合一体化支架组的缺损区域底部可见少量的柱状排列的软骨细胞以及多形核细胞。术后 12 周,对照组的缺损区域表面平坦,被纤维组织覆盖;一体化支架组的缺损区域与正常组织区域处底部可见少量柱状排列的软骨细胞;ADSCs 复合一体化支架组的底部可见较多柱状排列的软骨细胞以及多形核细胞(图 4)
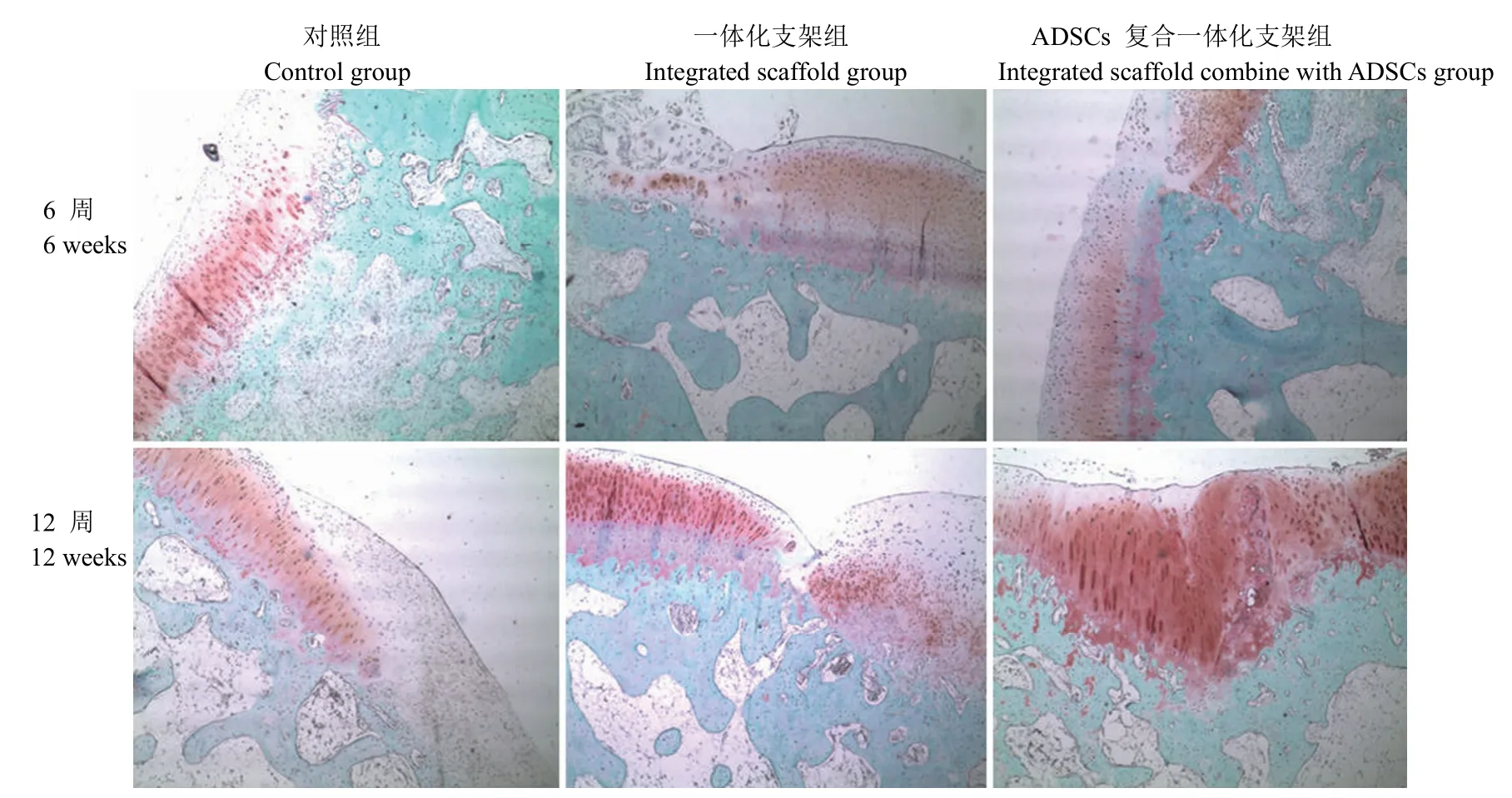
图5 术后番红 O-固绿染色观察(× 40)Figure 5 The safranine O-fast green stain observation at 6, 12 weeks after operation (× 40)
番红 O 固绿染色术后 6 周,对照组缺损区域 未被番红 O 着色,与呈红色的正常软骨组织界限明显;支架组缺损区域也未被番红 O 着色;一体化支架联合 ADSCs 组,缺损区域底部可见微弱的番红 O 着色。术后 12 周,对照组缺损区域表面被纤维组织覆盖;一体化支架组缺损区域底部可见少量番红 O 着色;一体化支架联合 ADSCs 组,缺损区域底部可见明显的番红 O 着色,且在缺损与正常组织交界处底部有大量红色的区域(图 5)。
3 讨论
近年来,骨软骨损伤修复是骨科领域研究的热点之一,由于关节软骨自我修复能力较差,尤其针对大面积的软骨缺损,同时伴有软骨下骨的缺损。对此类损伤的修复十分棘手,目前研究报道一些相关软骨修复的新方法也探索了软骨相关的修复机制,在某种程度上存在优势和应用的可能性[9-10]。鉴于软骨细胞及成骨细胞黏附定植和增殖需要的材料孔隙不同,因此构建可诱导软骨与软骨下骨生成的一体化骨软骨支架就十分有必要。课题组已构建脱细胞真皮基质/生物矿化胶原一体化支架,其中真皮来源的细胞外基质来源于动物皮肤组织,可以调节细胞增殖、移行及分化;下层起到支撑作用,具有很好的力学性能和成骨诱导性,是骨软骨一体化多相支架骨层重要组成部分。
本实验应用一体化支架为骨软骨缺损的动物模型植入后,缺损处能够得到较好的充填,达到一定程度的修复,但修复组织与正常透明软骨相比仍具有差异。因此,本研究将一体化支架与脂肪干细胞联合应用,探讨该方法对骨软骨缺损的修复作用。结果表明,单纯支架以及支架与脂肪干细胞联合均能在术后 6 周即发挥促进修复的作用,但两者 ICRS 评分无显著性差异,证明后者的优势并未显现;术后 12 周,后者的 ICRS 评分显著高于前者,证实其治疗效果明显优于前者。HE 染色和番红 O-固绿染色也证实,单纯一体化支架以及 ADSCs 复合一体化支架均能够促进骨软骨缺损的修复,在损伤部位与正常组织交界处,一体化支架组并未见到透明软骨基质产生,而 ADSCs 复合一体化支架组则已经见到缺损区域底部出现透明软骨基质,且 ADSCs 复合一体化支架组的软骨细胞增殖更活跃,已有柱状排列的趋势,与正常软骨组织相似。因此,ADSCs 的加入将更有利于促进骨软骨缺损的修复。被认为是对关节软骨损伤修复起促进作用的关键生长因子,能够刺激蛋白多糖与 II 型胶原的合成;诱导间充质干细胞向软骨细胞分化并表达 II 型胶原和蛋白多糖;抑制金属蛋白酶的表达从而抑制胶原等细胞外基质的降解;参与调节软骨基质的构建或重构。尽管本研究已经证实一体化支架与脂肪间充质干细胞联合应用有利于骨软骨缺损的修复,且缺损与正常组织交界处有新生的柱状排列的软骨细胞,但经过 12 周的修复,仍未达到透明软骨/透明软骨样修复的目标。后续我们将延长实验时间,进一步观察再生支架与脂肪间充质干细胞联合应用对骨软骨缺损修复的最终结果。
