不同形貌MnO2的合成及其催化氧化甲苯性能的研究
2020-11-09王胜楠张泰格金东竹耿旭磊张学军刘威
王胜楠,张泰格,金东竹,耿旭磊,张学军,刘威
(沈阳化工大学 环境与安全工程学院,辽宁 沈阳 110000)
挥发性有机化合物(Volatile Organic Compounds,VOCs)是PM2.5 的前驱体也是O3生成的主要因素,严重污染环境,也对人类健康造成威胁[1-3]。甲苯作为一种典型的VOCs,其来源广泛、沸点低、毒性大、可以稳定的存在大气环境中,因此有必要对其特性采取合适的技术进行去除[4]。目前,去除VOCs 的方法众多,如吸附法、吸收法和催化氧化等,其中催化氧化法因其成本较低、二次污染小等优点已被广泛应用在VOCs 去除领域也是最有前途的方法之一[10-12]。近年来,金属氧化物被广泛用作催化剂和催化剂载体,金属氧化物比金属表现出更丰富和复杂的表面组成和结构[13-14]。且与贵金属催化剂相比,过渡金属氧化物的价格相对低廉,同时也能表现出较好的催化性能。其中锰氧化物由于价格低廉、稳定性好、催化活性优越等优点而广泛应用于VOCs 的催化氧化上[5-7]。且不同形貌的氧化锰、不同晶体结构的氧化锰以及多变的价态其活性存在明显不同的差异,因此广泛应用于催化领域[8-9]。例如,朱等人使用水热方法合成了一维(1D)α-、β-、γ-和δ-MnO2纳米棒,并发现其对CO 具有较好的催化活性[15]。Finocchio 等研究了Mn3O4、Mn2O3和MnO2的表面和氧化还原性质,认为在丙烷氧化过程中,体氧扩散速率对催化氧化速率有影响[16]。本文采用低温水热法制备了不同形貌的MnO2催化剂,通过对所得催化剂进行表征,并结合其甲苯催化氧化活性分析,找出了影响不同形貌MnO2催化剂催化活性的主要影响因素。
1 实验部分
1.1 催化剂制备
催化剂的制备方法为低温水热法,具体制备过程如下:在室温下,向4 个烧杯中分别加入30 mL 0.4 M 冰乙酸溶液,在搅拌条件下向4 个烧杯中分别加入0.47 g 高锰酸钾,随后持续搅拌30 min;将搅拌后的混合溶液分别转移到4 个自压反应釜中,密封后分别放置于预先升温至100、120、140 和180 ℃的鼓风干燥箱中反应12 h。反应结束后,将自压釜自然冷却至室温,随后将所得产物抽滤,洗涤后可得到的黑色沉淀。沉淀分别用乙醇和水冲洗几次后,放入60 ℃烘箱中干燥12 h。干燥完成后,所得样品在马弗炉中300 ℃条件下煅烧2 h,升温速率为1 ℃·min-1。煅烧完成后即可得到不同形貌的MnO2催化剂。
1.2 催化剂的表征
XRD 测试采用BRUKER D8 ADVANCE 型X 射线衍射仪,采用Cu-Kα作为射线源,测试范围为10~70°;扫描电子显微镜(SEM),采用日立SU8010(Hitachi,日本)高分辨冷场发射扫描电子显微镜测试;比表面积测定(BET)及孔径分布,测试采用SSA-6000 孔径比表面积分析;H2-TPR 测试和O2-TPD 在PCA-1200 型化学吸附仪(北京彼奥德电子技术公司)上测定。
1.3 催化活性测试
采用常压连续流固定床反应器对甲苯进行催化氧化活性评价。其中N2通入鼓泡器中将甲苯气体带出,随后经过内径为8 mm 的石英管中与催化剂发生反应,最后进入气相色谱对其浓度进行检测。K型热电偶对催化剂反应床层的进行温度检测,反应温度范围为100~400 ℃。将已压片过筛(粒径为40~60 目)的0.1 g 催化剂装入石英管后,通入反应气。反应气成分为:甲苯500×10-6、体积分数为20%的氧气以及作为平衡气纯度为99.9%的氮气,气体总流速为 100 mL·min-1,即空速为 60 000 mL/(g·h)。
2 结果与讨论
2.1 物相表征(XRD)
通过XRD 测试了不同反应温度下所得MnO2样品的晶体相,所得产物的粉末XRD 衍射谱图如图1所示。当反应温度为100 ℃时,产物的衍射峰属于典型的层状δ-MnO2的衍射峰,并且没其他杂相锰氧化物的衍射峰的出现。当反应温度为120 ℃时,产物的衍射峰属于典型的α-MnO2。当反应温度升高至140 ℃和180 ℃时,所得样品依然是α-MnO2,只是随着反应温度升高,所得样品的衍射峰逐渐变得高而尖锐,这一现象表明产物的结晶程度随反应温度的升高而增加。XRD 结果表明,反应温度对所得氧化锰样品的晶体结构及结晶程度有重要影响。
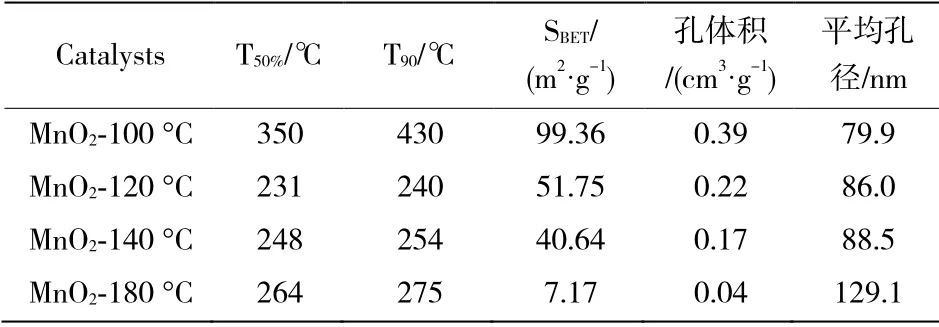
表1 催化活性、比表面积、空体积和平均孔径
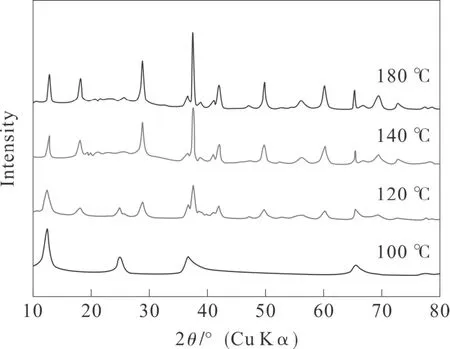
图1 不同反应温度下产物的XRD 谱图
2.2 形貌表征(SEM)
图2 为不同水热温度下制备的MnO2催化剂的扫描电镜(SEM)图像。从图中可以看出,随着水热温度的变化其出现明显不同的纳米结构。在100,120,140,180 ℃的反应条件下,所得的MnO2粒子分别为纳米球、纳米棒、纳米杆以及纳米棒+纳米线。纳米球的直径大小约为400 nm、纳米棒的直径大小约为100 nm、纳米杆的直径大小约为80 nm。这一结果表明,随着反应温度的升高,样品的形貌有从球形向棒状的转变趋势。结合XRD 和SEM 的表征可知,反应温度对产物的结构和形貌起着决定性的作用,而结构和形貌改变往往与催化剂的催化活性密切相关。

图2 不同水热温度时制备MnO2催化剂的SEM 图
2.3 比表面积分析分析(BET)
图3-1 和图3-2 分别代表不同水热温度下的MnO2催化剂的氮气吸附-脱附等温线和孔径分布曲线。如图3-1所示,所有催化剂均表现出IV 型等温线的典型特征,在相对压力(P/P0)为0.45~1.0之间表现出H3 滞回环,这表明所有催化剂均为介孔或中孔结构特征[22-23]。但值得注意的是,不同催化剂滞回环出现在不同的P/P0值下,并且表现出不同的吸附量,表明不同水热温度影响了MnO2样品的孔结构分布[23-24]。该现象可以通过图3-2所示的孔径分布曲线来证实,可以观察到孔径主要分布在0~500 nm 范围内,并且表现出不同位置的孔径分布峰。但同时也发现,MnO2-120 ℃和MnO2-140 ℃具有相似的回滞环,表明其具有相似的介孔结构,且比MnO2-100 ℃和MnO2-180 ℃催化剂表现出更多的非均匀介孔结构。各催化剂的比表面积、孔径分布结果列于表1,显然,MnO2-100 ℃具有最大的SBET(99 m2g-1)值,MnO2-120 ℃的SBET(51 m2g-1)和MnO2-140 ℃ SBET(40 m2g-1)的比表面积相差不大,而MnO2-180 ℃的SBET(7 m2g-1)最小。SBET值顺序如下:MnO2-100 ℃(99 m2g-1)>MnO2-120 ℃(51 m2g-1)>MnO2-140 ℃(40 m2g-1)>MnO2-180 ℃(7 m2g-1)。对比发现,虽然MnO2-100 ℃具有较大的比表面积、孔体积、平均孔径但其对甲苯的催化活性并不是最理想的。说明比表面积的大小不是影响催化剂的决定性因素。
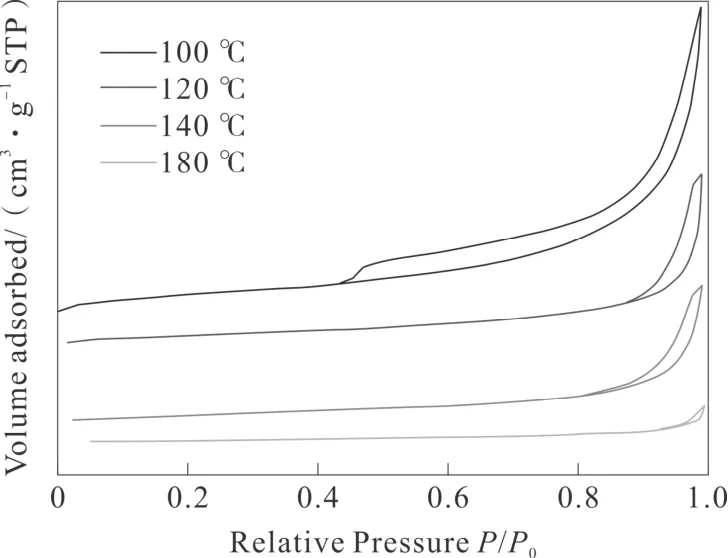
图3 -1 不同水热温度时制备MnO2催化剂的氮气吸脱附曲线
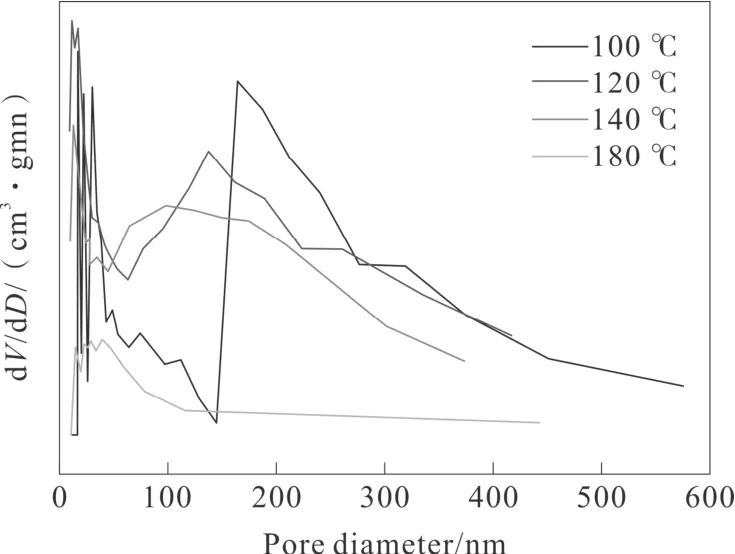
图3 -2 不同水热温度时制备MnO2催化剂的孔径分布图
2.4 还原性分析
催化剂氧化还原性能对催化反应有很大影响,通过H2-TPR 实验探讨了不同水热温度下制备的MnO2的氧化还原性能,结果如图4所示。如图4所示,MnO2-120 ℃和MnO2-140 ℃催化剂具有相似的还原峰和还原温度且H2-TPR 曲线表现出两个明显的还原过程,第一个还原峰大约出现在320 ℃左右,第二个还原峰大约出现在340 ℃左右。而MnO2-100 ℃( 还原峰温度约 377 ℃)和MnO2-180 ℃(还原峰温度约425 ℃)具有相似的还原峰型但还原温度相差较大且均表现出一个不对称的还原峰。所有样品的还原峰可分为三部分:MnO2→Mn2O3→Mn3O4→MnO[17-18]。从总体上也能够发现,MnO2-120 ℃具有最低的还原温度和最大的还原峰,这说明MnO2-120 ℃拥有最好的氧化还原性能[19]。有研究表明,催化剂氧化还原性能的改善能够促使更多的活性氧的产生,从而提高催化剂对甲苯的催化去除性能。因此,MnO2-120 ℃可能拥有更好的催化活性。
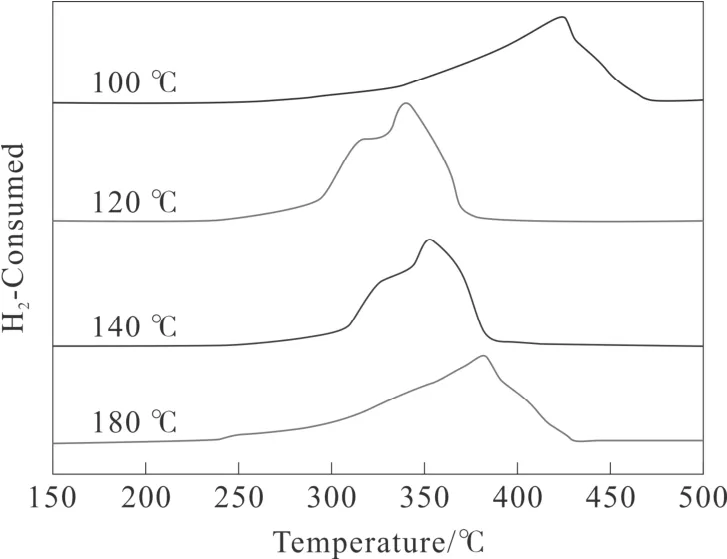
图4 不同水热温度时MnO2催化剂的H2-TPR 谱图
2.5 氧气程序升温脱附分析
样品的氧吸附能力是影响催化性能的关键因素[20]。通过O2-TPD 实验对催化剂在50~900 °C 温度范围内的氧吸附能力进行测试,结果如图5所示。
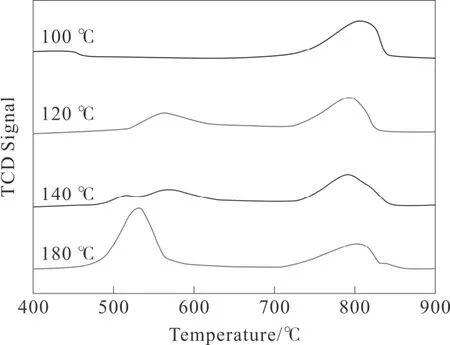
图5 不同水热温度时MnO2催化剂的O2-TPD 谱图
样品在400~900 °C 的温度范围内显示出两种解吸峰,其在400~700 °C 之间的解析峰归属于氧原子与Mn3+的结合(β),700~900 °C 的温度范围的解吸峰归属于氧原子与Mn4+(γ)的结合。从图中明显的发现,MnO2-120 °C 和MnO2-140 °C 具有相似的解析温度和峰面积。其在530 °C 的解析峰温度明显低于其他催化剂,这表明它拥有最多的表面氧空缺以及最弱的氧结合能力,这有利于催化反应的进行。文献报道,较大的解吸峰强度,较低的氧气解吸温度,表示较高的氧迁移率,通常认为是促进催化氧化VOCs 过程中的关键因素[21]。因此,水热温度的差异会影响催化剂的氧流动性能和氧空缺数量。
3 催化氧化甲苯活性评价
不同形貌的MnO2氧化物催化剂催化氧化甲苯性能的活性如图6所示。从图6 可以看出,所有样品的甲苯的转化率随反应温度的升高而增加,并且在430 ℃以下都可以将甲苯完全分解。但也能够明显的发现不同水热温度条件下所得样品对甲苯的催化氧化明显不同。MnO2-120 ℃的T50%(231 ℃,甲苯转化率达到50%时的温度)和T90%(254 ℃,甲苯转化率达到90%时的温度)均低于其他样品。表1 总结了每种催化剂的催化活性数据,根据T50%和T90%大小,甲苯的催化活性遵循以下顺序:MnO2-120 ℃(T50%:230 ℃;T90%:240 ℃)>MnO2-140 ℃(T50%:248 ℃;T90%:254 ℃)>MnO2-180 ℃(T50%:264 ℃;T90%:275 ℃)>MnO2-100 ℃(T50%:350 ℃;T90%:430 ℃)。且从数据明显发现,MnO2-120 ℃和MnO2-140 ℃催化活性较好,且其两者具有相似的催化活性。
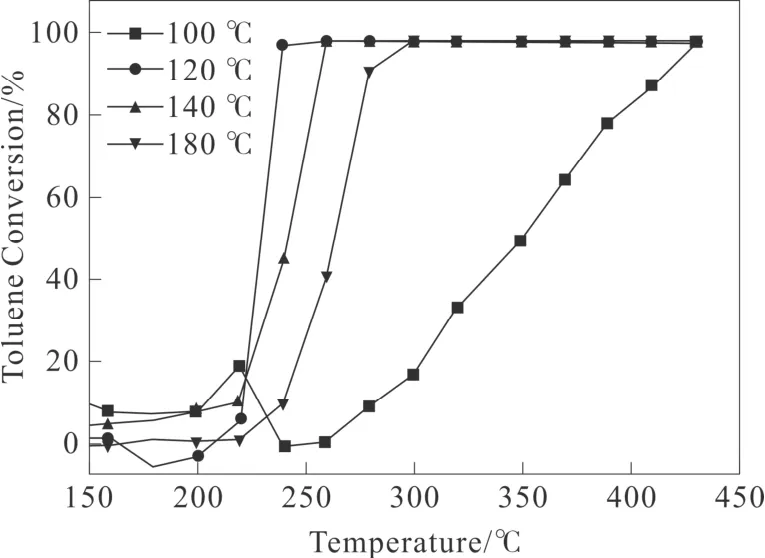
图6 不同水热温度下产物对甲苯的催化活性谱图
4 结论
本文采用低温水热法,合成了不同形貌的MnO2催化剂。通过对甲苯的去除研究了其催化氧化性能,并通过多种表征技术测试探讨了其理化性质。粉末XRD 的表征结果表明,合成的四种催化剂均分属不同结构的MnO2,从层状的δ-MnO2转变为α-MnO2且衍射峰逐渐变锐,表明产物的结晶程度随反应温度的升高而增加。4 种MnO2样品都可以在低于430 ℃将甲苯完全转化。根据T50%和T90%的值,甲苯的催化活性遵循以下顺序:MnO2-120 ℃(T50%:230 ℃;T90%:240 ℃)>MnO2-140 ℃(T50%:248 ℃;T90%:254 ℃)>MnO2-180 ℃(T50%:264 ℃;T90%:275 ℃)>MnO2-100 ℃(T50%:350 ℃;T90%:430 ℃)。说明较好的低温还原性能和较大的吸附氧浓度有利于催化活性的提高。
