SOX6 基因对H2 O2 诱导的星形胶质细胞损伤的机制
2020-11-09肖宗宇张广华许常林
巨 虎,肖宗宇,张广华,许常林
(青海大学附属医院神经外科,西宁 810000)
星形胶质细胞(Astrocyte,AS)是神经系统中数目众多的细胞之一,具有复杂多样的生物学特性,帕金森综合征、阿尔茨海默症等多种中枢神经系统疾病均与AS 细胞活化及功能异常有关[1-2]。 过氧化氢(H2O2)是人体内的主要活性氧簇(ROS),有研究证实,H2O2可诱导AS 细胞凋亡,而降低H2O2诱导的氧化应激可减少AS 凋亡[3-4]。 目前已有大量研究使用H2O2建立AS 细胞的氧化损伤模型[5]。SOX6 是SOX 基因家族D 亚家族成员之一,参与了早期胚胎发育及器官形成过程,是软骨、肌肉、中枢神经系统发育过程中一个重要的调控因子[6]。 有研究显示,向大鼠侧脑室注射miR-219 激动剂可抑制少突胶质细胞中SOX6 的表达,促进细胞成熟,从而改善由脂多糖导致的全身炎症所引起的新生鼠少突胶质细胞成熟障碍[7];miR-499 过表达可通过直接靶向SOX6 抑制抗缺氧诱导的PC12 细胞损伤,促进细胞增殖,降低LDH 漏出量,抑制细胞凋亡[8]。以上研究提示SOX6 基因在中枢神经系统损伤中有重要作用。 但SOX6 对H2O2诱导的AS 细胞损伤影响及机制尚未明确。 因此,本研究通过RNA 干扰技术沉默AS 细胞SOX6 表达,旨在探讨SOX6 表达抑制对AS 细胞凋亡的影响及机制。
1 材料和方法
1.1 实验动物
8 周龄的SPF 级雄性SD 大鼠2 只,体重(200±20)g,购自上海市公共卫生临床中心[SCXK(沪)2015-0002],[SYXK (青) 2016-0001]。 实验过程中严格遵守3R 原则。
1.2 主要试剂与仪器
DMEM 培养基(货号:12800-082)、FBS(货号:100099141)均购自美国Gibco 公司;BCA 蛋白浓度测定试剂盒(货号:P0012)购自上海碧云天生物技术有限公司;LDH 试剂盒(货号:MAK066)购自美国Sigma 公司;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(货号:KGA108-1)购自江苏凯基生物技术股份有限公司;JC-1 探针(货号:T3168)购自美国Molecular Probes;SOX6 抗体(货号:ab64946)购自英国Abcam;Cyt.C(货号:12963)、caspase3(货号:9662)、caspase9(货号:9502)、Bcl-2(货号:3498)、Bax(货号:2772)和p-AKT 抗体(货号:4060)均购自美国CST;MultiskanTMFC 酶标仪购自美国Thermo;FACSCalibur 流式细胞仪购自美国BD。
1.3 实验方法
1.3.1 大鼠AS 取材及培养
参照McCarthy 等[9]方法加以调整,建立AS 体外纯化培养体系。 无菌条件下取大鼠大脑,DHanks 缓冲液漂洗,眼科剪剥离血管和脑膜,剪碎大脑皮质,用胰酶进行细胞消化,然后加入DMEM 完全培养基,离心,弃掉上清,用含15% FBS 的完全培养基重悬细胞,以200 目筛网过滤,接种细胞于培养瓶中,在37℃、5%CO2培养箱孵育1 h,取出未贴壁的细胞悬液,以1.0×106/mL 浓度接种于培养皿内,于培养箱内继续培养,2~3 d 更换一次培养液,8 ~9 d 细胞融合度达90%时,37℃震荡以去除小胶质细胞和少突胶质细胞,PBS 液洗涤,换液,继续培养1 d后,胰酶消化传代。 取第3 代细胞进行实验。
1.3.2 实验分组及处理
本实验共分为4 组,即阴性对照组(NC 组):AS转染无干扰作用的siRNA;H2O2组:20 μmol/L 的H2O2处理AS 细胞24 h;H2O2+NC 组:无干扰作用的siRNA 转染AS 细胞24 h 后,20 μmol/L 的H2O2处理细胞24 h;H2O2+si-SOX6 组:SOX6 特异性siRNA 转染AS 细胞24 h 后,20 μmol/L 的H2O2处理细胞24 h。 其中siRNA 转染参照LipofectamineTM2000 转染说明(美国Invitrogen),转染前1 d,以2×105个/孔接种第3 代AS 细胞于6 孔板,于培养箱内常规培养,转染时细胞达60%~70%融合度,分别制备NC 及si-SOX6 与LipofectamineTM2000 复合物,将复合物加入6 孔板相应孔内,于培养箱内常规孵育6 h,弃上清培养液,加入DMEM 完全培养基,培养48 h。
1.3.3 Western blotting
加入适量的RIPA 裂解液提取总蛋白,BCA 法检测蛋白浓度,蛋白与适量5×上样缓冲液混匀,100℃,5 min,煮沸变性。 上样,每孔道40 μg,经SDS-PAGE 分离蛋白,转PVDF 膜,室温摇床封闭1 h,将膜加入已稀释的一抗中(1 ∶1000),4℃孵育过夜,洗膜3 次,加稀释好的HRP 标记的羊抗鼠二抗(1 ∶3000),室温摇床轻微摇动孵育1 h,洗膜,显影。Quantity One 软件目的蛋白相对表达量。 实验重复3 次。
1.3.4 LDH 试剂盒检测细胞毒性
收集按照1.3.2 处理的各组细胞上清液,根据LDH 试剂盒说明配制试剂盒并加样,在37℃反应30 min,酶标仪测定492 nm 各孔吸光度值。
1.3.5 流式细胞术分析细胞凋亡率
根据试剂盒说明书进行操作检测细胞凋亡率。收集按照1.3 处理的各组细胞,PBS 洗涤细胞,1×Annexin-binding buffer 200 μL 重悬细胞,分别加Annexin V-FITC 和PI 各5 μL,避光室温反应15 min,再加入1× Annexin-binding buffer 400 μL,流式细胞仪上机检测(1 h 内)。 实验重复3 次。
1.3.6 线粒体膜电位检测
收集按照1.3 处理的各组细胞,PBS 洗涤细胞,加入10 μg/mL 的JC-1,在37℃孵箱中孵育30 min,弃去细胞液体,PBS 洗涤细胞,以洗尽JC-1 残余,通过激光共聚焦显微镜观察荧光情况。 实验重复3 次。
1.4 统计学方法
计量数据均用平均数±标准差( ¯x ±s)表示,采用SPSS 21.0 软件进行数据分析,两组数据采用独立样本t检验,多组间数据比较采用单因素方差分析,两两比较采SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 干扰SOX6 表达效果
通过Western blotting 检测SOX6 特异性siRNA转染AS 细胞效果,结果如图1 所示,H2O2可明显上调AS 细胞SOX6 蛋白表达,而细胞转染si-SOX6 后SOX6 表达明显降低(P<0.05)。
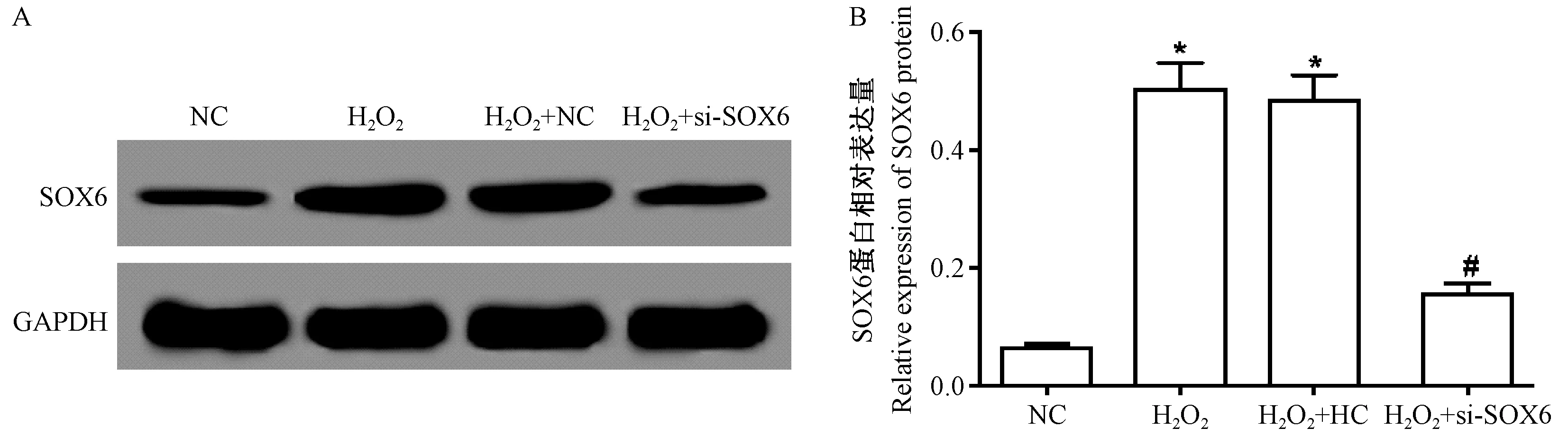
图1 SOX6 特异性siRNA 转染AS 细胞效果(n=3)Figure 1 Effects of SOX6-specific siRNA transfection on AS cells
2.2 干扰SOX6 对H2O2 诱导的AS 细胞毒性影响
如图2 所示,H2O2处理AS 细胞后,细胞毒性明显升高,而转染si-SOX6 后细胞毒性明显降低(P<0.05)。
2.3 干扰SOX6 可抑制H2O2 诱导的AS 细胞凋亡
流式细胞术结果如图3 所示,H2O2可明显促进AS 细胞凋亡,而细胞转染si-SOX6 可明显减弱H2O2对细胞凋亡诱导作用(P<0.05)。
2.4 干扰SOX6 可提高H2O2 诱导的AS 细胞线粒体膜电位
运用JC-1 探针,采用激光共聚焦检测细胞内线粒体膜电位变化,结果如图4 所示,H2O2可明显降低AS 细胞膜电位,干扰SOX6 后细胞膜电位明显升高(P<0.05)。
2.5 干扰SOX6 可抑制H2O2 诱导的AS 细胞线粒体凋亡
如图5 所示,H2O2可明显上调Cyt.C、caspase3和Bax 表达,下调Bcl-2 表达,而干扰SOX6 表达可减弱H2O2对Cyt.C、caspase3、caspase9 和Bcl-2 表达下调及Bax 表达上调作用(P<0.05)。
2.6 干扰SOX6 对H2O2 诱导的AS 细胞PI3K/AKT 信号通路的影响
如图6 所示,H2O2可明显下调p-AKT 表达,而干扰SOX6 表达后p-AKT 表达明显升高(P<0.05)。
3 讨论
AS 细胞广泛分布于中枢神经系统各个区域,与多种神经系统疾病发生发展有关。 目前认为这些神经系统疾病发病机制与氧化应激存在密切关系[10]。 AS 细胞是一类易受损敏感的细胞,氧化损伤后可阻碍其保护功能,从而成为神经损伤发展过程中的促进因子[11]。 因此,保护AS 细胞免受氧化应激损伤,对于中枢神经系统疾病损伤保护具有重要意义。
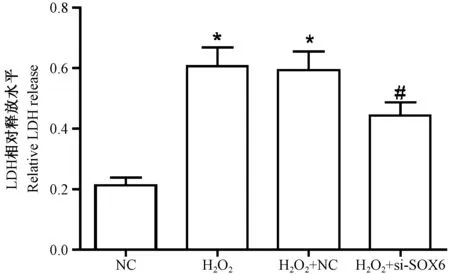
图2 干扰SOX6 对H2O2 诱导的AS 细胞毒性影响(n=3)Figure 2 Effects of SOX6 interference on toxicity of AS cells induced by H2O2

图3 干扰SOX6 对H2O2 诱导的AS 细胞凋亡影响(n=3)Figure 3 Effects of SOX6 interference on apoptosis of AS cells induced by H2O2
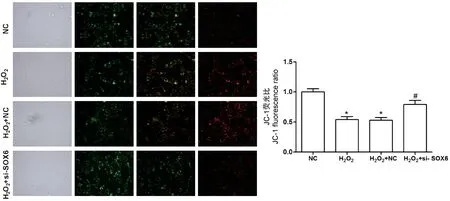
图4 干扰SOX6 对H2O2 诱导的AS 细胞膜电位的影响(n=3)Figure 4 Effects of SOX6 interference on membrane potential of AS cells induced by H2O2
SOX6 是SOX 基因家族D 亚家族成员之一,是一个关键的器官发展及细胞分化调节器,参与神经分化和神经发育过程[12]。SOX6 对AS 细胞生长影响及机制尚未明确。 已有研究表明,过表达miR-499 可通过靶向SOX6 抑制抗缺氧诱导的PC12 细胞损伤,促进细胞增殖,抑制LDH 漏出,并抑制细胞凋亡[8]。 鉴于此,本研究通过RNA 干扰技术沉默AS 细胞SOX6 表达,研究抑制SOX6 表达对H2O2诱导的AS 细胞凋亡的影响。 结果显示,H2O2可明显上调AS 细胞表达,而干扰SOX6 表达后细胞SOX6表达明显降低。 说明成功建立了抑制SOX6 表达的AS 细胞,进一步研究发现,抑制SOX6 表达可明显降低H2O2对AS 细胞的凋亡促进作用,提示抑制SOX6 表达可降低AS 细胞损伤。

图5 干扰SOX6 对H2O2 诱导的AS 细胞线粒体凋亡相关蛋白表达影响(n=3)Figure 5 Effect of SOX6 interference on the expression of mitochondrial apoptosis pathway-related proteins in AS cells induced by H2O2
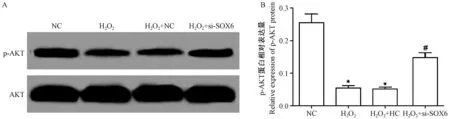
图6 干扰SOX6 对H2O2 诱导的AS 细胞PI3K/AKT 信号通路的影响(n=3)Figure 6 Effect of SOX6 interference on PI3K/AKT signaling pathway in AS cells induced by H2O2
研究表明,细胞中线粒体膜电位降低,可促进细胞色素C(Cyt.C)释放至胞浆,最终激活caspase家族酶caspase3,从而引发细胞凋亡[13-15]。 在细胞中,Bcl-2 和Bax 分别通过调控下游基因发挥抗凋亡作用和促凋亡作用,Bcl-2 可通过阻碍线粒体破坏、Cyt.C 释放及caspase 家族激活,从而抵抗神经细胞凋亡[16-17]。 有研究表明,H2O2刺激可明显降低AS细胞线粒体膜电位[18]。 本研究结果显示,干扰SOX6 表达可明显提高线粒体膜电位,下调Cyt.C、caspase3 和Bax 表达,上调Bcl-2 表达,提示干扰SOX6 表达可通过线粒体通路抑制细胞凋亡,对AS细胞损伤起保护作用。
PI3K/AKT 信号通路通过多种途径调控神经细胞凋亡等过程,对神经细胞存活至关重要。 有研究证实,PI3K/AKT 信号通路参与帕金森氏病、阿尔茨海默症等动物模型的发病过程[19-20]。 也有多项研究表明,激活PI3K/AKT 信号通路对神经损伤有保护作用[21-22]。 AKT 是PI3K/AKT 信号通路的中心环节,AKT 活化后可通过调节下游相关基因表达而影响细胞生物学过程。 有研究表明,氧化应激可明显抑制AS 细胞PI3K/AKT 信号通路[23-24]。 本研究结果显示,干扰SOX6 表达可明显上调H2O2诱导的AS 细胞中p-AKT 表达。 提示干扰SOX6 表达对H2O2诱导AS 细胞凋亡的影响与激活PI3K/AKT 信号通路有关。
综上所述,本研究发现,在AS 细胞中干扰SOX6 基因表达可通过抗凋亡途径保护H2O2诱导的AS 损伤,此保护作用与线粒体通路及PI3K/AKT信号通化激活有关。 提示SOX6 在神经系统损伤中的重要作用,值得进一步深入探究。
