可溶性识别分子PTX3 的研究进展
2020-11-09彭婉君赵彬彬刘江宁
彭婉君,赵彬彬,武 婧,陈 鑫,牛 栋,刘江宁
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家卫健委人类疾病比较医学重点实验室,北京 100021)
穿透素-3(pentraxin 3,PTX3),与C 反应蛋白(C reactive protein,CRP)、血清淀粉样蛋白P(serum amyloid P component,SAP)同属于正五聚蛋白家族。该家族在进化中高度保守,具有循环多聚结构的特点,是天然免疫的重要组成部分。 研究发现,相比CRP 和SAP,PTX3 的基因序列在小鼠与人中同源性极高,因此,可通过研究小鼠的PTX3 蛋白来了解该蛋白在人体中的功能情况。 PTX3 是一种典型急性期蛋白,在炎症刺激下由炎症细胞因子进一步诱导产生,参与对抗外源性的微生物感染。 此外,在组织修复和癌症调节等多种生物过程中发挥着重要的作用。
1 PTX 家族
天然免疫反应是机体抵御外界微生物入侵的第一道防线,由体液反应与细胞反应两部分组成。与适应性免疫不同,天然免疫受体是一种胚系基因编码的受体,称为模式识别受体(pattern recognition receptor,PRR),它识别病原体表面的保守结构,即所谓的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)。 PRR 可分为细胞相关受体和可溶性分子两大类。 细胞相关受体包括内吞受体和信号受体,例如Toll 样受体(Toll-like receptors, TLRs), NOD 样受体( the NOD-like receptors)等;可溶性分子是体液天然免疫的重要组成部分, 包括补体成分、 甘露糖结合凝集素(mannose-binding lectin,MBL)、表面活性蛋白、纤维胶原素(ficolins)、正五聚蛋白(pentraxins,PTXs),它们在结构和表达方面各不相同,但都具有激活补体、中和病原体和调节凋亡细胞以及炎症调节等功能[1]。
正五聚蛋白超家族是一种在遗传进化上保守的多聚体蛋白家族,具有一个独特的主基序—由200 个氨基酸组成的长结构域。 该家族依据分子量大小及结构,可分为长链PTX 和短链PTX 两类。短链PTX 包括CRP 和SAP,其分子量均小于25×103;长链PTX 包括PTX3、PTX4、NP1(neuronal pentraxin 1)和NP2,其中,PTX3 是最早发现的长链PTX。
2 PTX3 的基因及蛋白结构
人类和小鼠的PTX3 基因均定位于3 号染色体,由2 个内含子和3 个外显子组成,内显子分别编码蛋白的前导肽、氨基末端和C 端PTX 结构域。 该基因的近端启动子具有多个调控元件,包括Pu1、AP-1、NF-κB、SP1 和NF-IL-6,促炎因子例如肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素-1(interleukin-1,IL-1)可以通过结合NF-κB 对其发挥诱导作用[1]。 除此之外,PTX3 转录也可被PI3K/Akt 和JNK 通路,或通路下游调节因子FUS/CHOP 易位激活。 近期研究表明,表观遗传机制可调控PTX3 基因的表达,特别是PTX3 增强子和启动子的高度甲基化可导致人癌症中PTX3 基因沉默[2-3],而较低的甲基化与冠状动脉疾病患者血浆中更高的PTX3 水平具有很好的相关性[4]。
PTX3 是由8 个亚基组成的同源多聚糖蛋白,共含有381 个氨基酸,其中包括由17 个氨基酸组成的信号肽。 其C 端结构域与CRP 和SAP 同源,8 个高度保守的氨基酸序列(HxCxS/TWxS,x 是任意氨基酸)组成了PTX 家族的标志性序列;而N 端结构域与其他已知蛋白质没有序列相似性[5]。 CRP 和SAP 的钙结合位点在PTX3 的五聚体结构域中缺失,这表明了不同正五聚蛋白结合特性的差异,即PTX3 与C1q 的相互作用是非钙离子依赖的,而CRP 和SAP 会生成钙离子黏附带[1]。 PTX3 蛋白具有复杂的四元结构,其特征是两个四聚体通过共价键连接在一起,形成一个340×103的八聚体,其与四聚体相比具有更大的功能活性[6]。 目前已在Asn220 的C 端区域发现了一个单一的N-糖基化位点,该糖苷基调控PTX3 与其他可溶性模式识别分子的相互作用,包括C1q、 factor H 和ficolin-1。 独特的四元结构和蛋白糖基化状态决定了PTX3 对配体的识别,并最终决定了其生物学功能。 PTX3 基因及蛋白结构示意图见图1。
3 PTX3 的产生
尽管PTX3 与CRP 和SAP 基因序列相似度较高,但其在来源细胞和诱导产生方面表现出重要差异。 CRP 和SAP 主要由肝脏在IL-6 的刺激下产生,而PTX3 可通过Toll 样受体激动剂、炎性细胞因子(IL-1β 和TNF-α 等)、微生物组成成分如脂多糖(lipopolysaccharide, LPS) 或外膜蛋白 A (outer membrane protein A,OmpA)等刺激,诱导多种细胞类型进行分泌表达,其中包括树突细胞(dendritic cells,DC)、单核细胞、巨噬细胞、成纤维细胞、滑膜细胞、软骨细胞、脂肪细胞、上皮细胞、血管内皮细胞、平滑肌细胞、间质细胞、颗粒细胞和神经胶质细胞等。 T 淋巴细胞、B 淋巴细胞及NK 细胞均不表达PTX3,而PTX3 在成熟中性粒细胞中的表达仍存在争议。 Jaillon 等[7]研究发现,未成熟的中性粒细胞前体在骨髓分化过程中表达PTX3 转录本并合成蛋白,而成熟的外周血中性粒细胞不能表达PTX3 mRNA,但PTX3 可储存于成熟中性粒细胞中,并在微生物及炎症信号的刺激下释放。 而Imamura 等[8]研究表明LPS 可刺激刚分离的成熟中性粒细胞表达PTX3 mRNA。

图1 PTX3 基因及蛋白结构Figure 1 The gene and protein organization of PTX3
4 PTX3 的功能
PTX3 是体液性天然免疫系统的一种可溶性模式识别受体,被称为“抗体前体”,可识别外源微生物,作为调理素调节炎症反应。 PTX3 由吞噬细胞产生,由中性粒细胞储存,经刺激后产生释放可与部分抗原结合,被巨噬细胞或中性粒细胞上Fcγ 受体IIa(FcγRIIa/CD32)和补体受体3(CD11b/CD18)识别,从而增强其吞噬活性,促进机体天然免疫。近期有研究表明,由脾边缘区(marginal zone,MZ)周围的一组中性粒细胞释放的PTX3 可与脾MZ B 细胞结合。 脾脏中性粒细胞具有粒细胞-巨噬细胞集落刺激因子 ( granulocyte-macrophage colonystimulating factor,GM-CSF)相关的功能特征,可进行免疫活化并增强PTX3 的释放;MZ B 细胞是一群天然的抗体生成B 淋巴细胞,位于血液循环系统与适应性免疫系统之间,对T 细胞依赖抗原和非依赖抗原都能产生快速的抗体反应。 中性粒细胞分泌的PTX3 以非FcγR 依赖方式结合MZ B 细胞、B-1 细胞和不成熟的B 细胞,促进B 细胞产生的免疫球蛋白从lgM 到lgG 的转换。 同时,PTX3 也可增强IgM和IgG 对血源性包膜肺炎链球菌、包膜多糖或细菌碳水化合物等的中和反应。 因此,PTX3 通过作为MZ B 细胞的内源性佐剂,连接起了天然免疫系统和适应性免疫系统[9]。
PTX3、CRP 和SAP 均可识别多种补体成分,并在多种生理病理条件下激活补体系统。 CRP 和SAP 以聚集或配体结合的形式与经典补体途径(classical pathway,CCP)的识别单元C1q 相互作用,从而导致CCP 在病原体上的激活[10]。 而PTX3 与C1q 结合既不需要蛋白聚集也不需要钙离子,C1q通过其球状结构域与PTX3 相互作用,激活CCP,促进C3、C4 沉积。 此外,PTX3 也可通过与ficolin-1、ficolin-2 和MBL 的特异性相互作用调控凝集素补体通路。 Ma 等[11]发现 PTX3 可促进烟曲霉(A.fumigatus)感染后机体内ficolin -2 介导的补体沉积。这两种补体通路途径在下游都汇聚到C4b2a 转化酶,涉及相同的下游分子,导致C3 转化,C3 转化最终可以启动补体旁路途径的级联放大反应[12]。
除了促进补体激活,PTX3 也对补体激活有负调控作用。 一方面,PTX3 可在经典途径中通过阻断C1q 与免疫球蛋白的相互作用而抑制补体活化。另一方面,PTX3 是一种独特的H 因子(Factor H,FH)的配体,它识别FH 的两个结合位点,SCR7 和SCR19-20[13]。 而FH 是一种抑制因子,PTX3 可募集FH,同时二者的结合不会干扰FH 的抑制作用,因此这种结合有助于防止补体过度活化,在炎症的控制中发挥重要作用。 研究发现PTX3 的分泌可由氧化应激诱导,而氧化应激是视网膜色素上皮细胞的年龄相关性黄斑变性( age-related macular degeneration,AMD)的主要病因之一。 PTX3 缺乏症患者体内由于PTX3 的缺失而放大了这种氧化应激所引起的补体活化,造成症状加重。 这表明PTX3可通过与视网膜色素上皮细胞中的FH 相互作用,抑制补体和炎性小体的过度激活[14]。
上述的调节补体功能是PTX3 对炎症反应发挥调控作用的主要机制之一。 除了参与补体活化外,PTX3 还通过调控炎症细胞的募集来参与炎症反应。 该效应由PTX3 与粘附分子P-选择素(Pselectin)的相互作用来介导,二者结合可减少炎症部位对中性粒细胞募集,抑制白细胞滚动进而抑制炎症细胞浸润[15]。 近期有研究表明,PTX3 缺乏症会导致气道高反应性增强、黏液生成增多和IL-17a主导的肺部炎症加剧,说明PTX3 在过敏性炎症的发展过程中具有调节作用[16]。
5 PTX3 在人类疾病中的作用
5.1 感染性疾病
PTX3 参与机体抵抗微生物入侵的免疫反应,通过不同的机制发挥其抗感染作用,包括调理作用、促进吞噬、调节补体活性、与抗菌蛋白相互作用等。 最早发现PTX3 抗真菌感染功能的是其对烟曲霉(Aspergillus fumigatus) 和铜绿假单胞菌(Pseudomonas aeruginosa)感染的抑制作用,PTX3 与两种真菌结合增强巨噬细胞与中性粒细胞对其识别能力,促进细胞吞噬功能,发挥调理作用。 近期Ciancarella 等[17]研究发现PTX3 有助于机体细胞外志贺氏菌(Shigella)的清除,志贺氏菌是一种侵染结肠和直肠粘膜的人类肠道致病菌,可引起有害的炎症反应。 肺炎球菌感染可使肺上皮细胞高表达PTX3,同时,PTX3 高表达使相关细胞因子释放增加,因此PTX3 对细菌感染也存在调控作用。
在抗病毒入侵方面,Reading 等[18]发现人类和小鼠的PTX3 可与流感病毒结合,介导一系列抗病毒反应,包括抑制血细胞凝集、中和病毒和抑制病毒神经氨酸酶的活性。 PTX3 的抗病毒活性通过其唾液酸配体与病毒血凝素糖蛋白结合来发挥作用。因此,PTX3 在宿主感染早期具有新的抗病毒作用,可作为潜在的治疗靶点。
另一方面,PTX3 也可作为多种感染性疾病的生物标志物。 肺曲霉病、肺结核、登革热病毒感染、脑膜炎球菌病、钩端螺旋体病、志贺氏菌病、脓毒症和病毒性呼吸道感染患者血浆中PTX3 水平显著升高,与疾病的严重程度有显著相关性,可作为预后的重要预测因子[19-20]。 通过研究慢性丙型肝炎(HCV)患者抗病毒治疗前PTX3 与炎症活性、纤维化的生化和病理学参数的关系,发现HCV 患者的PTX3 水平随着肝纤维化程度的加剧而升高;因此PTX3 作为显著纤维化的单一生物标志物,提供了新的临床诊断指标[21]。 PTX3 在感染性疾病中的作用示意图见图2。
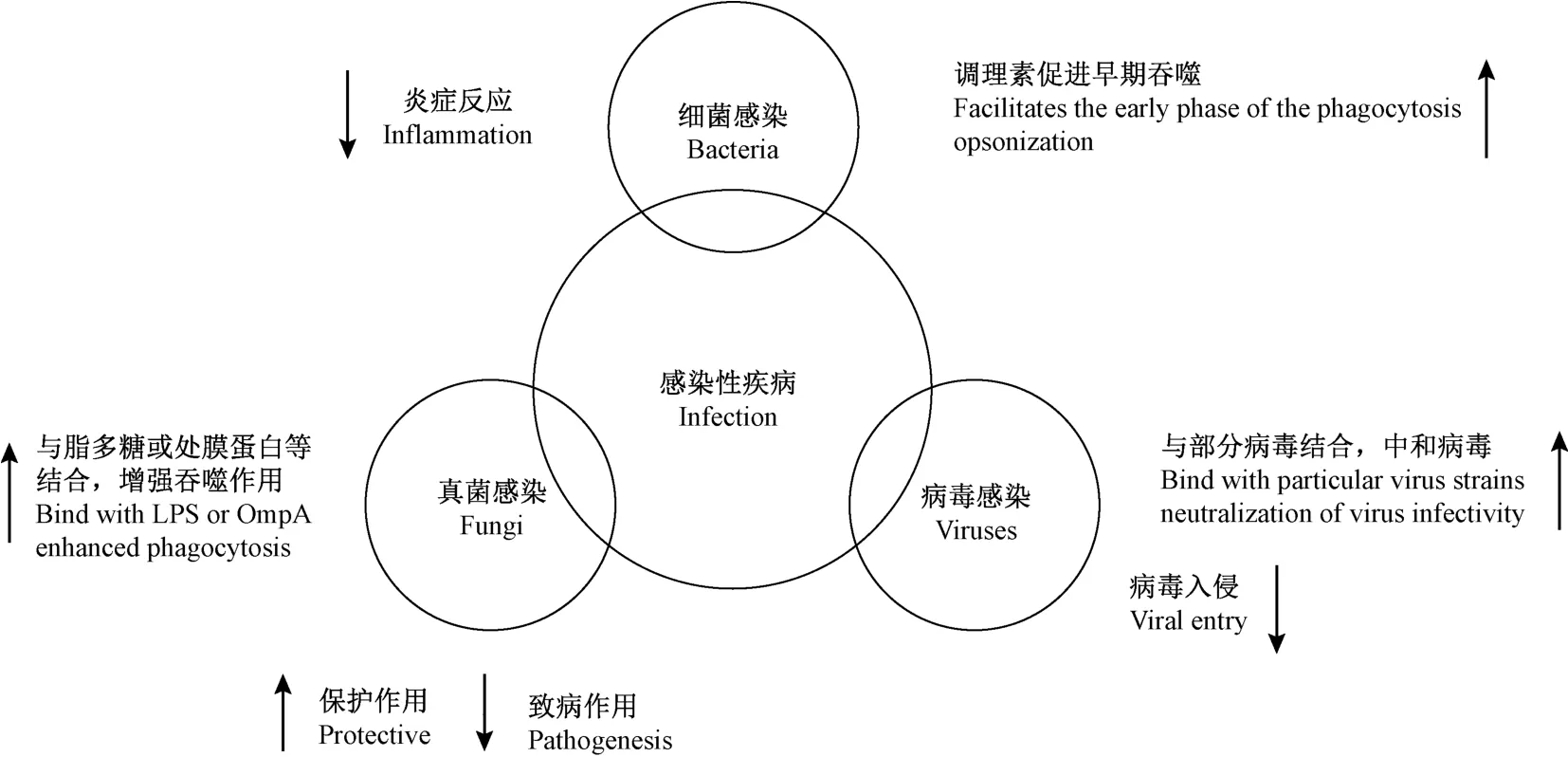
图2 PTX3 在感染性疾病中的作用Figure 2 Role of PTX3 in infection
5.2 癌症
慢性炎症,尤其是由微生物感染引起的炎症反应与癌症密切相关,同时癌症相关炎症是导致癌细胞遗传异质性的重要原因之一。 PTX3 具有调节炎症反应的功能,提示其在控制肿瘤发展方面也能发挥相应作用。
利用平滑肌肉瘤疾病模型,Eduardo 等[3]发现PTX3 可招募并结合FH,调节肉瘤细胞上的C3 沉积,促进C5a、CCL2 释放,进而减少M2 表型的巨噬细胞聚集,通过调节补体依赖的肿瘤相关炎症,在小鼠和人体内发挥外源性抑癌基因作用。 通过对经活检确诊为小细胞肺癌( small-cell lung carcinoma,SCLC)患者的石蜡包埋标本进行PTX3表达量检测,发现PTX3 的高表达与SCLC 肿瘤细胞的侵袭行为有相关性,表明它可能是SCLC 的一种预后标志物,同时也是SCLC 治疗的潜在分子靶点[22]。
最近研究表明,PTX3 不仅具有抑制癌症的保护作用,也有促进肿瘤细胞迁移、侵袭和增加巨噬细胞趋化的负调节作用。 例如,胃癌来源的PTX3 可促进巨噬细胞的募集,可能促进胃癌相关炎症的发展[23]。 在头颈部鳞状细胞癌(head and neck squamous cell carcinomas,HNSCCs)中,油酸通过AKT/NF-κB 通路诱导PTX3 产生,而PTX3 提高了MMP-3 和波形蛋白的表达,增强了肿瘤细胞与内皮细胞的相互作用,促进了肿瘤的迁移与侵袭[24]。 PTX3 在癌症中的作用示意图见图3。
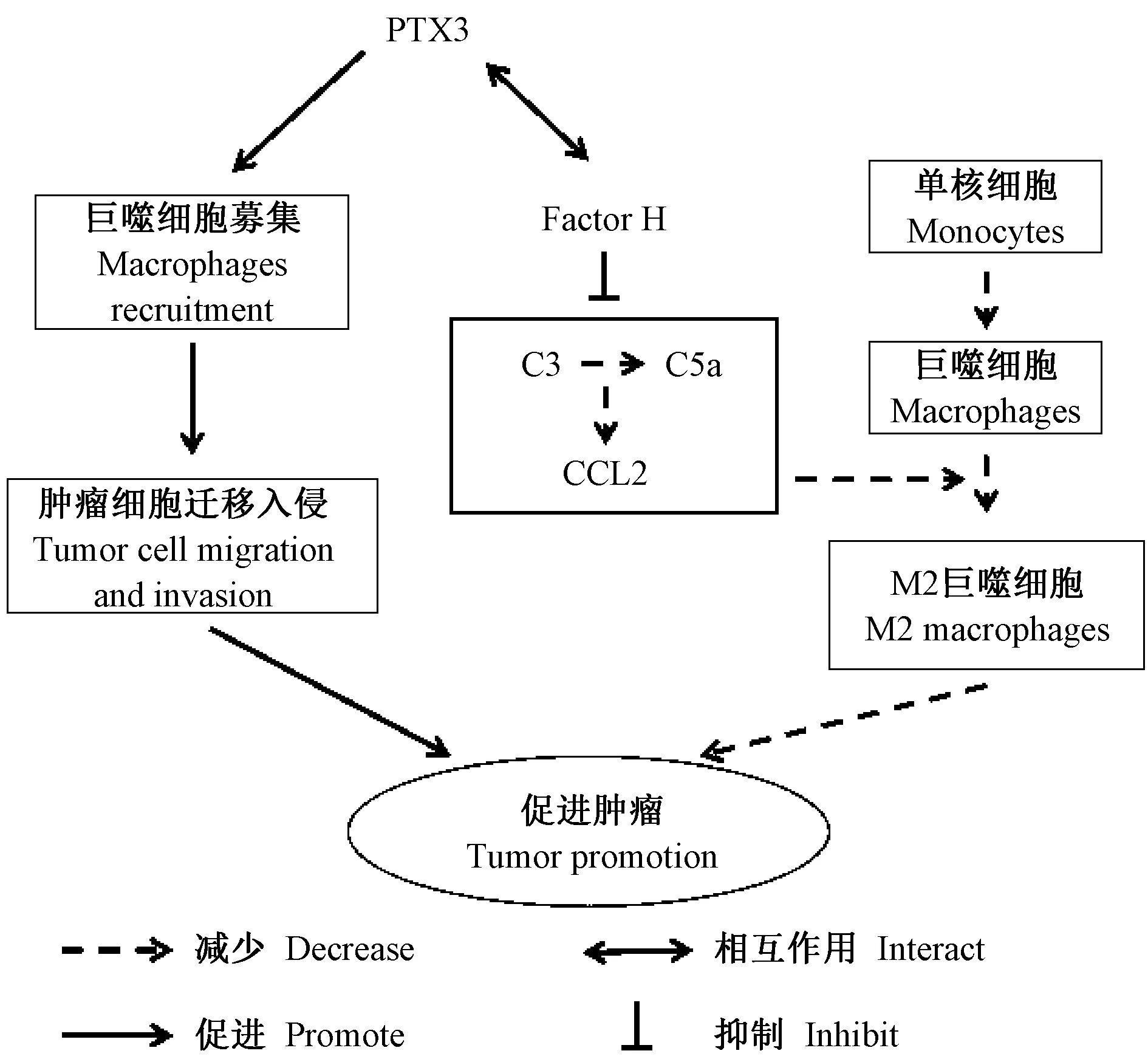
图3 PTX3 在癌症中的作用Figure 3 Role of PTX3 in cancer
5.3 心血管疾病
心血管疾病(Cardiovascular diseases,CVD)是一种严重危险人类健康的疾病,位于全球各种死因的首位;在我国心血管疾病的形势也日趋严重。 研究发现,PTX3 对心血管系统具有明显的调节作用,主要通过影响炎症反应、血管生成、肿瘤发生、细胞粘附等多种生理过程[25]。
经流行病学和临床病例分析,认为PTX3 是动脉粥样硬化的有效生物标志物。 炎症是导致年轻和老年受试者动脉粥样硬化的主要有害因素,而PTX3 在调节炎症反应中发挥着重要作用,其在血浆中的高水平与冠状动脉粥样硬化性的严重程度成正相关[26]。 在动脉血栓形成的小鼠模型中,源自血栓内和血管壁的血管内皮细胞的PTX3,通过其N端结构域靶向结合纤维蛋白原,抑制血小板粘附和聚集,从而阻止血栓形成[27]。 然而,Shindo 等[28]发现PTX3 在动脉粥样硬化血栓形成的发病机制中也具有不良作用。 PTX3 可增加组织因子(tissue factor,TF)在单核细胞和内皮细胞中的表达;而作为凝血级联反应的主要调节因子,TF 水平的升高直接导致血栓的形成。 此外,PTX3 在小鼠脑缺血损伤模型中也发挥保护作用,并参与水肿消退和胶质瘢痕形成[29]。
研究发现在急性心肌梗死(Acute myocardial infarction,AMI)患者发病约7 h 后,血浆PTX3 水平显著升高,3 天后降低至基线水平;因此PTX3 可作为缺血性心肌病的心肌细胞不可逆损伤的早期指标。 此外,考虑到其在血浆中的浓度在心肌梗死发生时发生快速变化,PTX3 被认为是一种新的潜在的心肌梗死标志物[25]。 对于进行药物支架置入术的冠状动脉疾病患者和心绞痛患者,PTX3 也可作为一种预后标志物[30]。
5.4 组织重塑与修复
PTX3 在组织修复与重塑中起着不可替代的作用,分析PTX3 缺陷小鼠不同的组织损伤模型,包括皮肤伤口愈合、无菌肝肺损伤等,发现PTX3 缺陷导致纤维蛋白沉积和持久性增加、凝块变厚,胶原沉积增加。 PTX3 通过与临时基质蛋白即纤维蛋白相互作用,参与组织修复的调控,TLRs 和IL-1 是其有效诱导因子,在组织损伤和修复过程中出现的酸性pH 值可能是PTX3 功能的一个开关信号[31]。Vezzoli 等[32]研究表明,PTX3 在急性无菌损伤的骨骼肌再生过程中发生表达上调,PTX3 可减少炎症反应时间,加快肌肉细胞碎片清除,加快骨骼肌损伤愈合时间。 另有研究者比较PTX3 在骨质疏松症、骨关节炎患者和正常对照年轻受试者成骨细胞中的表达和功能,发现PTX3 在骨内平衡中参与了成骨细胞的增殖、分化[33]。 在急性-慢性肝损伤中,PTX3 受脂多糖诱导表达上调,介导肝星状细胞损伤愈合反应[34]。
此外,PTX3 也参与了血管生成的调控。 血管生成受促血管生成因子和抗血管生成因子之间的平衡以及细胞外基质蛋白相互作用的调控。 成纤维细胞生长因子2(Fibroblast growth factor 2,FGF2)是一种主要的促血管生成因子,PTX3 可抑制FGF2对血管生成的促进作用。 而肿瘤坏死因子刺激因子-6(tumor necrosis factor-stimulated gene-6,TSG-6)通过与FGF2 竞争结合PTX3,可逆转PTX3 对FGF2介导的血管生成的抑制作用[35]。 近期有研究者发现微粒物质中的内毒素诱导诱导调控PTX3 和血管内皮生长因子释放[36]。
6 展望
PTX3 是一种可溶性模式识别分子,通过调节补体活化等生物功能,促进机体对病原体的识别,是抵抗真菌、细菌和病毒感染的重要介质,也是炎症反应的调节因子,并可作为多种疾病的生物标志物。 目前已发现PTX3 在病原体感染、癌症、心血管疾病等多种人类疾病中发挥着重要作用,在生理病理学中具有深远意义,深入研究PTX3 的功能可为多种疾病临床诊断和治疗铺平道路。
