急、慢性高尿酸血症模型的建立
2020-11-09冯学轩刘月姝饶子亮黎耀俊潘晓慧姚嘉琪郭起岳邝少松
冯学轩,刘月姝,饶子亮,黎耀俊,潘晓慧,姚嘉琪,郭起岳,王 诺,邝少松
(广东省医学实验动物中心,广州 528248)
高尿酸血症(hyperuricemia,HUA)是指由于嘌呤代谢异常导致的以高尿酸为特征的代谢性疾病,是引起痛风性关节炎的生化基础,长期持续的高尿酸血症,将大大增加尿酸盐在肾及关节处的沉积,引起痛风及肾脏病变,使得肾病发病率及死亡率升高,抗高尿酸药物的研发亦因此成为热点[1-2]。 临床上治疗高尿酸血症的药物,有用于治疗急性发作的,也有用于治疗慢性疾病的,对于不同药物的研发,需要应用不同类型的疾病模型,合适的动物模型能够为药物的研发夯实基础。 为此,本实验在前期研究基础上,结合大小鼠体内存在尿酸酶代谢系统,可将尿酸代谢成水溶性高的尿素通过尿液排出体外的特点[3-4],采用次黄嘌呤联合尿酸酶抑制剂氧嗪酸钾建立小鼠急性高尿酸血症模型[5-6],采用腺嘌呤联合尿酸排泄抑制药物乙胺丁醇建立大鼠慢性高尿酸血症模型型[7-8],并对模型的指征进行生化及病理学上的检测,同时采用阳性药别嘌醇片考察模型的可治愈性,为用于治疗急性或慢性高尿酸血症药物的研发提供相应的模型工具及基础数据。
1 材料和方法
1.1 实验动物
30 只SPF 级C57BL/6 小鼠、30 只SPF 级SD 大鼠,雄性,由广东省医学实验动物中心提供[SCXK(粤) 2018-0002]。 动物饲养在SPF 级动物房[SYXK (粤) 2018-0002],饲养温度与湿度:20℃~26℃,40%~70%,采用10 h:14 h 昼夜间断照明。动物自由进食和饮水,所有饲料和饮用水均由广东省医学实验动物中心提供。 试验伦理编号:B201607-2。 本试验涉及的与动物试验相关的内容和程序遵从实验动物使用和管理的相关法律法规及广东省医学使用动物中心实验动物伦理委员会的相关规定,保证实验动物的福利。
1.2 主要试剂与仪器
别嘌醇片:批号150403,重庆青阳药业有限公司生产;次黄嘌呤:批号SLBQ1672 V,Sigma 公司生产;腺嘌呤:批号WXBB5072 V,Sigma 公司生产;氧嗪酸钾:批号STBD5759 V,Sigma 公司生产;乙胺丁醇盐酸盐:批号WXBC0611 V,Sigma 公司生产;羧甲基纤维素钠(CMC-Na):批号2015 年1 月19 日,天津市大茂化学试剂厂生产;肌酐试剂盒:批号20160222,尿素氮试剂盒:批号20160312,尿酸试剂盒:批号20160312,均购自上海科华生物工程股份有限公司;XOD 试剂盒:批号160705,南京建成生物工程研究所生产;戊巴比妥钠:批号160606,德国默克生产。 BS-3000 A 电子分析天平,感量:0.1 g,上海友声衡器有限公司生产;BS224S 电子分析天平,感量:0.1 mg,赛多利斯科学仪器(北京)科技有限公司生产;KDC-2046 低速冷冻离心机,科大创新股份有限公司中佳分公司生产;T10 basic 高速分散器,IKA 公司生产;7020 型全自动生化分析仪,日本株式会社日立高新技术公司生产;RM2135 轮转切片机,德国LEICA 公司生产;ASP300S 生物组织全自动脱水机,德国LEICA 公司生产;EG1150 生物组织包埋机及冷冻机,德国LEICA 公司生产;CS-VI 摊片烤片机,湖北孝感医用仪器有限公司生产;AutoStainer-XL 生物组织全自动染色机,德国LEICA公司生产;BX41 型荧光显微镜,日本奥林巴斯公司生产;CellSens Standard 显微图像软件,日本奥林巴斯公司提供。
1.3 实验方法
1.3.1 急性高尿酸血症小鼠模型
30 只C57BL/6 小鼠检疫结束后,按体重随机分为正常对照组、模型对照组、阳性对照组,10 只/组。模型对照组及阳性对照组小鼠腹腔注射50 mg/mL次黄嘌呤溶液同时皮下注射20 mg/mL 氧嗪酸钾溶液,正常对照组同法注射0.5%羧甲基纤维素钠溶液,注射体积为10 mL/kg 体质量。 造模30 min 后阳性对照组按20 mL/kg 体质量灌胃5 mg/mL 别嘌醇药液,正常对照组及模型对照组同法灌胃0.5%CMC-Na 溶液。 造模2 h 后各组动物眼眶静脉窦采血后颈椎脱臼处死,3000 r/min 离心10 min 取血清,用于各指标检测,取肝,生理盐水冰浴匀浆制备10%的组织匀浆液,进行XOD 活性检测。
1.3.2 慢性高尿酸血症大鼠模型
30 只SD 大鼠检疫结束后,按体重随机分为正常对照组、模型对照组、阳性对照组,10 只/组。 除正常对照组外,其余各组动物每天上午按5 mL/kg体质量灌胃30 mg/mL 的腺嘌呤溶液及50 mg/mL的乙胺丁醇盐酸盐溶液造模,两药灌胃相隔约2 h,正常对照组同法灌胃纯净水,1 次/d,连续21 d。 与造模相隔4 h,阳性对照组动物按10 mL/kg 体质量灌胃别嘌呤醇药液,正常对照组及模型对照组同法灌胃0.5% CMC-Na 溶液,1 次/d,连续21 d。 末次给药1.5 h 后,各组大鼠按60 mg/kg 体质量腹腔注射3%戊巴比妥钠溶液麻醉,腹主动脉采血后放血处死,3000 r/min,离心10 min 取血清,用于各指标检测,同时取肝检测XOD 活性,取肾进行组织病理学检测。
1.3.3 指标检测
(1)体重:慢性高尿酸血症大鼠模型每周称量动物体重一次。
(2)急性高尿酸血症小鼠模型:检测血尿酸、血肌酐、血清尿素氮及肝XOD 活性。
(3)慢性高尿酸血症大鼠模型:检测血尿酸、血肌酐、血清尿素氮、肝XOD 活性。 取右肾10%福尔马林固定后HE 染色,按表1 进行肾小管间质损伤半定量评分,按表2 进行肾炎性细胞浸润半定量评分。 肾小管间质损伤定义为炎症细胞浸润,小管萎缩/代偿性扩张、间质纤维化、残余肾单位肥大。 取左肾,无水乙醇固定,Gomori 六胺银法染色进行尿酸盐结晶观察,按表3 进行评分。

表1 肾小管间质损伤半定量评分标准Table 1 Semiquantitative criteria for renal tubular interstitial injury
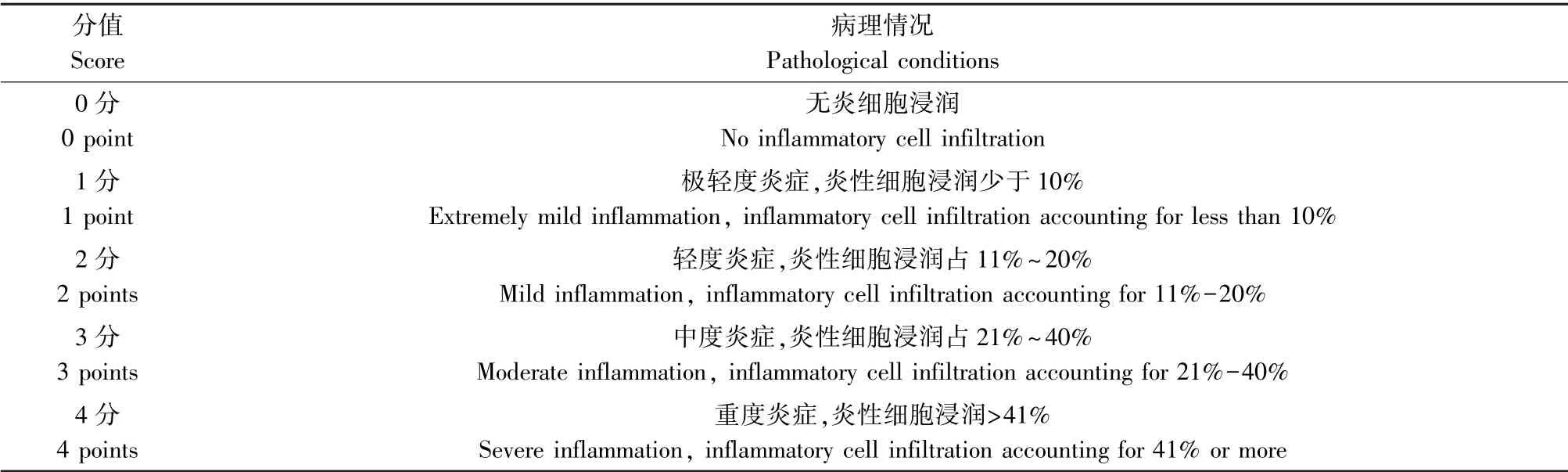
表2 肾脏炎性细胞浸润半定量评分标准Table 2 Semiquantitative criteria for renal inflammatory cell infiltration

表3 尿酸盐结晶评分标准Table 3 Urate crystal scoring criteria
1.4 统计学方法
所有数据采用平均数±标准差( ¯x ±s)表示,应用SPSS 21.0 软件进行统计分析;计量资料数据方差齐,或数据经转换后方差齐,则采用组间两两比较的单因素方差分析方法;若数据经转换后方差仍不齐,采用秩和检验进行统计分析。 检验水准α=0.05。
2 结果
2.1 体重测量结果
慢性高尿酸血症大鼠模型:与正常对照组相比,模型对照组体重在d8 ~d21 下降有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组体重无统计学差异(P>0.05)(见图1)。
为保证测绘档案的信息化管理应用效果和提高综合查询服务能力,系统建立后,要做好档案管理的维护,及时更新,发布最新的归档数据。在整理出数据后,档案管理员要仔细核对数据清单,保证入库档案数据无误后发布。不同单位应根据归档情况和著录情况来确定更新频率,但至少保证每半年更新一次,漳州市测绘设计研究院是基于一张图平台实现了全部测绘档案信息的实时入库管理,入库后的归档信息如图4所示。
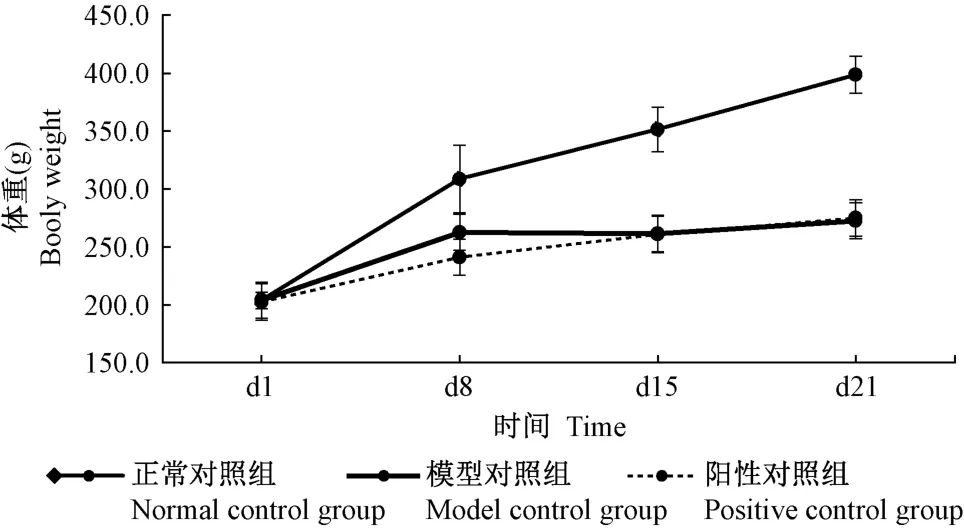
图1 体重测量结果Figure 1 Body weight measurement results
2.2 血尿酸
2.2.1 急性高尿酸血症小鼠模型
与正常对照组相比,模型对照组血尿酸显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组血尿酸显著下降有统计学差异(P<0.05)。 见表4。
2.2.2 慢性高尿酸血症大鼠模型
与正常对照组相比,模型对照组血尿酸显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组血尿酸值显著下降,有统计学差异(P<0.05)。 见表5。
2.3 血肌酐
2.3.1 急性高尿酸血症小鼠模型
与正常对照组相比,模型对照组血肌酐显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组血肌酐值无统计学差异(P>0.05)。 见表4。
2.3.2 慢性高尿酸血症大鼠模型
2.4 血清尿素氮
2.4.1 急性高尿酸血症小鼠模型
与正常对照组相比,模型对照组血清尿素氮无统计学差异(P>0.05)。 与模型对照组相比,阳性对照组血清尿素氮无统计学差异(P>0.05)。 见表4。
2.4.2 慢性高尿酸血症大鼠模型
与正常对照组相比,模型对照组血清尿素氮显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组血清尿素氮无统计学差异(P>0.05)。 见表5。
2.5 肝XOD 活性
2.5.1 急性高尿酸血症小鼠模型
与正常对照组相比,模型对照组肝XOD 活性无统计学差异(P>0.05),与模型对照组相比,阳性对照组肝XOD 活性无统计学差异(P>0.05)。 见表4。
2.5.2 慢性高尿酸血症大鼠模型
与正常对照组相比,模型对照组肝XOD 活性显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组肝XOD 活性显著下降,有统计学差异(P<0.05)。 见表5。

表4 急性高尿酸血症小鼠血尿酸、血肌酐、血清尿素氮及肝XOD 活性检测结果( ¯x ±s,n=10)Table 4 Results of serum uric acid, serum creatinine, serum urea nitrogen, and liver XOD activity in acute hyperuricemia mice
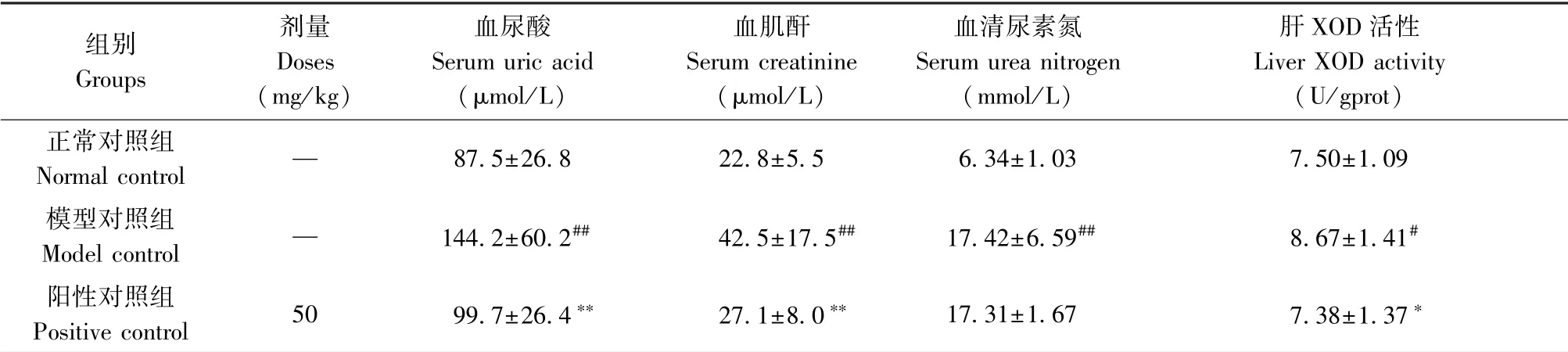
表5 慢性高尿酸血症大鼠血尿酸、血肌酐、血清尿素氮及肝XOD 活性检测结果( ¯x ±s,n=10)Table 5 Results of serum uric acid, serum creatinine, serum urea nitrogen, and liver XOD activity in chronic hyperuricemia mice
2.6 慢性高尿酸血症大鼠组织病理学结果
2.6.1 肾病理检查结果
模型对照组所有动物均见肾损伤,表现为大量肾小管变性、坏死,肾小管尿酸盐沉积,肾小管扩张,部分肾小管见炎性细胞浸润,少量肾小管见细胞管型。 阳性对照组可见肾损伤有一定程度修复,损伤程度较模型对照组轻,表现为部分肾小管变性,肾小管扩张、尿酸盐沉积情况明显改善,仅少量肾小管内见尿酸盐沉积。 见图2、3。
2.6.2 肾炎性细胞浸润结果
与正常对照组相比,模型对照组肾炎性细胞浸润评分显著升高,有统计学差异(P<0.01)。 与模型对照组相比,阳性对照组肾炎性细胞浸润评分显著下降,有统计学差异(P<0.05)。 见表6、图4。
2.6.3 肾小管间质损伤及尿酸盐结晶评分结果
与正常对照组相比,模型对照组肾小管间质损伤及尿酸盐结晶评分均显著升高,有统计学差异(P<0.05)。 与模型对照组相比,阳性对照组二者评分均显著下降,有统计学差异(P<0.05)。 见表6。

表6 慢性高尿酸血症大鼠肾炎性细胞浸润、肾小管间质损伤、尿酸盐结晶评分结果( ¯x ±s,n=10,%)Table 6 Results of renal inflammatory cell infiltration, renal tubular interstitial injury, and urate crystal score in chronic hyperuricemia rats

图2 慢性高尿酸血症对大鼠肾脏病理的影响(HE 染色)Figure 2 Effects of chronic hyperuricemia on renal pathology in rats. HE staining
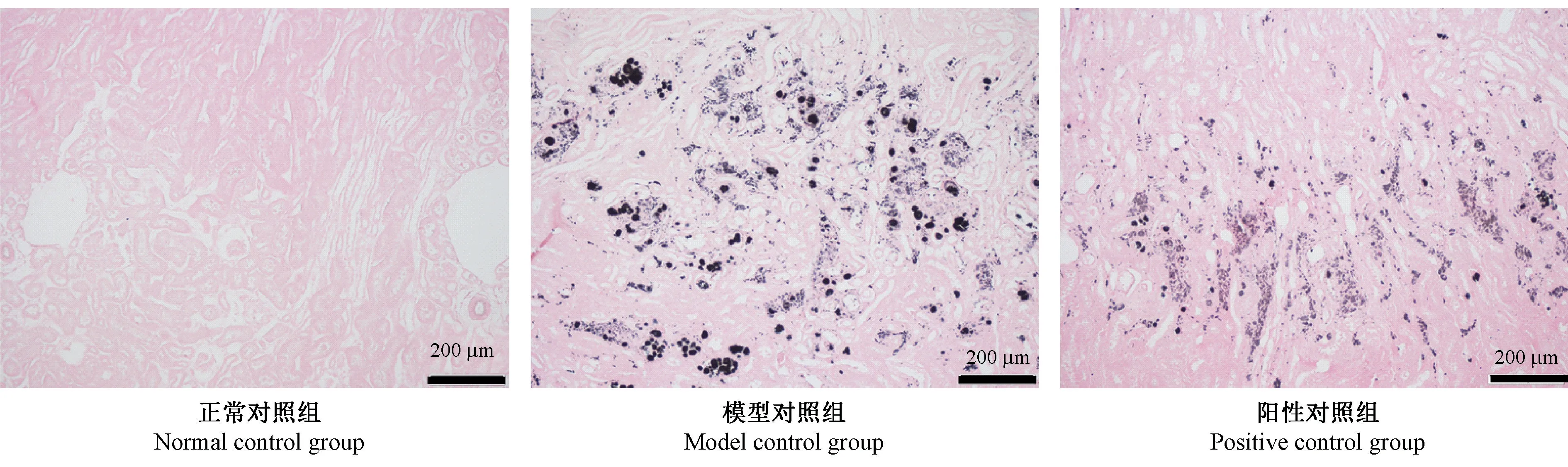
图3 慢性高尿酸血症大鼠肾脏尿酸盐结晶情况(Gomori 六胺银染色)Figure 3 Renal urate crystallization of rats with chronic hyperuricemia. Gomori hexamine silver staining
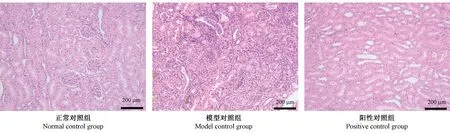
图4 慢性高尿酸血症大鼠肾脏炎性细胞浸润情况(HE 染色)Figure 4 Renal inflammatory cell infiltration of rats with chronic hyperuricemia. HE staining
3 讨论
高尿酸血症(HUA)在我国的发病率日趋升高,沿海发达城市发病率甚至高达25%,因此建立合适的HUA 模型以便开展药物研发成为了研究的热点。在众多的研究中,部分学者会选择单用尿酸前体物质如腺嘌呤、次黄嘌呤或单用尿酸排泄抑制剂如氧嗪酸钾、乙胺丁醇等进行造模[8],如Zhao[5]、Hu[6]等学者采用氧嗪酸钾建立HUA 模型,杨佳梅等[7]学者则单用腺嘌呤或氧嗪酸钾建模。 但氧嗪酸钾和腺嘌呤的造模机理并不一样,单用氧嗪酸钾造模会忽略了人们饮食结构改变,高嘌呤食物摄入增加这一临床诱因;单用腺嘌呤造模则忽略了啮齿类动物与人尿酸代谢的差异性:人不可将尿酸代谢而大小鼠却可通过尿酸酶将尿酸代谢成尿素后排出。因此,本研究综合上述因素,在模拟临床发病诱因的同时结合大小鼠的尿酸代谢特点,采用尿酸前体物质联合尿酸排泄抑制剂建模,此举可降低每种造模剂的剂量,起到提高成模率的同时降低不必要的毒副作用,更好地建立高尿酸血症动物模型[8-11]。
本实验之所以采用次黄嘌呤结合氧嗪酸钾建立急性高尿酸血症模型,原因在于次黄嘌呤只需代谢成黄嘌呤即可形成尿酸,代谢路径较短,可快速形成尿酸[10],而氧嗪酸钾与尿酸的嘌呤环相似,可抑制尿酸酶的活性,快速减少尿酸的分解[12],二者结合能够在较短时间内引起血尿酸升高,起到模拟高尿酸血症急性发作的特点。 人体高尿酸血症的急性发作在于一次性摄入高嘌呤物质,而体内未能及时将其代谢,因此出现血尿酸的急性升高及轻微的肾损伤(表现为血肌酐的升高),而此时的XOD不会有明显的变化,因为XOD 作为一种非专一性酶类,在短时间内其活性不会起显著性变化。 本次的实验结果显示,500 mg/kg 剂量的次黄嘌呤结合200 mg/kg 剂量的氧嗪酸钾构建急性高尿酸血症模型,动物血尿酸在建模2 h 后显著升高,血肌酐也随之升高,肝黄嘌呤氧化酶(XOD)的确无明显变化,这与高尿酸血症急性发作的特点相吻合。 抗急性高尿酸血症药物的药效评价主要侧重于快速降尿酸,本实验建立的急性模型,其血尿酸浓度不会升高太过,且在给予别嘌醇后,血尿酸可以快速地下降,这对于药物的初筛具有良好的适用性,不会轻易淘汰具有开发潜力的药物。 其次,使用小鼠建模,对于开发初期的药物,特别是合成化药,中药单体,能够节省药物用量,一定程度上起到高通量筛选的作用。
对于慢性高尿酸血症,则主要在于尿酸的长期积累,腺嘌呤代谢成尿酸需要较长的代谢路径,而乙胺丁醇对肾脏排泄的抑制作用也非一蹴而就,因此二者结合可用于长时间持续造模,使动物逐渐形成慢性高尿酸血症。 因此,本实验利用150 mg/kg剂量的腺嘌呤联合250 mg/kg 剂量的乙胺丁醇制备了慢性高尿酸血症模型。 此建模方法无论从血生化上还是从组织病理学上进行评价均有较好的成模性。 在临床上,慢性高尿酸血症患者除血尿酸明显升高外,XOD 作为催化嘌呤合成尿酸的关键酶类,其活性也随之升高,邓建平等[13]通过检测20 例高尿酸血症及痛风患者的XOD 活性,发现其XOD活性要比正常人显著升高,此外,由于人体产生的尿酸约有2/3 经肾排出,因此,临床上慢性高尿酸血症还伴随肾功能减退及肾损伤,包括肾炎症的发生[14-16]。 本实验模型大鼠在21 d 建模后,血尿酸高出正常大鼠约65%,XOD 活性高出约16%,血肌酐,血清尿素氮均明显升高,且病理结果与之吻合,出现肾尿酸盐结晶沉积,大量肾小管变性、坏死,炎性细胞浸润。 这些指征表明,本实验模型具有明显的慢性高尿酸血症的特点,且能够较好地贴近于临床表征。 该模型还采用了黄嘌呤氧化酶抑制剂别嘌醇作为阳性药,给药后,模型大鼠血尿酸、XOD 活性均明显下降,肾损伤也得到一定程度恢复,说明本模型具有治愈性,且可探究所研发药物对XOD 的作用程度。
综上所述,本实验提供的建模方法操作简单且实用性强,为相关药物的开发提供了评价工具及基础的建模数据。
