二乙基亚硝胺联合四氯化碳诱发C57BL/6 小鼠肝癌模型
2020-11-09仲鑫汝
仲鑫汝,许 龙,田 睿,苏 静,张 勇
(吉林大学基础医学院病理生理学系,长春 130000)
肝癌是一种以高发生率、高复发率、高死亡率为特征的侵袭性恶性肿瘤。 在全球范围内,每年诊断出超过70 万例肝癌患者,大多数国家死亡率几乎等于发病率[1]。 2015 年全国肿瘤登记中心数据表明,肝癌发病率呈缓慢下降趋势,然而,肝癌复发转移率较高,导致预后较差,肝癌的5 年发病率仅为10.1%,是所有恶性肿瘤中最低的[2-3]。 研究表明,肝癌的主要危险因素包括乙型以及丙型肝炎病毒感染、黄曲霉素摄入、酒精性肝硬化、以及非酒精性脂肪肝等。 肝癌发病隐匿初始症状不明显,初诊时只有不到一半的患者处于早期阶段,这些患者可通过手术治疗(肝切除、肝移植)、TACE、化疗和放疗等手段治疗,其中肝移植是最为有效的治疗策略。然而大部分患者确诊时已经达到肝癌中晚期阶段,由于肝负担过重等原因,其中的70%患者并不适合手术治疗,导致肝癌死亡率居高不下[4-5]。 肝癌的发生是一个多步骤的病理过程,其特征是从慢性肝损伤到肝炎,肝纤维和肝硬化的过程逐渐演变,最终表现为肝癌,然而到目前为止,肝癌的发病机制尚不清楚[6]。 为了探索肝癌的发生机制,寻找有效的治疗方法,建立能够精准模拟人类肝癌发展进程的动物模型就显得十分必要。
肝癌小鼠模型目前主要分为四种(1)自发性、(2)移植性、(3)化学性、(4)转基因性肝癌模型,四种模型中化学诱发性肝癌模型因为操作简单,成瘤率高等原因应用较为广泛,其中又以DEN 联合CCl4最为常用。 60 年代以来,遗传毒性药物DEN 被广泛用于肝癌小鼠模型的建立,DEN 作为DNA 烷化剂,可破坏生物体内的DNA、蛋白质、脂质、并且对肝脏的亲和力较高,可导致肝细胞死亡,这一过程与肝癌的发生发展十分相似[7]。 近年来发现,DEN(肝癌诱发剂)与CCl4(肝癌促进剂)联用,可加快肝癌发展,缩短造模时间,降低小鼠的死亡率,提高造模成功率,为后续研究肝癌发生机制奠定了基础[8]。
1 材料和方法
1.1 实验动物
SPF 级雄性C57BL/6 小鼠110 只,8 周龄,体重为(20±2) g,购于北京维通利华公司实验动物技术有限公司[SCXK (京) 2017-0033];实验于吉林大学基础医学院动物实验中心[SYXK (吉) 2018-0001]IVC 独立送风隔离系统设施中进行;室内温度为20℃~28℃,相对湿度50%~70%,噪音低于60 dB,光照明暗交替12 h/d;小鼠所食用饲料为吉林大学基础医学院动物中心所提供高压饲料,饮用水为灭菌蒸馏水,使用的笼子等用具均高压灭菌处理。 在实验动物饲养和实验过程中遵循3R 原则(替代、减少、和优化),尽量用无知觉材料替代活体动物、试图用最少的实验动物解决实验问题并减少实验动物所承受的痛苦,给予实验动物人道关怀。
1.2 主要试剂与仪器
二乙基亚硝胺(DEN,美国sigma 公司,25 mL/瓶,密度为0.95 g/mL);四氯化碳(CCl4,上海凌峰凌峰化学试剂有限公司,中国);ALT、AST 含量试剂盒(南京建成公司,中国)。 -80℃冰箱(SANYO 公司,日本);天平(METTLER Toledo 公司,瑞士);超速低温离心机(Beckman 公司,美国); 石蜡切片机(Leica 公司,德国)。
1.3 实验方法
1.3.1 模型制作方法
根据文献[9-12]110 只SPF 级雄性C57BL/6 小鼠,预饲养7 d 适应环境后,随机取30 只小鼠作为正常对照组,其余80 只作为对照组。 正常对照组小鼠无处理,模型组小鼠,腹腔注射DEN(100 mg/kg),间隔2 周,再次注射DEN(50 mg/kg);第一次注射DEN 3 天后给予小鼠CCl4和橄榄油混合液灌胃处理(配置体积比为20 ∶80,剂量为5 mL/kg),每周灌胃2 次,持续进行4 周,灌胃时动作轻柔,以防损伤小鼠食道。
观察对照组和模型组小鼠生长状况、精神食欲以及体重等改变情况;按照上述方法造模,分别于给药后第4、8、12、16、20、24、28、32 周取两组小鼠的肝组织与眼周静脉血,对照组每次处死3 只,模型组每次处死6 只。 解剖取小鼠肝左叶,取出的肝组织一部分迅速放入4%多聚甲醛中,组织蛋白质变性凝固,用于组织病理切片,剩余组织放入-80℃和液氮中保存,用于后续实验;从眼眶静脉中取静脉血1.5 mL,静置24 h,低温超速离心机以4500 r/min速度(4℃)离心10 min,吸取上清,用于检测小鼠肝中AST、ALT 含量的变化。
1.3.2 解剖形态观察和病理学组织观察
将肝组织从4%多聚甲醛中取出,经过酒精脱水,二甲苯透明,石蜡包埋等操作后,将组织切成薄片,黏附于玻片上,苏木精-伊红染色后,镜下观察小鼠病理组织学结果。
1.4 统计学方法
实验数据用SPSS 22.0 进行统计分析,所有数据以平均数±标准差(±s)表示。 该实验所用的图由使用GraphPad Prism version 6.02 绘制。
2 结果
2.1 小鼠体重变化
110 只小鼠造模前体重为(20±2)g。 与对照组小鼠比较,给药结束后,模型组小鼠体重明显下降;随后的两个月中,模型组小鼠体重逐渐回升至略低于对照组的水平,随后的5 个月,模型组体重保持稳定,但始终低于对照组(图1)。
2.2 小鼠肝脏形态及病理组织学变化
小鼠解剖后,肉眼观察小鼠肝形态。 对照组小鼠肝质地柔软,颜色鲜红,肝表面光滑,未见任何病变。 模型组小鼠给药8 周时,小鼠肝表面粗糙、色泽暗淡、出现多个大小不一的圆形隆起;第16 周,圆形隆起增多;第24 周,肉眼可见明显的炎性肿块和白色肿瘤组织;第32 周,肝布满白色肿瘤组织,肝组织正常形态基本消失(图2)。
2.3 病理组织学结果
第6 个月时取对照组和模型组的肝左叶组织,进行HE 染色,随后在光镜下观察,发现与正常的肝组织相比,模型组的炎性肿块和白色肿瘤组织部位有明显的癌症组织病理改变(图3)。

图1 对照组和模型组小鼠8 个月体重变化Figure 1 Weight change of the control group and the model group at 8 months
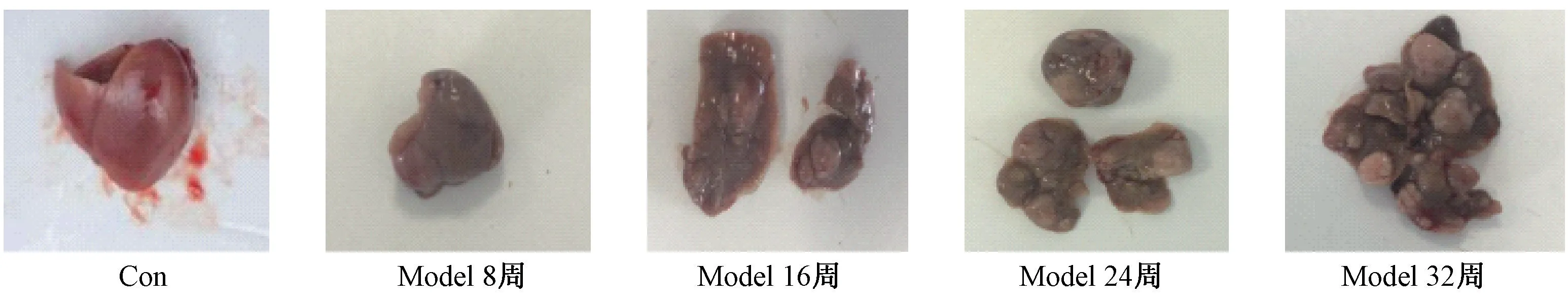
图2 不同时期小鼠肝脏形态Figure 2 Liver morphology of mice at different times
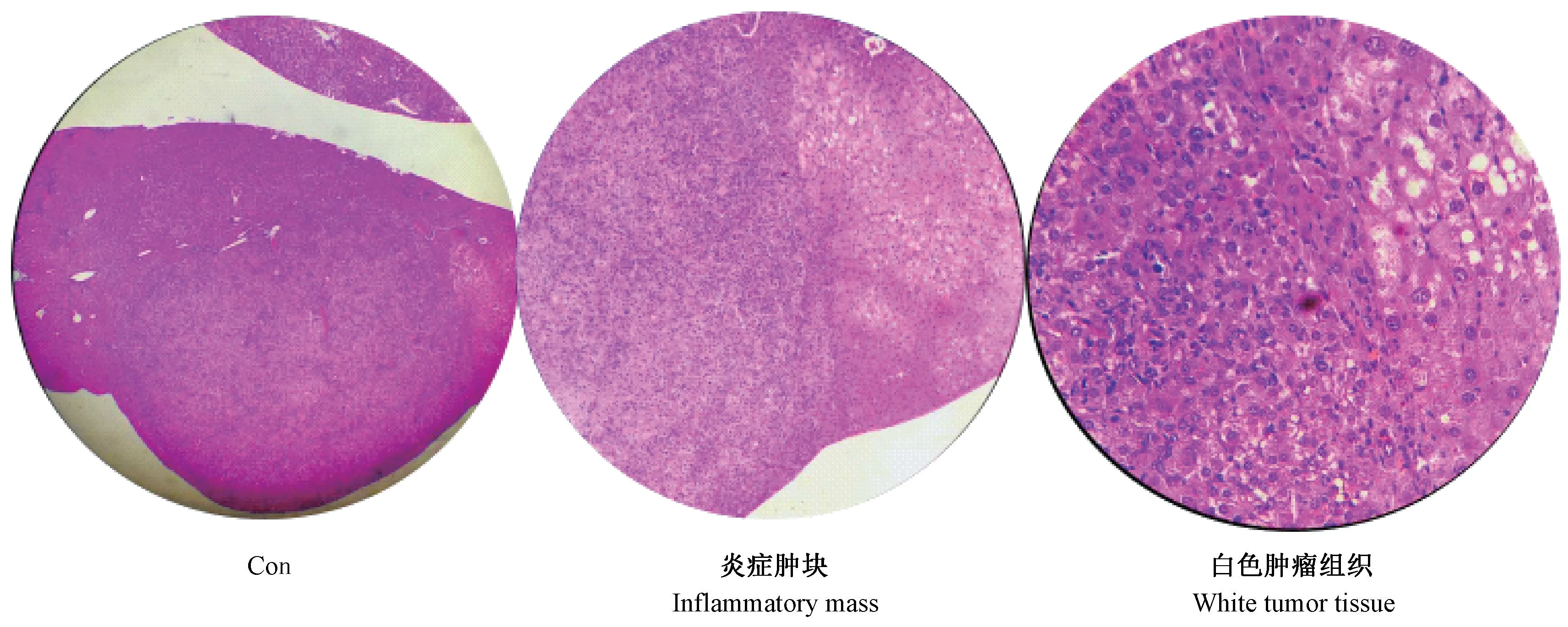
图3 小鼠肝组织的病理学改变(HE 染色)Figure 3 Pathological changes of liver tissue in mice. HE staining
2.4 小鼠肝组织中相关酶的变化情况
模型组小鼠的谷丙转氨酶和谷草转氨酶相比于正常对照组显著升高,说明模型组小鼠肝脏受到严重损伤(图4)。
3 讨论
2013 年,WHO 宣布由于肝癌导致死亡的人群中50%患者来自中国[13-14]。 由于死亡人数巨大,所以实现肝癌的早期防治,寻找有效且精准的治疗迫在眉睫,我们为了观察肝癌的发生发展的过程,探索肝癌的发生机制,建立能够精确模拟人类肝癌发展进程的动物模型就成了必要的手段。
目前应用较为广泛的小鼠模型主要有四种,自发性、化学性、移植性、转基因性肝癌模型[15-16],自发性肝癌模型是小鼠在未经过任何人工处理下自发形成肝癌,可排除人为因素的干扰,但缺点是造模周期长,成瘤率不稳定,难以监测[17]。 转基因性肝癌模型是应用基因工程把外源基因导入到小鼠基因组内,不但可以从组织器官水平研究,还可以深入到细胞和分子水平,但是造模技术要求高,价格昂贵,且作用比较局限,国内目前较少开展[18]。移植性肝癌模型是将其他动物或人的组织或细胞移植到造模小鼠体内,该模型在临床应用较多,主要用于抗癌药物筛选。 化学诱导肝癌模型是通过注射或者经口给药方式予以小鼠化学品,目前有多种诱癌剂,如二乙基亚硝胺(Diethylnitrosamine,DEN)、黄曲霉素B1(AflatoxinB1, AFB1)、二甲基氨基偶氮苯(p-dimethylaminoazobenzene,DAB)、 亚氨基偶氮甲苯(o-aminoazotoluene, OAAT)等,肝癌的的发生是一个多步骤的病理过程,其特征是沿着慢性肝损伤到肝炎,肝纤维和肝硬化的过程逐渐演变,临床病例中70%的肝癌患者与肝硬化有关,肝硬化是肝癌患者中能观察到的最常见的组织病理学特征,然而,绝大多数小鼠模型在诱癌过程中并未出现肝硬化和肝纤维化,这与人类肝癌的发生过程形成鲜明的对比,研究发现化学诱癌剂二乙基亚硝胺联合四氯化碳诱发的肝癌遵循肝炎-纤维化-肝癌过程[19-20],比较基因组学表明,二乙基亚硝胺诱导的肝癌小鼠的基因表达与人类肝癌基因表达最为相似,DEN 诱导的肝癌小鼠模型便于观察肝癌的发生发展过程。
在该实验中,我们将谷丙转氨酶(ALT)和谷草转氨酶(AST)作为评价肝损伤的指标,ALT 和AST存在于各种细胞中,但肝细胞含量最多,当肝细胞损害时, ALT 和AST 大量入血,导致血清中AST 和ALT 水平升高[21]。 从图4 和图5 中我们可以看出,与对照组小鼠相比,从第8 周开始,ALT、AST 水平逐渐升高,说明小鼠肝细胞持续损伤,并且伴随着ALT、AST 水平的升高,肝组织中炎性肿块和白色结节增多,肝组织正常形态逐渐消失,最终发展成肝癌。
本实验中二乙基亚硝胺联合四氯化碳虽然成功诱发C57BL/6 小鼠肝癌,但是这个模型仍然存在一些问题,一是虽然采用各种方法来加速肝癌的发生,但形成肿瘤的周期仍然很长。 二是肝癌发生发展的分子机制仍不明确,尚需进一步探索。

图4 模型组小鼠谷丙转氨酶和谷草转氨酶的变化情况Figure 4 Changes of ALT and AST in mice in the model group
