血管内皮细胞P2X7受体介导脓毒症急性肺损伤中肺血管内皮细胞的炎性损伤
2020-11-09邹子俊王琴李方义周明根李伟超郑煜凯何志捷
邹子俊 王琴 李方义 周明根 李伟超 郑煜凯 何志捷*
在脓毒症发生发展过程中,肺损伤常最早出 现。脓毒症急性肺损伤(ALI)的共同特征是肺上皮-血管内皮细胞损伤、炎症细胞浸润、肺水肿[1]。研究显示,肺血管内皮细胞(VEC)屏障完整性是维持正常肺微循环渗透性的重要基础,而中性粒细胞、巨噬细胞等炎症细胞的参与是脓毒症ALI 中VEC 屏障损伤的重要机制[2]。然而,在粒细胞缺乏患者中,脓毒症同样可以导致ALI 的发生。研究粒细胞缺乏时脓毒症ALI 中导致VEC 损伤的机制,能为这类患者脓毒症ALI 治疗提供理论基础。P2X7 受体(P2X7R)是嘌呤能受体P2X 家族中非常独特的一个亚类,ATP 刺激打开P2X7 离子通道受体,通过多种信号通路,参与炎症反应或细胞凋亡[3]。本研究探讨血管内皮细胞P2X7 在脓毒症ALI 中VEC 炎性损伤的作用,现报告如下。
1 材料和方法
1.1 人脐静脉血管内皮细胞(HUVEC)体外培养和鉴定将HUVEC(ATCC 公司)加入至37℃DMEM 培养基6 ml 中,离心8 min、1500 rpm,弃上清液,加HUVECs 培养液,接种于明胶溶液包被的培养瓶中培养。取P2 代细胞,用0.25%EDTA-胰蛋白酶(GIBCO 公司)消化后,接种于盖玻片,4%多聚甲醛固定,加3% H2O2,37℃孵育15 min,去除过氧化物酶活性,PBS 冲洗后山羊血清封闭15 min。加1∶50 的兔抗人Ⅷ因子抗体为一抗,阴性对照则不加一抗。4℃过夜,PBS 洗涤,加二抗(含生物素),37℃孵育20 min,PBS 冲洗,DAB 染色,镜下观察到胞质呈棕色,为阳性染色,清水冲洗。传代至第三代用于实验研究。
1.2 细胞分组、处理及检测随机分为脓毒症组(HUVECs+1 μg/ml LPS)、对照组(HUVECs+等量NS)、拮抗剂组(HUVECs+等量50 μmol/L A438079(P2X7 阻断剂,Abcam 公司)),处理后分别于6h、12h、24h 时间点收集细胞。(1)RT-PCR 法检测各组P2X7 mRNA 表达:提取总RNA 后,P2X7 引物序列 为:(P2X7 F:CTGGAACGATGTCTTGCAGTAT;P2X7 R:CCCACTTGACGGTGCCATAAT。)扩增片段长度为495 bp。甘油醛三磷酸脱氢酶(GAPDH)为内参照,引物序列为:(GAPDH F:CGTGCC⁃GCCTGGAGAAACCTG; GAPDH R: AGAGT⁃GGGAGTTGCTGTTGAAGTCG;)扩增片段长度为983bp。用凝胶影象分析软件测定每个条带的光密度值,并计算样品P2X7 与GAPDH 条带的光密度比值。(2)采用北京达科为生物技术有限公司提供的ELISA 试剂盒,检测各组TNF-α、IL-1β、IL-6 水平。(3)采用bioss 公司生产的VEGF-1 抗体试剂盒,应用免疫组化法检测各组VEGF-1 蛋白表达。
1.3 统计学处理采用SPSS16.0 统计软件包进行数据处理,以P<0.05 为差异具有统计学意义。
2 结 果
2.1 HUVEC 的观察及鉴定HUVEC 细胞呈紧密融合生长,排列类似“铺路石”。细胞呈多角形,边界清楚,胞浆丰富;可见细胞核仁1-2 个,在镜下呈圆形,核内染色质较稀疏。传代培养时,30 min左右开始贴壁生长,细胞相互连接。免疫细胞化学染色显示,HUVECs 均着色,胞质呈棕黄色强阳性染色,阴性对照无着色(图1)。

图1 HUVECs 免疫细胞化学染色观察(×400,光学显微镜)
2.2 P2X7 mRNA 的表达变化与对照组相比,脓毒症组6 h 表达明显增加,12 h 达高峰(P<0.05)。与脓毒症组相比,拮抗剂组各时点表达均有下降(P<0.05)。(见图2)

图2 实验各组肺组织P2X7 mRNA 的表达水平
2.3 TNF-α、IL-1β、IL-6 水平变化在各时点上TNF-α、IL-6、IL-1β 表达脓毒症组均高于对照组(P<0.05);而拮抗剂组均低于脓毒症组(P<0.05)。脓毒症组和拮抗剂组IL-6 表达逐渐增高,12h 达高峰;TNF-α 及IL-1β 表达在6h 达到高峰,之后逐渐降低,峰值拮抗组均低于脓毒症组(P<0.05)。见图3-5。

图3 实验各组TNF-α 水平
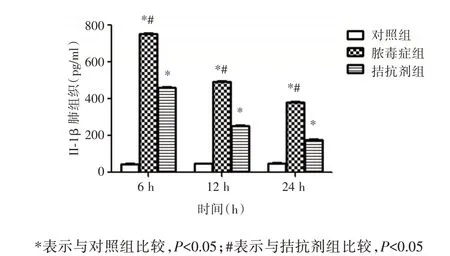
图4 实验各组IL-1β 水平

图5 实验各组IL-6 水平
2.4 VECF-1 水平变化VEGF-1 在HUVEC 细胞膜被染成棕黄色颗粒,正常HUVECs 表达交低,以胞膜为主,胞核无表达;与对照组比较,脓毒症组胞膜的阳性颗粒颜色明显变深,阳性细胞数明显增高。与脓毒症组比较,拮抗剂组胞膜阳性颗粒颜色明显变浅。见图6。
3 讨 论
VEC 在维持肺内环境稳定中起重要作用,肺VEC 损伤不仅是肺水肿产生的重要机制,也是炎症反应发生及放大的重要病理生理基础。在中性粒细胞缺乏患者中,肺VEC 损伤被目前认为是脓毒症ALI 的始动环节[4]。Ozen M 等[5]的研究显示炎症反应中肺VEC P2X7 表达明显增加。本研究发现:在LPS 诱导的急性炎症反应下,VEC P2X7表达明显增加,TNF-α、IL-1β、IL-6 释放增加;阻断P2X7 显示阻断VEC P2X7 可减少肺VEC 炎症因子释放。肺VEC 损伤主要由第一次打击后聚集在肺组织内的炎症细胞在激活状态下产生大量炎症介质所致。然而,在中性粒细胞缺乏患者中,肺VEC 损伤却佷可能是脓毒症ALI 的始动环节[4]。本研究显示,在缺乏粒细胞等炎症细胞参与状态下,LPS 可诱导VEC 产生炎症反应,释放炎症因子,阻断VEC P2X7 明显减少炎症因子释放。即在脓毒症ALI 早期,即使在缺乏炎症细胞介导之前,VEC 也可以以效应细胞致P2X7 表达增多,介导多种炎症因子的释放,同时又是这些炎症因子作用的靶细胞,导致VEC 损伤。由此我们推断肺VEC P2X7 的表达增加可能是中性粒细胞缺乏患者发生ALI 的重要机制之一。另外,本研究还发现,在无炎症细胞参与下,VEC P2X7 与VEGF-1 表达存在一定关系。VEGF 不仅在血管形成中起重要作用,同时也参与血管渗透性的改变[6]。临床上VEGF-1 大量输入人体可直接导致肺VEC 渗透性明显增加,最终导致ALI 的发生,这也被认为是粒细胞缺乏患者发生输血相关ALI 的重要机制[7]。在粒细胞缺乏患者中,炎症细胞包括跨血管内皮迁移能力在内的功能减退,需要肺VEC 通透性进一步增加,才能使这些功能减退的炎症细胞通过跨细胞或细胞旁路途径通过肺VEC 屏障,这也可能是粒细胞缺乏患者发生ALI 的关键机制之一。
因此,在缺乏粒细胞等炎症细胞参与状态下,肺VEC P2X7 通过TNF-α、IL-1β、IL-6 多种炎症因子和血管渗透因子VEGF-1 产生增多,介导肺VEC屏障的损伤,促进ALI 的发生,这可能中性粒细胞缺乏患者发生急性肺损伤的重要机制之一。但本研究只是体外实验水平显示LPS 诱导肺VEC P2X7的过表达可能是在中性粒细胞缺乏患者ALI 中起重要作用,存在一定局限性,确切结论有待进一步体外实验研究证实。
