丁二烯在氧气中的氧化反应特性及产物
2020-11-08赵惠霞刘雄民段鹏志梁敏马丽赖芳
赵惠霞,刘雄民,段鹏志,梁敏,马丽,赖芳
(广西大学 化学化工学院,广西 南宁 530004)
丁二烯是石油工业中的重要原料,普遍应用于橡胶[1-3]、染料[4]、医药[5]和有机合成等行业[6-7]。丁二烯具有共轭双键效应,易氧化生成过氧化物[8-10]。丁二烯氧化途径模型计算[11-14]、氧化反应动力学[15-17]和产物分析[18-19]已有多篇文献报道。但对丁二烯在氧气条件下的稳定性以及氧化后生成的固体产物没有受到关注。
本文研究了丁二烯在氧气氛围中的反应特性及不同条件下过氧化物浓度变化关系;采用顶空-气相色谱-质谱联用(HS-GC-MS)仪检测分析产物类型,同时对氧气条件下的反应途径进行推测。对丁二烯的生产和贮存提供了实验依据,同时对丁二烯的合理利用具有重要的理论意义。
1 实验部分
1.1 材料与仪器
丁二烯(纯度≥99.0%)、氧气、氮气(体积分数≥99.2%)均为工业品;硫代硫酸钠、可溶性淀粉、碘化钾、三氯甲烷均为分析纯。
QP2010(EI)源型气相色谱-质谱联用仪;8860-50型示波器储存记录仪;PHL-A-10MP-A型压力传感器;CC-3083-02型温度传感器;密闭反应釜。
1.2 丁二烯的氧化反应
反应实验示意图见图1。

图1 反应实验示意图Fig.1 Schematic diagram of reaction experiment1.加热装置;2.反应釜;3.压力传感器;4-1、4-2.温度传感器;5.示波记录仪;6.进/出气口
采用不锈钢材质的密闭反应釜作为内衬,将反应所需装置自行组装,并在低于丁二烯沸点温度条件下进行液化,取适量丁二烯样品加入体积约为2 mL的特制玻璃试管中,将其放进反应装置内并充入氧气,在加热装置上进行恒温加压氧化反应。采用温度传感器和压力传感器分别检测反应釜中的温度和压力,并通过记忆示波器记录下温度和压力的实时变化,在实验完成后,将装置拿出进行降温处理至环境温度后取出反应产物。并在相同反应条件下充入氮气反应作为对照试验。
1.3 测定过氧化物含量
丁二烯氧化反应产生的过氧化物浓度采用碘量法[20]进行定量分析。取10 mL三氯甲烷溶液于100 mL锥形瓶中,将反应后的样品完全溶解在该溶液中。加入1%(质量分数)的淀粉-碘化钾溶液,静置30 min,生成的过氧化物被碘化钾还原(1),通过与淀粉结合使溶液呈现蓝色。然后,用硫代硫酸钠标准溶液滴定直至蓝色完全褪去(2)。由消耗的硫代硫酸钠标准溶液的体积计算过氧化物浓度。

(1)

(2)
(3)
式中Z——样品的过氧化物浓度,mmol/kg;
Va——反应后产物耗用Na2S2O3溶液的体积,mL;
Vb——空白样消耗Na2S2O3溶液的体积,mL;
c——Na2S2O3溶液的浓度,mol/L;
m——原样品质量,g。
1.4 反应产物分析
丁二烯氧气条件下反应产物的定性定量分析采用阶梯升温顶空-气相色谱-质谱联用技术[21]。
1.4.1 顶空条件 进样温度40,80,120 ℃;进样环温度50,90,130 ℃;真空管温度50,90,130 ℃;GC 循环时间10 min;瓶子平衡时间10 min;加压时间0.2 min。采用升温程序:(1)40 ℃顶空进样50 ℃保持1 min,先升至52 ℃(0.5 ℃/min),再升至60 ℃(4 ℃/min),最终升至90 ℃(15 ℃/min);(2)80 ℃顶空进样90 ℃保持1 min,先升至95 ℃(1 ℃/min),再升至100 ℃(5 ℃/min),最终升至120 ℃(20 ℃/min);(3)120 ℃顶空进样130 ℃保持1 min,先升至134 ℃(1 ℃/min),再升至150 ℃(8 ℃/min),最终升至240 ℃(30 ℃/min)。
1.4.2 气相色谱-质谱条件 RTX-5型弹性石英毛细管色谱柱,规格为30.0 m×0.25 μm×0.25 mm。载气为高纯氦气,柱流量为1 mL/min;分流比30.0∶1,进样口温度423.15 K,接口温度543.15 K。EI离子源,电子能量0.8 kV。扫描质量范围m/z=18~300,采用全扫描模式。
2 结果与讨论
2.1 丁二烯在氧气条件下的压力行为
丁二烯沸点为-4.4 ℃,常温下为气态,丁二烯的氧化反应和聚合反应如式(3)、(4)。在反应装置中,当温度T达到设定值时,丁二烯如果发生化学反应可以通过检测压力的变化来显示出来。由于丁二烯与氧气均为气体,当两者发生反应时,反应消耗丁二烯和氧气,造成反应釜内压力下降;当丁二烯本身聚合时,多个丁二烯分子聚合形成聚合物,压力同样会产生下降。由此原理,可以根据反应系统中压力的改变来测定丁二烯氧化反应的特点及行为。

(4)

(5)
为了确定丁二烯是否会与氧气进行反应,首先以氮气(N2,105,90 ℃)作为对比实验,压力-时间的变化关系如图2中曲线A和B。为了解温度对丁二烯反应特性的影响,考察丁二烯在氧气条件下的反应过程,进行了恒温实验。当n(O2)∶n(C4H6) =1.0∶1.0时,在反应釜温度分别达到恒定温度50,70,80,90,100 ℃下进行反应,反应时间为8 h。反应进行中压力-时间的变化如图2中曲线E、D、C、F、G所示。反应完成后,根据反应后与反应前的压力变化值计算其反应量。各个温度下的反应量见表1。

表1 不同温度下的反应量Table 1 The amount of reaction at different temperatures
由图2可知,在氮气氛围下,达到恒温(90,105 ℃)后,反应釜内压力不发生改变,说明在氮气气氛下,丁二烯的化学性质在较高温度下依旧能够保持稳定,且不发生反应。在氧气气氛中,50 ℃条件时,氧化初期约为 1 h,之后压力呈缓慢的下降趋势,说明丁二烯在50 ℃下与氧气发生缓慢氧化反应;70,80 ℃时,氧化初期约为 0.6 h,随后压力呈线性开始下降;90,100 ℃时,氧化初期约为 0.25 h,而后压力迅速下降。温度升高,氧化初始阶段变短。

图2 不同温度下时间-压力的关系Fig.2 Time-pressure relationship at different temperaturesA.N2,105 ℃;B.N2,90 ℃;E.O2,50 ℃; D.O2,70 ℃;C.O2,80 ℃;F.O2,90 ℃;G.O2,100 ℃
由表1可知,温度升高时,反应量增加。这是由于温度升高,导致活化分子增多,丁二烯与氧气发生快速反应。温度升高,氧化前期变短,消耗氧气越多。丁二烯与氧气反应剧烈,生成的过氧化物增多,且随着温度的升高,过氧键中的离解能较低易发生断裂分解,产生活性较高的基团[22],引发丁二烯进一步发生聚合反应。
综上所述,在氮气氛围下,温度升高到105 ℃时,丁二烯不发生反应,化学性质仍然非常稳定;在氧气氛围下,初始氧化时间受温度影响。温度上升时,氧化反应程度增大,氧化反应更易发生。
2.2 丁二烯过氧化物浓度变化规律
2.2.1 反应温度对过氧化物浓度的影响 取一定量丁二烯于釜中,充入适量氧气,在不同温度条件下反应 26 h,利用碘量法测定产物中过氧化物的生成量,过氧化物浓度随温度的变化趋势见图3。

图3 反应温度对丁二烯过氧化物浓度的影响Fig.3 Effect of reaction temperature on butadiene peroxide concentration
由图3可知,反应温度在45~75 ℃时,丁二烯会与氧气进行氧化反应,有过氧化物生成,且过氧化物浓度先增加后降低。推测可能是过氧化物中产生的过氧键离解能相对较低,高温下会发生断裂进行分解。马继涛等[23]结合定量构效关系(QSPR)原理,分析了有机过氧化物的自加速分解温度(SADT)以及对分子结构间的内在联系。徐慧悦等[24]采用 DSC和ARC考察了不同稳定剂对过氧化二异丙苯(DCP)热稳定性的影响,其分解温度为87 ℃左右。张金锋等[25]利用RSD和DSC技术进行了过氧化苯甲酸叔丁酯的热危险性实验研究,分析了TBPB分解的初始温度与升温速率有关,并呈现正相关趋势,并计算出热分解温度为95 ℃左右。因此在45~65 ℃温度区间时,丁二烯过氧化物相对较稳定,过氧化物热分解量小于其生成量,因此过氧化物浓度表现为不断上升趋势。当温度>65 ℃时,过氧化物分解速率逐渐增大,高于其生成速率,过氧化物的浓度随温度增长呈现降低趋势。因此,65 ℃为高压下丁二烯过氧化物产生的较易温度。
2.2.2 反应时间对过氧化物浓度的影响 在温度为65 ℃时,充入氧气进行高压反应,反应时间与产物过氧化物浓度的影响趋势见图4 。

图4 反应时间与丁二烯过氧化物浓度关系图Fig.4 Relationship between reaction time and butadiene peroxide concentration
由图4可知,随着反应时间的增加,过氧化物浓度呈现先增大后减小趋势,反应时间为 26 h时,过氧化物浓度达到最大值,反应时间>26 h后,过氧化物的浓度在不断降低,说明过氧化物在反应过程中不断发生分解。由此可知,反应时间26 h时为高压下过氧化物浓度的最大值,此时较易生成丁二烯过氧化物。
综上所述,高压下,反应温度65 ℃,反应时间 26 h时,丁二烯过氧化物较易产生,过氧化物浓度为9.1 mmol/kg。
2.3 反应产物分析
为了解丁二烯与氧气反应的产物,推测丁二烯在氧气条件下的反应途径,采用 HS-GC-MS 对丁二烯与氧气反应后固体产物进行定性定量分析。n(C4H6)∶n(O2)=1∶1,70,80,90,100 ℃四个温度下恒温反应8 h,表2~表4分别表示了顶空进样温度40,80,120 ℃的产物分析,表5为4个反应温度下的产物汇总。
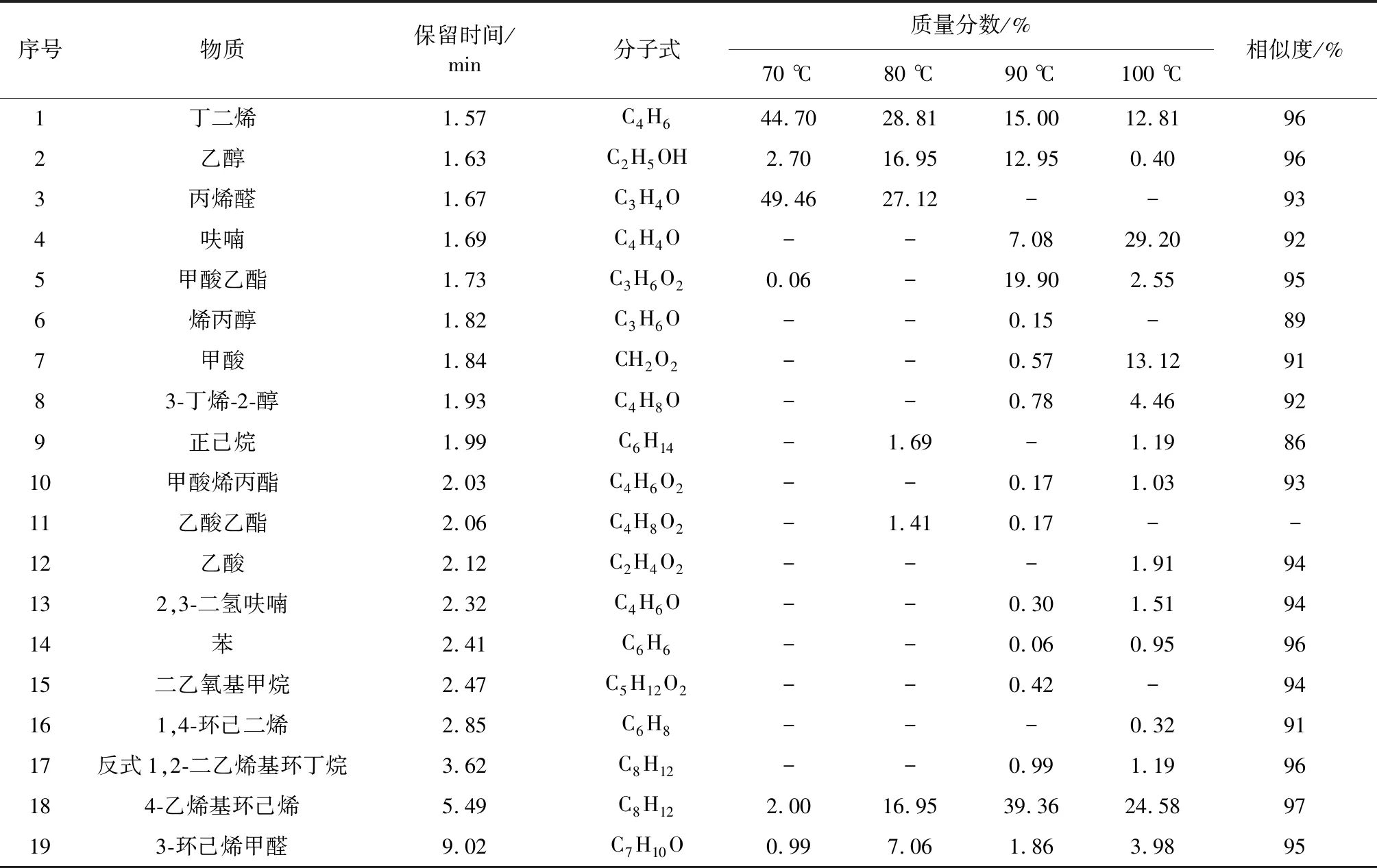
表2 顶空进样温度40 ℃Table 2 Headspace injection temperature 40 ℃
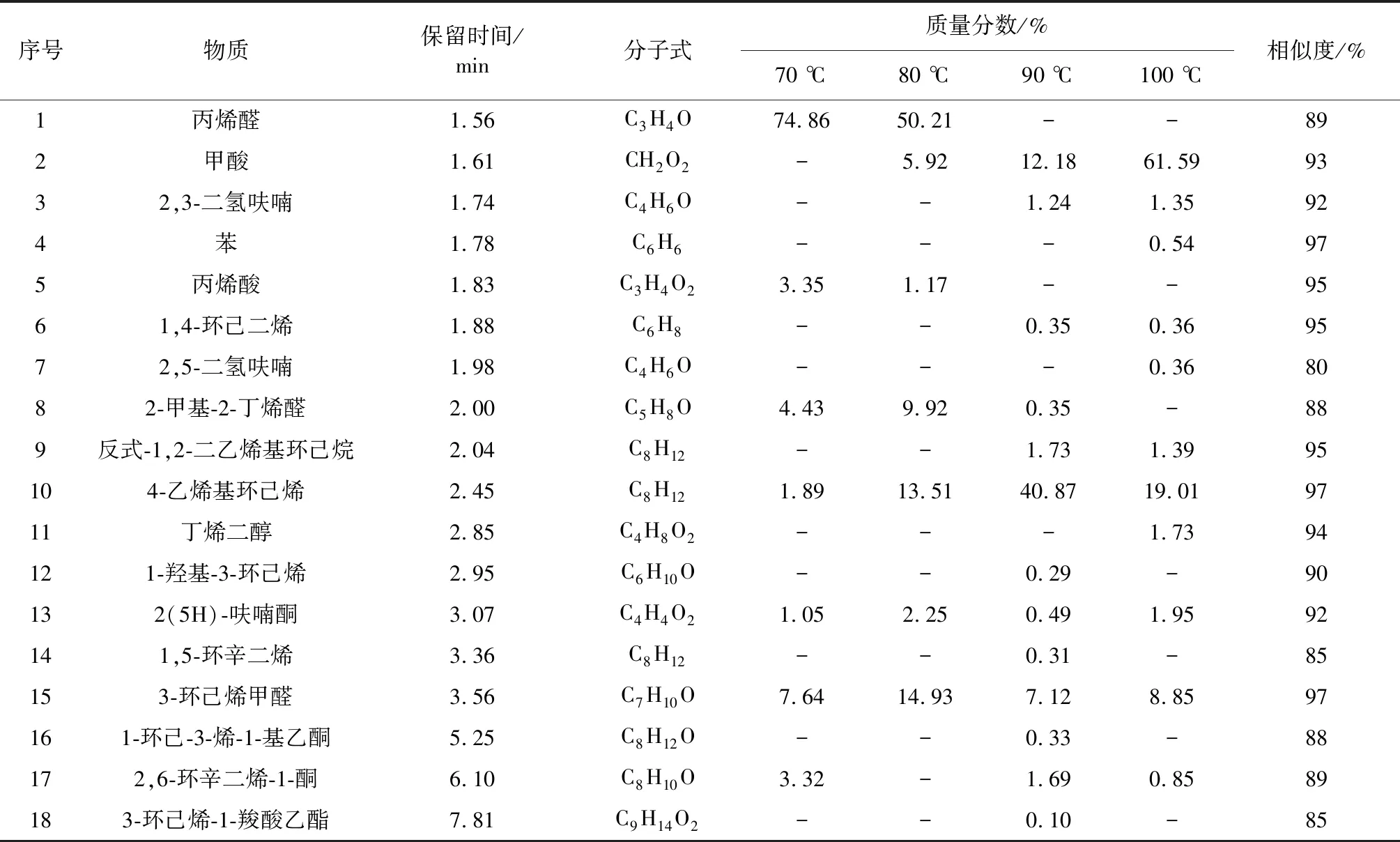
表3 顶空进样温度80 ℃Table 3 Headspace injection temperature 80 ℃
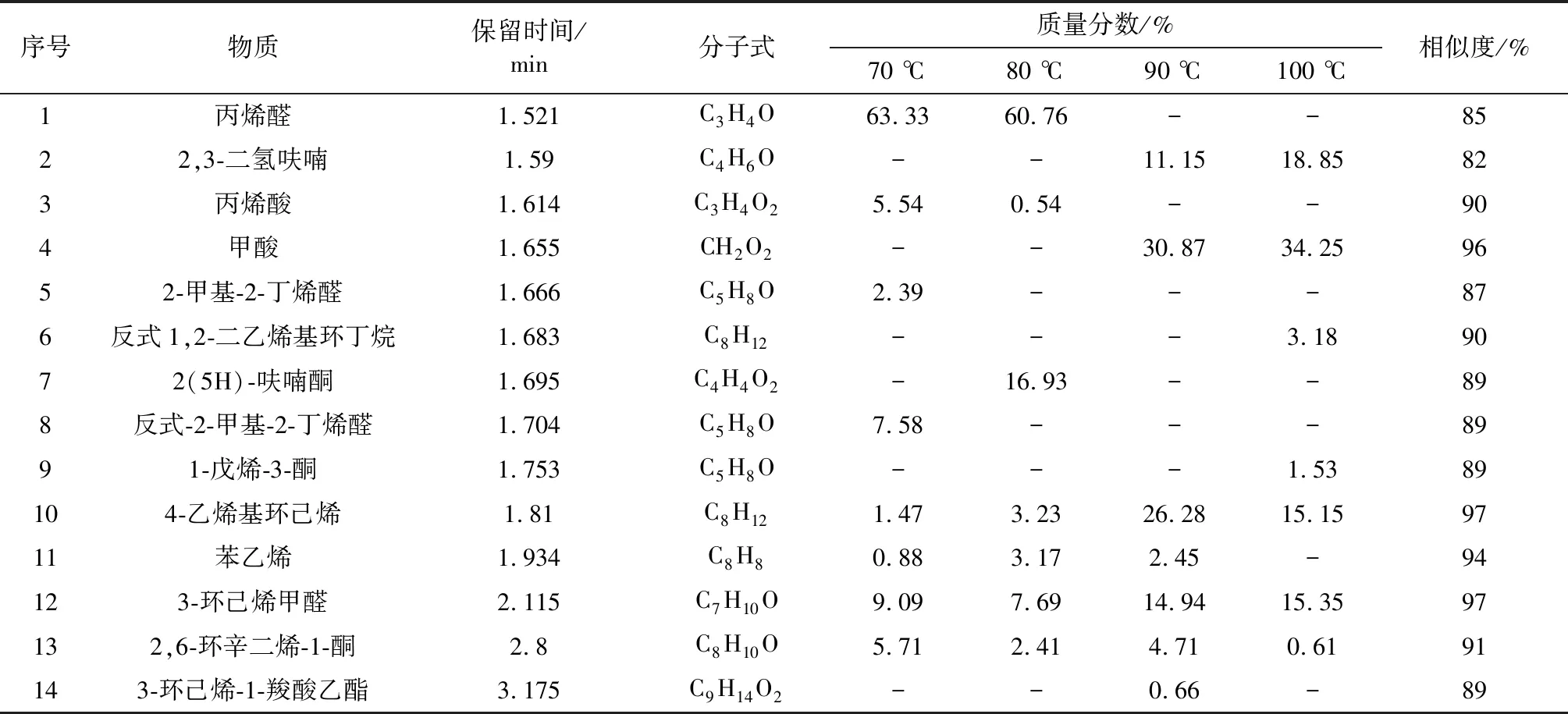
表4 顶空进样温度120 ℃Table 4 Headspace injection temperature 120 ℃
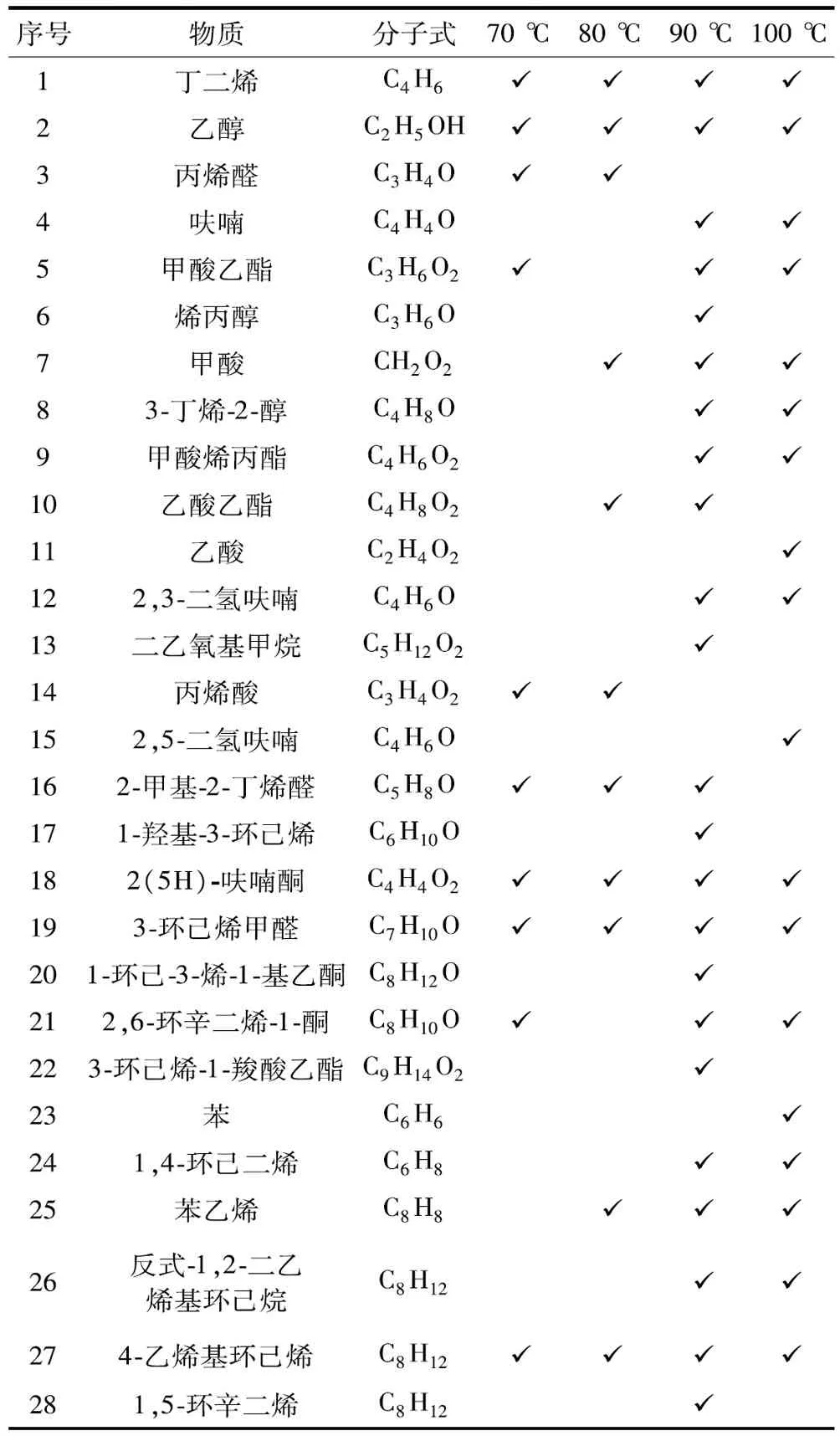
表5 不同温度下产物分析汇总Table 5 Analysis and summary of products at different temperatures
根据 HS-GC-MS 的测定结果,通过参考文献以及相似度来进行检索并对其进行结构推测。丁二烯在氮气条件下化学性质稳定不发生反应。丁二烯在氧气条件下生成多种中间产物,随着温度的升高,反应产物的种类变多,反应更复杂。由表2~表4可知,丁二烯在氧气条件下反应生成中间产物主要分为两大类:一类为与氧气反应生成的氧化产物;一类为聚合生成的聚合产物。丁二烯氧化产物主要为丙烯醛、呋喃、2,5-二氢呋喃和2,3-二氢呋喃。在4个温度下,丁二烯生成的过氧化物分解产生自由基,促进丁二烯自身之间的聚合,形成二聚体以及引发丁二烯C—C键断裂形成碳链更小的化合物,发生聚合反应。
综上所述,丁二烯在氮气条件下化学性质稳定,不发生反应。在氧气条件下,丁二烯会发生氧化反应和聚合反应,丁二烯发生氧化反应生成丙烯醛、呋喃、2,5-二氢呋喃,2,3-二氢呋喃等氧化产物,氧化过程中生成的过氧化物会分解生成自由基将导致丁二烯发生聚合反应,生成反式1,2-二乙烯基环丁烷、4-乙烯基环己烯、1,5-环辛二烯等聚合产物。
2.4 丁二烯在氧气条件下的反应途径
根据丁二烯在氧气条件下的反应特性和反应产物,推测丁二烯反应途径见图5。
由图5可知,丁二烯先与氧气反应形成过氧化物,过氧化物受热分解产生自由基。自由基与丁二烯反应生成丙烯醛、呋喃[11,26-27];自由基会激发丁二烯产生自身聚合反应,生成4-乙烯基环己烯、反式-1,2-二乙烯基环丁烷和1,5-环辛二烯3种二聚体[13,28-29];分解过氧化产生的自由基会引发丁二烯碳碳键断裂[11,26],断裂的碳碳键会生成加成产物苯、1,4-环己二烯和氧化产物甲酸、乙酸。

图5 丁二烯在氧气条件下的反应途径Fig.5 Reaction routes of butadiene under oxygen condition
3 结论
(1)在氮气条件下,即使在105 ℃下,丁二烯不发生反应,化学性质仍然非常稳定;在氧气氛围下,初始氧化时间受温度影响。随着温度上升,氧化初始阶段较短,反应量增加;温度的上升,压力明显下降,氧化反应程度增大,氧化反应更易发生。
(2)反应温度和反应时间对丁二烯氧化过程中生成过氧化物浓度的影响趋势均为先升高后降低,高压下反应温度65 ℃,反应时间26 h时,丁二烯过氧化物较易产生,过氧化物浓度为 9.1 mmol/kg。
(3)丁二烯在氧气条件下反应产物与温度有关,且产物比较复杂,主要有丙烯醛、呋喃、2,5-二氢呋喃、2,3-二氢呋喃、反式1,2-二乙烯基环丁烷、4-乙烯基环己烯、1,5-环辛二烯等。
