Fenton/US降解吡啶的动力学及影响因素研究
2020-11-08杨银李雪原刘路明童祯恭江立文
杨银,李雪原,刘路明,童祯恭,江立文
(华东交通大学 土木建筑学院,江西 南昌 330013)
吡啶是一类六元含氮杂环芳香烃化合物,广泛应用于工业中。它常来自于焦化、印染、制药废水,这些废水具有污染物浓度高、毒性大和可生化性差等特点,给水体环境和人体健康造成严重威胁[1]。同时,由于该类化合物具有种类众多、结构稳定和难降解等特性,传统的活性污泥法对其处理效果往往不佳[2-3]。Fenton法能将此类物质快速矿化,提高废水的可生化性;而如何降低Fenton试剂的用量是当前研究的热点。超声(US)技术可提供更短的反应周期,减少试剂投量,逐渐被应用于处理难降解化合物中[3-5]。
本文采用Fenton/US法降解含吡啶的模拟废水,研究吡啶溶液降解的反应动力学规律,考察溶液初始pH值、超声功率、H2O2浓度、FeSO4·7H2O 浓度和溶液初始浓度对其降解效果的影响,同时还对比了Fenton/US协同法与两种组合工艺(即先US后Fenton,先Fenton后US)降解吡啶溶液的效果,这将为含吡啶的实际废水处理提供技术和理论支撑。
1 实验部分
1.1 试剂与仪器
C5H5N,GC级;NaOH、HCl、30%H2O2、FeSO4·7H2O均为分析纯。
78-1型磁力搅拌器;PHS-25型pH计;AL204型电子分析天平;DZF6020型电热恒温鼓风干燥箱;DS-3510型超声波清洗仪;FS-600型超声波发生器;GC9790气相色谱仪。
1.2 吡啶溶液的配制
量取一定量的吡啶于50 mL烧杯中,用蒸馏水溶解,并定容于1 000 mL的容量瓶中,配制浓度为1 000 mg/L的储备液。分别量取一定量储备液于500 mL容量瓶中,用蒸馏水稀释至标线,配制成100,150,250,300,350 mg/L的吡啶溶液。
1.3 实验方法
在500 mL烧杯中加入300 mL浓度350 mg/L的吡啶溶液,溶液初始pH值7.0,加入0.617 g/L FeSO4·7H2O和40 mmol/L H2O2,室温(25±3)℃下进行Fenton/US联合反应2 h。每间隔30 min取10 mL反应液,用1 mol/L NaOH或1 mol/L HCl溶液调节其pH至8.0,作为待测样品。
1.4 分析方法
吡啶溶液浓度采用GC9790气相色谱仪进行顶空-气相色谱法测定。
色谱柱: HP-INNOWax型(30 m×0.32 mm×0.50 μm)毛细管柱。
检测条件:以55 ℃作为进样口的温度;采用恒流模式,将柱流速控制在3.5 mL/min;以5∶1的分流比,进行分流进样,将流速控制在1 mL/min;FID检测器温度为280 ℃;在50 ℃的初始温度下维持1 min后,分别以10,20 ℃/min的速度升至120 ℃和150 ℃,并且在相应温度下保持1,2 min;氢气和空气流量分别为35,400 mL/min;以500 μL作为进样量。
2 结果与讨论
2.1 溶液初始pH值对降解吡啶的影响
在吡啶溶液初始浓度、H2O2浓度、FeSO4·7H2O 浓度和超声功率分别为350 mg/L、40 mmol/L、0.617 g/L和400 W的条件下,反应120 min。溶液初始pH值对吡啶降解效果的影响,见图1。
用一级反应动力学[6]对图1的吡啶溶液降解过程进行拟合,结果见表1。
V=dC/dt=-K×C
(1)
式中V——反应速率,mol/(L·min);
K——吡啶溶液的降解速率常数,min-1;
C——溶液中的浓度,mg/L。
对式(1)积分可得:
ln(Ct/C0)=-K·t
(2)
式中Ct——t时刻溶液中的浓度,mg/L;
C0——溶液的初始浓度,mg/L;
t——反应时间,min。

图1 溶液初始pH值对吡啶降解效果的影响Fig.1 Effect of initial pH of solutionon pyridine degradation
由表1可知,线性相关系数R介于0.977 0~0.995 7之间,说明一级反应动力学符合吡啶溶液的降解过程。速率常数K值随溶液初始pH值的变化趋势见图2。

表1 吡啶溶液的降解动力学方程Table 1 Kinetic equation of degradation of pyridine solution
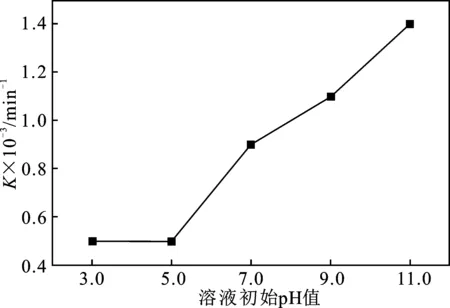
图2 溶液初始pH值对K值的影响Fig.2 Effect of initial pH of solution on K
由图2可知,K值随着溶液初始pH的上升,逐渐增大,溶液初始pH值11.0时有最大K值,为1.4×10-3min-1。由此可见,在碱性环境中,Fenton/US降解吡啶溶液的速率比酸性环境中的降解速率快。这可能是由于一方面,在酸性环境中,Fe3+主要以Fe(OH)2+的形式存在,超声可加速Fe(OH)2+分解成Fe3+离子和HO2·,提高Fenton链式反应的效率[7],pH值过低时,溶液中的H+会捕获大量的·OH,且体系中Fe2+易水合形成[Fe(H2O)]2+,降低了液相中Fe2+的浓度,导致了吡啶溶液的降解速率常数K值无明显变化[8-9];另一方面,由于吡啶溶液具有一定的碱性和极性,其在中性或碱性环境中,主要以分子的形态存在,而其在酸性环境中下,则主要以稳定盐的形态存在[10]。基于超声理论,在溶液中以分子形态存在的吡啶由气-液交界面进入空化泡内部,不仅产生自由基氧化反应,还会发生热解和超临界水(SCW)氧化反应,从而增大了降解速率常数K值;而在溶液中以稳定盐形态存在的吡啶,增加了吡啶的水溶性,使得位于气液界面和进入空化气泡内部溶液中的吡啶含量减少,弱化了超声空化效应[10],从而降低了降解速率常数K值。
2.2 超声功率对降解吡啶的影响
实验条件同1.3节。超声功率对吡啶溶液降解速率常数K值的影响,见图3。

图3 超声功率对K值的影响Fig.3 Effect of ultrasonic power on K
由图3可知,K值随着超声功率的增大而增加,400 W时至临界值(K=1.4×10-3min-1)后迅速下降。任百祥等[11]的研究也证实了这种趋势。保持适当的超声功率可强化超声空化效应,使得气泡溃灭时向水中释放的·OH数量增多[12],提高H2O2被催化分解成·OH的反应速率,从而增大了吡啶溶液的降解速率常数K值;但当超声功率过高时,一方面,空化气泡数量过多,离散了超声能量,气泡难以溃灭;另一方面,过大的空化泡,易造成声屏蔽,使得超声能量得不到充分利用,从而使吡啶溶液的降解速率常数K值下降[13-14]。此外,太高的超声功率还会使得系统过热,产生热损耗,进而浪费超声能量,从而减缓吡啶溶液的降解速率[15]。
2.3 H2O2浓度对降解吡啶的影响
实验条件同1.3节,H2O2浓度对吡啶溶液降解速率常数K值的影响,见图4。

图4 H2O2浓度对K值的影响Fig.4 Effect of H2O2 concentration on K
由图4可知,K值随着H2O2浓度的增加先上升后下降。临界值(K=1.4×10-3min-1)出现在H2O2浓度为40 mmol/L时。该实验结果与蔡岚的研究结果相似[15]。因为在超声波及Fe2+的促进作用下,适量的H2O2能够热解生产·OH,使得位于气液交界面和空化泡内的·OH含量增加,提高吡啶溶液的降解反应速率K值;但当H2O2浓度过高时,溶液中产生的·OH会被过量的H2O2俘获[式(3)],生成HO2·,但由于HO2·的氧化还原电位(1.70 V)远低于·OH(2.80 V),使得·OH被HO2·消耗[式(4)],降低了·OH的有效浓度,影响Fenton试剂的氧化效率,从而降低了吡啶溶液的降解速率常数K值[16-17]。

(3)

(4)
2.4 FeSO4·7H2O浓度对降解吡啶的影响
实验条件同1.3节,FeSO4·7H2O浓度对吡啶溶液降解速率常数K值的影响见图5。

图5 FeSO4·7H2O浓度对K值的影响Fig.5 Effect of FeSO4·7H2O concentration on K
由图5可知,K值随着FeSO4·7H2O浓度先上升而后逐渐下降,当FeSO4·7H2O浓度为0.397 g/L 时,K值达最大值为2.9×10-3min-1。这一方面是由于较多的H2O2溶解于水中,降低了其进入空化泡内的浓度[5],因此超声作用对H2O2的分解效率不高;另一方面,Fenton/US体系中主要依靠适量的Fe2+催化分解H2O2产生·OH 和HO2·[15],有利于提升降解速率常数K值,但当Fe2+过量时,催化反应能力增强了,瞬间产生的·OH未来得及与溶液中的吡啶分子反应就湮灭了,同时Fe2+也会被·OH氧化成Fe3+,抑制了·OH在体系中的含量,降低了降解的效果[14]。
2.5 溶液初始浓度对降解吡啶的影响
FeSO4·7H2O浓度为0.397 g/L,其余实验条件同1.3节,溶液初始浓度对降解速率常数K值的影响见图6。

图6 溶液初始浓度对K值的影响Fig.6 Effect of initial concentration of solution on K
由图6可知,在反应过程中,随溶液初始浓度增加,K值快速下降,最终逐步走向平稳。该变化趋势也在张良波等的研究中得到了证实[10]。原因在于在溶液初始浓度升高的同时,由挥发的吡啶蒸气更多地进入到空化泡内部,降低了空化泡的温度,使得降解速率常数K值减小[10]。同时,溶液的初始浓度还会影响溶液的黏度,溶液黏度又会对空化阈和吸收声能产生影响,最终造成吡啶浓度越高,其空化反应越困难[18],从而使降解速率常数K值下降。
2.6 两种组合工艺与协同法降解吡啶效果的对比
实验条件:①Fenton法:吡啶的初始浓度为350 mg/L,初始pH值为3,H2O2浓度为40 mmol/L,FeSO4·7H2O浓度为0.617 g/L;②US法:初始pH值为11,超声功率为400 W;③组合工艺:指反应时间控制在30 min/90 min,60 min/90 min,90 min/90 min条件下,进行先US后Fenton和先Fenton后US试验。两种组合工艺与(初始浓度为350 mg/L)协同条件下的去除率对比情况见图7。

图7 两种组合工艺与协同法处理吡啶的去除率对比Fig.7 Comparison of the removal rate of pyridine with two kinds of combination process and co-processing
由图7可知,同一时间点下,两种组合工艺对吡啶的去除效果均优于协同法,3种方法对吡啶的降解效果按大小排列为:先Fenton后US>先US后Fenton>Fenton/超声协同。对于先US后Fenton而言,在后续Fenton实验条件不变的情况下,随着US反应时间的增加,吡啶溶液的去除率也逐渐升高,当US反应进行90 min时,其去除率可达61.7%。这可能是由于在超声波的充分作用下,产生的热解效应使得吡啶分子的化学键发生断裂,并在空化作用产生的·OH攻击下进一步破坏吡啶分子结构,从而将其氧化成易被降解的中间产物。然后再进行Fenton反应,由Fenton反应产生的·OH继续攻击吡啶及其中间产物,使得去除率得以提高;对于先Fenton后US而言,当后续US实验条件不变时,随着Fenton降解反应时间的增加,吡啶去除率呈现出先上升后下降的趋势,说明Fenton降解反应时间有一最优值,该最优组合方案为:Fenton反应60 min,US进行90 min,其去除效率能达到80.3%。其主要原因可能是,通过Fenton过程中产生的O2增加了液相中的空化核,这为超声波空化效应创造了良好条件[15],当Fenton法反应60 min时,溶液中的氧达到饱和,促进了空化泡的形成;当Fenton法反应至90 min时,溶液中H2O2剩余浓度与Fenton反应至60 min时相比,其浓度较低,一方面溶液中O2的含量减小,不利于后续超声空化泡的形成,另一方面·OH的产量下降,从而降低了吡啶的去除效果。另外,对于各个实验而言,吡啶的去除率均随着时间的延长而增加。
3 结论
(1)Fenton/US法对模拟吡啶溶液的降解过程满足一级反应动力学规律。
(2)在采用Fenton/US法降解吡啶溶液的过程中,吡啶溶液的降解速率常数K值随着溶液初始pH值的增大先无明显变化,而后逐渐增大;K值存在最大值,该值为1.4×10-3min-1,此时溶液初始pH值为11,这表明吡啶溶液在碱性环境中的降解速率明显优于在酸性环境中的降解速率。
(3)在Fenton/US对吡啶溶液降解的过程中,由超声功率、H2O2和FeSO4·7H2O浓度的增加,引起的吡啶溶液降解速率常数K值的变化具有相同的趋势,即K值均呈现出先上升后下降,且当K值达到最大值时,超声功率、H2O2浓度和FeSO4·7H2O浓度均对应一个临界值,其值分别为400 W、40 mmol/L和0.397 g/L;而随着吡啶溶液初始浓度的提高,其降解速率常数K值逐渐下降,最终趋于稳定。
(4)对比Fenton/US与两种组合工艺(先Fenton后US,先US后Fenton)降解吡啶溶液的研究表明,组合工艺较协同法处理具有更好的去除效果。这是因为协同法并没有很好地利用两种反应的优势;而就组合工艺而言,无论率先进行的是US还是Fenton,均可为后续反应提供更为高效的反应条件,从而提升吡啶的去除率。
