2018-2019年广东地区H9N2亚型禽流感病毒HA基因的遗传进化分析
2020-11-06宋才良廖志宏李鸿鑫蔺文成陈伟国张新珩谢青梅
宋才良,廖志宏,沈 勇,王 焕,李鸿鑫,蔺文成,陈伟国,张新珩,谢青梅
(华南农业大学 动物科学学院,广东 广州 510642)
禽流感病毒(AIV)属于正黏病毒科RNA病毒,具有8个单链RNA片段,编码至少10种蛋白质,包括2种主要的表面糖蛋白(HA和NA),核蛋白(NP),3种聚合酶蛋白(PB2、PB1和PA),基质蛋白(M1),离子通道蛋白(M2)和2种非结构蛋白(NS1和NS2)[1]。其中HA和NA高度可变并以多种亚型的形式存在,根据H9N2 AIV的HA基因划分出4个大的进化分支(h9.1~h9.4)[2]。AIV同种亚型或不同种亚型之间都可以进行广泛的基因重组,从而很大概率上导致了未知病毒的产生[3]。
H9N2 AIV于1966年在美国威斯康星州的火鸡体内被首次分离[4],并于1994年在我国广东省首次被报道;至今依然在世界范围内普遍存在,更是亚洲地区家禽面临的主要疾病之一[5];在多种禽类中表现出流行趋势,其继发性感染给养禽业造成巨大的经济损失[3]。H9N2 AIV不仅影响家禽业还给公共卫生安全带来巨大威胁[6-7]。虽然在国内源自早期病毒株的灭活疫苗已被广泛用于养鸡场来预防H9N2 AIV的发生,但是接种疫苗的鸡群依然可能感染新的H9N2 AIV[8-9]。此外,某些H9N2 AIV具有人类病毒株中存在的受体结合特性,这一因素增加了其在人呼吸道中发生重组的可能性,同时也增加了传播给其他物种的几率[10]。例如:一些H9N2 AIV具有人类典型的受体结合特征,并且H9N2 AIV在红细胞结合位点的变异与能引发人类流感大流行的毒株变异进程相似[11-12]。这些都表明了H9N2 AIV种间传播的可能性及其成为新的地方性毒株的能力。综上推测新出现的流感病毒可能会产生更严重的公共卫生安全问题,因此,对H9N2 AIV的持续监测,对于未来流感大流行的防控非常重要[1]。
H9N2 AIV感染是养禽业面对的主要问题之一。研究表明接种疫苗可限制其传播,但需要更广泛的流行病学调查为研发疫苗提供依据[13]。本试验的主要目的是了解广东地区H9N2 AIV表面糖蛋白HA和NA的系统发育关系以及分子进化特征,为广东地区H9N2 AIV的防控和疫苗研发提供理论依据。
1 材料与方法
1.1 样本采集与病毒分离2018-2019年,采集广东地区某些养鸡场在免疫灭活H9N2 AIV疫苗后仍出现疑似感染H9N2 AIV患病鸡的咽拭子和泄殖腔拭子,保存于含有双抗(100 U/mL的青链霉素)的PBS,涡旋、离心、取上清。取300 μL用AxyPrep体液病毒DNA/RNA小量试剂盒抽提核酸,用以下引物扩增HA与NA基因。HA-F/R:5′-TATTGGTCTCAGGGAGCGAAAGCAGGGG-3′,5′-ATATGGTCTCGTATTAGTAGAAACAAGG-GTGTTTT-3′;NA-F/R:5′-TATTGGTCTCAGGGAGCGAAAGCAGGGTA-3′,5′-TATTGGTCTC-AGGGAGCGAAAGCAGGAGTTTTTT-3′。然后进行RT-PCR鉴定和测序比对[14]。剩余的接种10日龄SPF鸡胚,于37℃、48 h后收尿囊液检测血凝效价。
1.2 遗传进化与序列分析将扩增得到的HA和NA基因与pMD19-T连接后进行测序,使用DNAStar和MEGA进行序列分析和构建系统进化树(表1)。
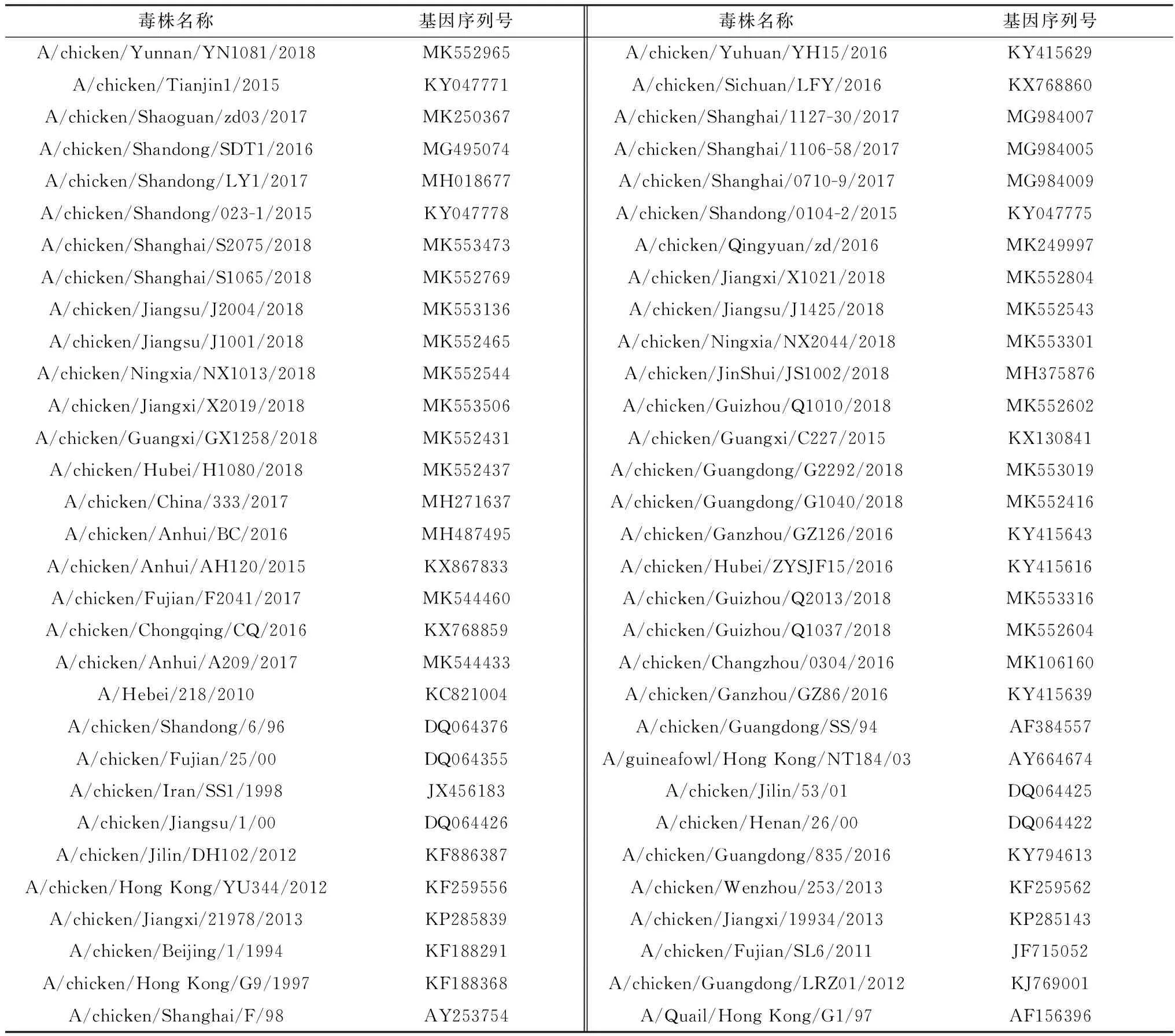
表1 H9N2 AIV参考毒株
1.3 关键位点变化分析为了观测HA和NA基因的关键位点变化,对5株分离株的裂解位点、受体结合位点、潜在糖基化位点以及红细胞结合位点(HB)与市售H9N2亚型AIV疫苗株的全基因组序列进行比对。
2 结果
2.1 病毒分离与鉴定结果通过RT-PCR扩增、测序比对以及从接种上清的SPF鸡胚中收集尿囊液进行血凝试验检测。在2018-2019年共分离出5株H9N2亚型AIV。5株分离株的HA和NA基因上传至NCBI(表2)。

表2 广东地区分离的5株H9N2 AIV
2.2 HA和NA基因的同源性及遗传进化分析对HA基因的分析表明,5株分离株核苷酸序列同源性为88.8%~95.9%;与4株疫苗株BJ/94、F/98、G1/97和G9/97的同源性为88.2%~96.9%。从系统进化树可以看出近5年h9.4.2.5已成为主流分支,5株分离株均属于这一分支(图1)。从NA基因来看,5株分离株核苷酸序列同源性为88.5%~97.0%;与4株疫苗株BJ/94、F/98、G1/97和G9/97的同源性为90.6%~91.1%。从系统进化树可以看出均属于BJ/94分支(图2)。

图1 HA基因进化树
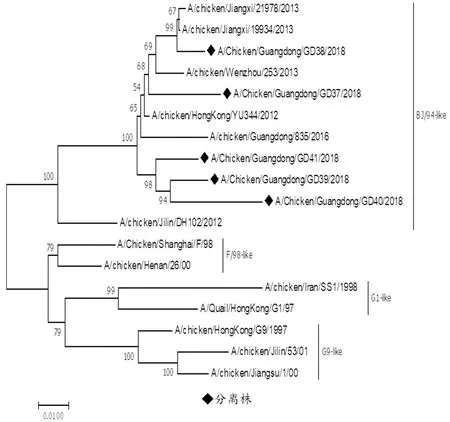
图2 NA基因进化树
2.3 关键位点分析5株分离株裂解位点的氨基酸序列均为PARSSR↓GLF;受体结合位点由109,161,163,191,198,202,203位共7个氨基酸组成,分离毒株中第198位氨基酸的变化较大,存在V、T 2种情况,其他氨基酸相对保守;受体结合位点右侧臂(第146~150位)氨基酸序列变化较大,分别存在 3种形式GTSKA、GTSNA和GTSRA,受体结合位点左侧臂(第232~237位),仅有NGLMGR一种形式(表3)。5株分离株HA氨基酸序列第234位氨基酸均由Q突变为L。在HA的糖基化位点分析中,发现5株分离株共有8个潜在糖基化位点,其中仅有3个保守,缺失了在218位的潜在糖基化位点同时在第313位增加了潜在的糖基化位点(表4)。分析NA基因氨基酸序列中的红细胞结合位点,发现5株分离株在第431~433位变化较大有PGV和PRV这2种形式(表5)。

表3 HA基因裂解位点和受体结合位点
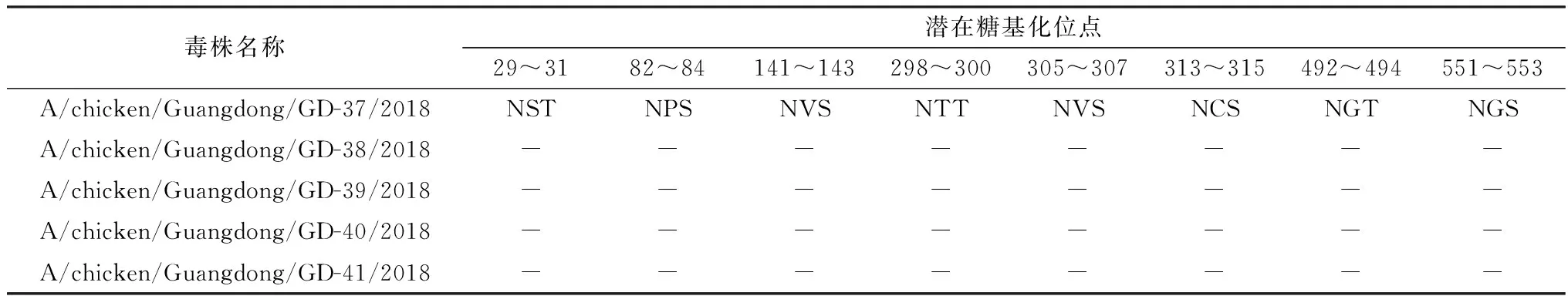
表4 HA基因潜在糖基化位点
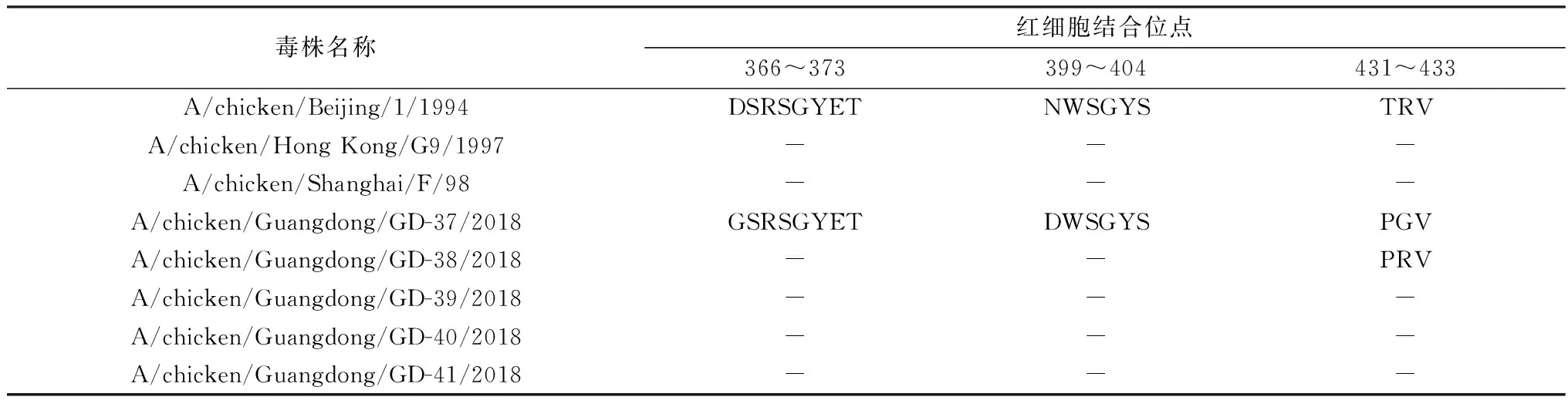
表5 NA基因红细胞结合位点
3 讨论
基于2018-2019年在广东地区分离出的5株H9N2 AIV均是在冬春季节发现,可以推测H9N2亚型AIV通常在寒冷和潮湿的冬季和春季传播。因此冬春交替时尤其要加强养殖场对AIV的防护措施。接种疫苗是防止AIV流行的有效方法,但市售商品化疫苗往往是针对已暴发的AIV[15],很大几率上造成疫苗与正在传播的病毒之间的不匹配导致保护作用很小甚至没有保护作用[16]。因此,需要根据流行病学的调查结果准确地预测出当下哪株菌株将占据主导地位,以减少AIV造成的经济损失。此外虽然近10年我国分离出的H9N2 AIV大多数都属于h9.4.2分支[17],但基于HA基因的进化分析发现它们之间是存在差异的,这与它们的分离区域或裂解位点处的氨基酸序列有关。系统发育分析表明有些分离株与疫苗株有较远的遗传关系,因此疫苗株需要更新,候选病毒株应从可能占优势的进化分支中选择[13]。
HA蛋白在感染过程中通过蛋白酶的作用被水解为HA1和HA2两个亚单位。HA1容易发生抗原漂移,而HA2存在能诱导产生交叉反应抗体的抗原表位,两者共同作用使病毒有很大几率会逃避机体产生的免疫反应。HA蛋白的裂解位点和潜在的糖基化位点是影响AIV抗原性的重要因素。低致病性毒株在裂解位点处只有1个精氨酸(R),而高致病性毒株有多个碱性氨基酸[18]。本试验中的5株分离株均符合低致病性AIV的特征。病毒感染宿主的范围是由HA基因受体结合位点所决定的,其中大部分是相对比较保守的,但也存在一些易变异的位点[19]。例如HA受体结合位点特定位置的氨基酸决定了对人或禽样唾液酸受体的亲和力。在HA基因中位于226位的氨基酸最为重要,因为当其为亮氨酸时会导致对人型受体更高的亲和力,而谷氨酰胺决定了禽类受体的特异性。当病毒适应新的宿主时,决定其受体特异性的234位氨基酸首先发生改变[20]。本试验的5株分离株234位氨基酸均为亮氨酸(L),具有与哺乳动物细胞中的α-2,6半乳糖苷链连接的唾液酸受体结合的特性。这一位点的变化有可能会改变病毒的抗原性并进一步影响受体结合特性从而感染新的宿主,因此在公共卫生学上要引起必要的重视[20]。
HA蛋白的迁移率分析表明,HA蛋白中氨基酸残基313和218位的2个潜在糖基化位点均为功能性糖基化位点[21]。HA蛋白的某些糖基化位点变化可能对病毒生物学特性的变化具有显著效果[22],如毒性和受影响的病毒蛋白的功能。研究表明,HA蛋白切割位点附近的糖基化状态的变化可能会影响病毒的毒力[23]。在流感病毒的HA蛋白的受体结合位点区域糖基化状态的变化可能会影响与病毒相关的结合抗体,从而产生HA突变体[21];同时H9N2 AIV第218位糖基化位点的缺失和313位糖基化位点的增加会影响病毒的感染力以及病毒在组织中的复制能力[24]。根据第313和218位氨基酸残基糖基化位点的变化,可以把H9N2 AIV的演变分为三类。在这些类别中,氨基酸残基313和218处糖基化位点的变化是动态的。在近10年中,根据其所占比例而言218G+/ 313G+型病毒在2008-2012年占据优势地位,而218G-/ 313G+型病毒在2013-2016年占绝对优势。这些变化是在病毒进化过程中发生的。通过软件预测本试验分离到的5株H9N2 AIV在218位的糖基化位点均缺失,其313位均存在潜在的糖基化位点,因此对于广东地区的H9N2 AIV的防控不能松懈。但符合上述条件的病毒由于感染力和在组织中复制能力的增强是否影响病毒传播能力和宿主范围的变化还需要进一步研究。NA的红细胞结合位点在AIV中高度保守。然而那些可以在哺乳动物中传播的AIV由于红细胞结合位点通过各种取代,从而降低了它们的红细胞结合能力[12]。5株分离株的NA基因氨基酸序列在红细胞结合位点处存在变异现象应该引起重视。
本试验结果表明,广东地区目前流行的H9N2 AIV主要属于h9.4.2.5谱系,与目前疫苗株之间的亲缘关系较远。通过对HA和NA基因的同源性分析,发现分离株与疫苗株的同源性存在差异。此外抗原特性表明,分离株与当前使用的疫苗株相比有所不同。尽管5株分离株均属于低致病性H9N2 AIV,但这些菌株还是具有与人类受体结合的潜在亲和力,并且与疫苗菌株相比表现出一定的遗传差异。通过对HA和NA基因氨基酸序列中发现的突变分析表明,这些新的菌株可能具有跨越物种屏障或者感染人类的遗传能力,有对公众健康造成严重威胁的可能[25-28]。因此,需要对H9N2 AIV进行长期系统的年度监测,并挑选出可有效保护广东地区免受H9N2 AIV侵袭的新疫苗株。否则此种情况有可能给我国H9N2 AIV的未来进化和生态系统带来极大的不确定性。本试验为广东地区H9N2亚型AIV的防控和疫苗研发提供了理论依据。
