催乳素受体剪接体在绵羊不同泌乳期乳腺组织中的表达规律
2020-11-06杨若晨段春辉李闰婷郭云霞张英杰刘月琴
杨若晨,段春辉,李闰婷,郭云霞,张英杰,刘月琴
(河北农业大学 动物科技学院,河北 保定 071000)
催乳素(PRL)是一种由垂体前叶合成并分泌的多肽类激素[1-2],PRL通过与其受体结合是发挥PRL生理功能过程中细胞信号转导通路的第一步[3]。PRLR为仅含有1个跨膜区域的跨膜蛋白,由膜外域、跨膜域和胞内域三部分组成,结构具有多样性。近年来,越来越多的研究表明,PRLR基因与繁殖息息相关。已知在反刍类动物中,绵羊、牛和山羊存在长型催乳素受体(L-PRLR)与短型催乳素受体(S-PRLR)2种剪接的转录本异形体[4-6]。SHI等[7]研究发现,L-PRLR在所有检测的奶山羊组织中普遍表达,在肌肉中mRNA的丰度最高,其次是肝脏、皮下脂肪和乳腺,脾脏中丰度最低。李晓雨等[8]研究发现,PRLR在不同生理时期绵羊组织发挥的作用不同。但是目前PRLR的2种剪接体在动物生命活动中的功能还不明确,且在不同生理阶段的表达规律也未见报道。
本试验通过研究小尾寒羊哺乳前期、中期、后期及断奶后L-PRLR与S-PRLR的mRNA在绵羊乳腺中的表达变化,旨在为明确PRLR不同剪接体对乳腺功能的调节作用提供理论依据。
1 材料与方法
1.1 试验地点和时间试验于2019年8月1日至2019年10月1日在河北省衡水市志豪畜科技有限责任公司进行。
1.2 试验设计选取年龄一致、体质量相近、同一天产双羔的小尾寒羊母羊20只,随机分为4组,每组5只,Ⅰ,Ⅱ,Ⅲ,Ⅳ组母羊分别在哺乳前期(产后7 d)、哺乳中期(产后29 d)、哺乳后期(产后50 d)、断奶后5 d屠宰取乳腺组织。
1.3 试验羊的饲养管理20只试验羊于同一圈中饲养,试验期间的饲养管理按照衡水市志豪畜牧科技有限公司的饲养方案统一进行。
1.4 样品采集试验羊屠宰前1 d禁食,采用颈静脉放血方式进行屠宰,4次屠宰均在上午8:00进行。屠宰去皮后,分离乳腺组织,剪碎至0.2 cm3的组织小块立即投入液氮中,样品带回实验室后,-80℃ 保存备用。
1.5 RNA提取和cDNA合成按北京全式金TransZolTM试剂盒说明书提取乳腺组织中的总RNA,并去基因组DNA,42℃反应2 min。反应体系(10.0 μL):5×gDNAEraser Buffer 2.0 μL,gDNA 1.0 μL,Total RNA 1.0 μL,RNA Free dH2O 6.0 μL。反转录cDNA反应程序:42℃孵育15 min,85℃加热5 s,-20℃保存备用。
1.6 RNA电泳检测采用1×TAE电泳缓冲液配制1%琼脂糖凝胶,调节电压为100 V,使RNA由负极向正极电泳25 min。
1.7 ORT-qPCR应用Oligo6.0引物设计软件设计内参基因及L-PRLR、S-PRLA引物,引物序列见表1。RT-qPCR的反应程序:95℃ 30 s;95℃ 5 s,60℃ 15 s,72℃延伸10 s,45个循环。
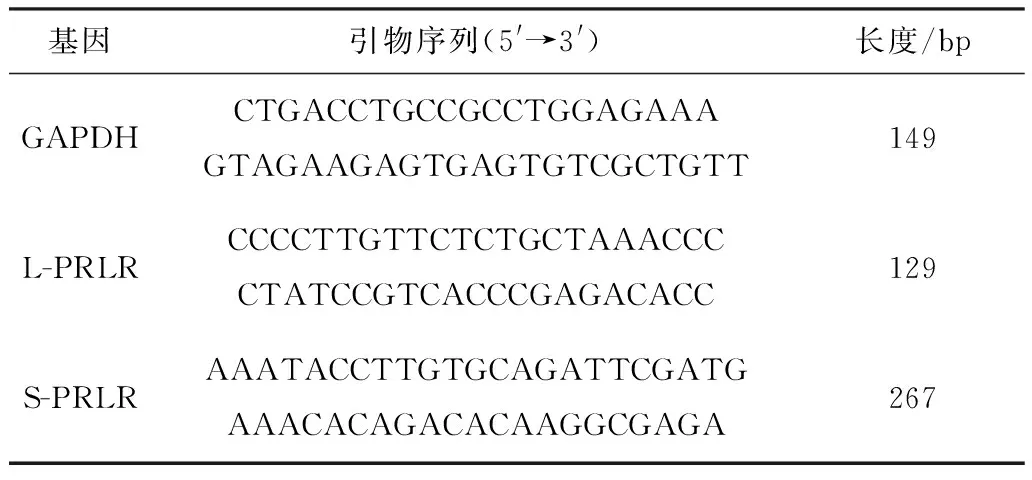
表1 引物序列及产物片段长度
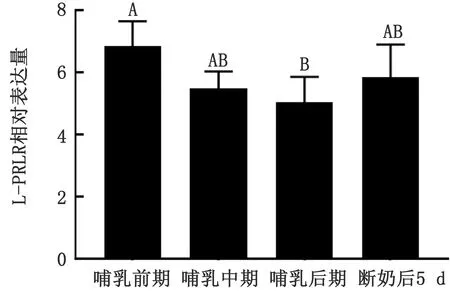
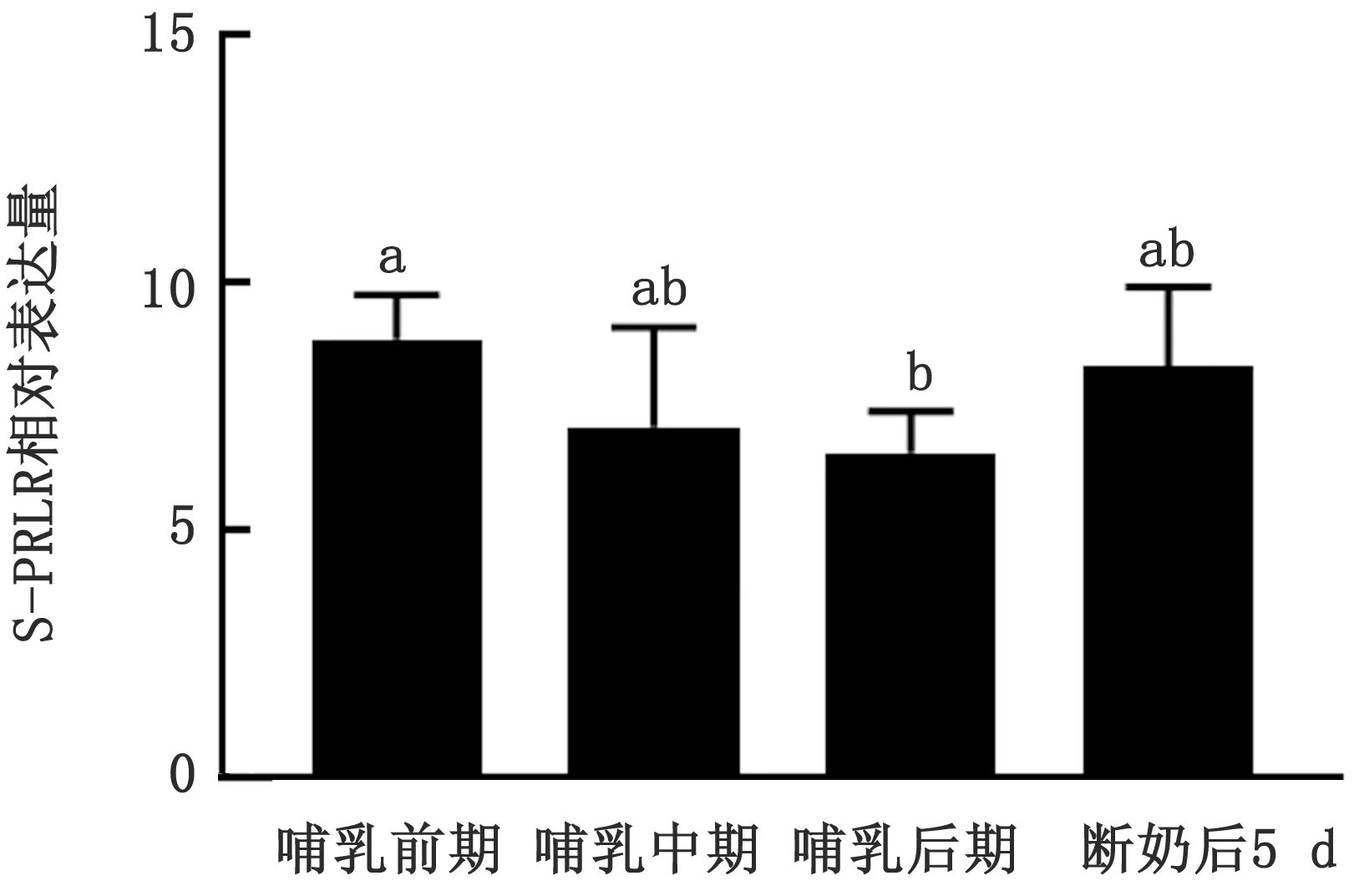
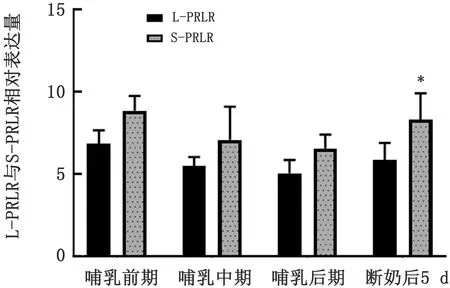
1.8 数据分析采用2-△△Ct计算乳腺组织中L-PRLR与S-PRLR的相对表达量。利用Graphpad 6.0软件中的Ordinary One-way ANOVA和t检验程序对数据进行统计分析。显著性水平为P<0.05差异显著,0.05 2.1 小尾寒羊母羊乳腺组织中总RNA提取总RNA电泳结果显示,18S和28S处条带清晰可见,5S处条带较弱(图1),表明RNA的完整性较好,降解不明显。所有样品均用分光光度计测量,D260/D280值均为1.80~2.00,表明样品纯度较好,无蛋白质与DNA污染,样品符合试验要求。 图1 乳腺组织RNA电泳图 M.Marker;1~3.产物 2.2 不同生理时期小尾寒羊乳腺组织中PRLR的剪接体mRNA表达分析不同生理时期小尾寒羊乳腺组织中PRLR的剪接体mRNA表达结果见图2~4。由图2可知,由哺乳前期至哺乳后期,L-PRLR 的相对表达量呈下降趋势,而哺乳后期至断奶后,L-PRLR的相对表达量呈上升趋势。其中,L-PRLR的相对表达量在哺乳前期显著高于哺乳后期(P<0.05),其他时期L-PRLR的相对表达量均差异不显著(P>0.10)。 由图3可知,由哺乳前期至哺乳后期,S-PRLR的相对表达量呈下降趋势,而哺乳后期至断奶后,S-PRLR 的相对表达量呈上升趋势。其中,S-PRLR的相对表达量在哺乳前期较哺乳后期有显著增高趋势(0.05 由图4可知,小尾寒羊在哺乳前期、中期、后期及断奶后的乳腺组织中S-PRLR的相对表达量均高于L-PRLR,且断奶后L-PRLR在乳腺组织中的相对表达量显著低于S-PRLR(P<0.05),其他3个时期两者的差异不显著(P>0.10)。 图2 小尾寒羊母羊乳腺组织中L-PRLR在4个时期的相对表达量 注:相同字母表示差异不显著(P>0.10);不同大写字母表示差异显著(P<0.05) 图3 小尾寒羊母羊乳腺组织中S-PRLR在4个时期的相对表达量 注:相同字母表示差异不显著(P>0.10);不同小写字母表示差异有显著趋势(0.05 图4 小尾寒羊母羊在4个时期L-PRLR与S-PRLR的相对表达量比较 注:*表示同一时期差异显著(P<0.05);未标注表示差异不显著(P>0.10) 3.1 PRLR不同剪接体的功能分析研究表明,2种亚型的PRLR共同表达对啮齿类动物卵巢卵泡的正常生理发育具有重要意义[9]。大鼠中PRLR的mRNA在黄体期均表达,且L-PRLR的表达量大于S-PRLR[10-11]。THOMPSON等[12]对小鼠L-PRLR与S-PRLR在卵巢中的表达进行分析,表明L-PRLR可能参与卵泡发育,而S-PRLR可能参与黄体的形成和维持。由此可知,L-PRLR与S-PRLR这2种剪接体在小鼠卵巢中的作用不同。ZI等[13]研究表明,在杂合子PRLR敲除雌性小鼠时,S-PRLR的过表达拯救了乳腺发育和功能。BERLANGA等[14]发现L-PRLR能激活β-酪蛋白基因启动子,而S-PRLR没有这种能力,同时2种剪接体的PRLR共同表达会阻碍PRL信号向乳蛋白基因启动子的传导,说明L-PRLR与S-PRLR在啮齿类动物乳腺中的功能不同,且S-PRLR能抑制催乳信号的传导。本试验结果显示,泌乳量很低的泌乳前期、泌乳结束的断奶后5 d的S-PRLR表达量均很高,间接验证了BERLANGA等[14]的研究结论。在哺乳动物中,对绵羊进行免疫组织化学和逆转录PCR分析卵巢在整个发情周期内S-PRLR和L-PRLR的定位和表达均存在差异,L-PRLR尤其局限于原始卵泡周围的基质细胞和原发性卵泡,而PRLR亚型均存在于窦前卵泡和黄体细胞的颗粒细胞中。在羊发情周期中发现S-PRLR的mRNA稳定表达,但L-PRLR的mRNA表达量在发情期增加而在黄体中期和在卵泡期开始时下降[3],而PRL不同剪接体在哺乳动物乳腺组织中的表达规律及生理功能有待进一步研究。 3.2 泌乳生理阶段对乳腺组织PRLR表达的影响BUCK等[15]报道,小鼠乳腺组织PRLR基因的表达水平在空怀期、妊娠期以及泌乳期无显著性变化,但在泌乳前期至泌乳中期PRLR的表达量呈下降趋势。CASSY等[16]研究了绵羊妊娠期和泌乳期PRLR基因在乳腺的发育和表达,结果表明PRLR mRNA的水平在妊娠期的第2个阶段上升,在妊娠期的最后阶段下降,泌乳期比妊娠期的水平高且保持相对稳定。此外,在泌乳期及干奶期的奶山羊的乳腺组织中均检测到PRLR的表达,且不同时期有差异,相对于泌乳前期,泌乳中期PRLR的表达量呈下降趋势,在泌乳后期下降为最低点后至干奶期逐渐上升[8,17]。在本试验中,L-PRLR与S-PRLR在乳腺中的相对表达量均在哺乳前期达到最高,此后开始下降,在哺乳后期时表达量最低,断奶后又呈上升趋势。研究发现,动物分娩前后,乳腺PRLR可增加数十倍,且PRLR在泌乳发动的2个阶段(第1阶段:妊娠后期开始少量分泌乳汁;第2阶段:伴随分娩分泌大量乳汁的起始阶段)均增多,PRL可与乳腺分泌细胞膜上的受体结合,促进乳蛋白和酶的mRNA的合成,哺乳阻抑下丘脑的PRL释放抑制激素的分泌,解除对腺垂体的抑制,催乳素的释放增多,从而PRLR的相对表达量增多[18],结果与本试验一致。本试验中L-PRLR与S-PRLR的相对表达量均在哺乳前期时达到最高,而泌乳高峰期过后,随着泌乳量的降低,动物机体对PRL的需求量也逐渐降低,故哺乳前期至哺乳后期L-PRLR与S-PRLR的相对表达量均呈下降趋势。李真等[17]的研究结果也与本试验一致,PRLR在干奶期表达量高于泌乳后期。可能是因为泌乳期结束后,乳腺进入退化期,此时脂肪垫重新生成,脂肪细胞内的PRLR mRNA含量较高[19]。因此,断奶后L-PRLR与S-PRLR的表达量上升可能与乳腺重构有关。 本试验在整个哺乳期及断奶后5 d小尾寒羊乳腺组织中S-PRLR的相对表达量均高于L-PRLR,说明2种剪接体在乳腺中的生理作用存在差异。LESUEUR等[20]已经证实了L-PRLR的作用是诱发PRL靶基因的表达,调节PRL诱导信号的传导,并且对PRL转录后的调节有一定的功能;而S-PRLR 的作用仍不清楚。但是,最近的研究发现,绵羊PRLR cDNA的全长编码序列S-PRLR与L-PRLR 分别对应272和557个氨基酸,与反刍动物长型PRLR转录本相比,短型异形体转录本是由第9外显子剪接到第9内含子最后的39 bp而形成,此处插入的39 bp的3′末端含有2个连续的终止密码子TAA和TAG,所以其编码了反刍动物S-PRLR 的最后11个氨基酸[21]。基因组分析表明,这个片段的存在或缺失是造成同转录物交替剪接的原因,并非是存在不同的基因。而S-PRLR和L-PRLR编码序列的唯一区别是在细胞质域的起始处是否存在1个39 bp的插入,在其3′端有2个相邻的插框终止密码子[7],因此,其编码序列的不同可能导致了两者功能的不同。小尾寒羊乳腺组织中PRLR的2种剪接体的具体功能及作用机制还有待进一步研究。2 结果
3 讨论
