Polymyxin NP实验筛查肠杆菌科多黏菌素耐药菌株临床评价
2020-11-06沈平华史保庆蒋晓飞
唐 瑜, 沈平华, 史保庆, 蒋晓飞
(1. 上海交通大学附属胸科医院检验科,上海 200030;2. 上海市第一妇婴保健院检验科,上海 200040;3. 枣庄市市中区矿务局医院检验科,山东 枣庄 277100);4. 复旦大学附属华山医院检验科,上海 200040;
碳青霉烯类耐药肠杆菌科细菌(carbapenemresistantEnterobacteriaceae,CRE)引起的临床感染在全球范围内均有报道,由于可选的抗菌药物十分有限,CRE已成为临床抗感染治疗面临的重大挑战[1]。多黏菌素被认为是治疗CRE感染的最后一道防线,但其耐药率也呈逐渐上升趋势。目前实验室的常规检测方法(纸片扩散法、E试验和仪器法等)无法有效、准确地检出多黏菌素耐药菌株[2-5],微量肉汤稀释法操作繁琐,且费时费力[2]。NORDMANN等[6]建立的Polymyxin NP实验操作简便,可以在2~4 h内快速检出对多黏菌素耐药的肠杆菌科细菌。本研究拟对临床分离的461株肠杆菌科细菌进行Polymyxin NP实验初筛,并采用微量肉汤稀释法进行验证,采用实时定量聚合酶链反应(realtime quantitative polymerase chain reaction,qRT-PCR)、聚合酶链反应(polymerase chain reaction,PCR)及测序法分析各菌株多黏菌素耐药机制,探讨Polymyxin NP实验在多黏菌素耐药菌株检测中的临床价值。
1 材料和方法
1.1 菌株来源及分类
收集2016年2—6月复旦大学附属华山医院肠杆菌科非重复临床分离株,采用VITEK-2 compact微生物鉴定系统(法国生物梅里埃公司)对所有菌株进行鉴定。461株肠杆菌科细菌中,肺炎克雷伯菌292株(63.34%)、大肠埃希菌160株(34.71%)、阴沟肠杆菌7株(1.52%)、产酸克雷伯菌2株(0.43%)。分离自痰液样本201株(43.60%)、尿液样本177株(38.39%)、血液样本24株(5.21%)、引流液样本21株(4.56%)、胆汁样本8株(1.74%)、其他样本30株(6.51%)。
1.2 体外药物敏感性试验
采用纸片扩散法检测461株肠杆菌科细菌对临床常用抗菌药物的敏感性,替加环素耐药折点参考欧洲抗菌药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)的判读标准[7],其他药物敏感性结果评判以美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)抗菌药物敏感性试验2014版要求为标准[8]。采用微量肉汤稀释法测定菌株对多黏菌素的最小抑菌浓度(minimum inhibitory concentration,MIC),并以该结果为标准,与Polymyxin NP实验结果进行比对。质控菌株大肠埃希菌(ATCC 25922)购自上海临床检验中心。
1.3 Polymyxin NP实验
参考文献[6]的方法预先配制Polymyxin NP实验所需溶液。(1)A液:准确称量M-H肉汤粉末25 g、酚红指示剂0.05 g,溶解于800 mL去离子水中,然后用盐酸溶液调节pH值为6.7,加水补足至900 mL。标准大气压下,121 ℃高压灭菌15 min,待恢复至室温(22~24℃)后,加入100 mL无菌的10%葡萄糖溶液,混匀后备用。(2)B液:在A液中加入多黏菌素(美国Sigma-Aldrich公司)至终浓度为5 μg/mL。挑取新鲜培养的待测菌株、阴性对照菌株[大肠埃希菌(ATCC 25922)]和阳性对照菌株(奇异变形杆菌),用0.9%氯化钠溶液调成3.0~3.5麦氏浓度的菌悬液,用于后续实验。在无菌96孔培养板的A1~A6孔中加入150 μL A液,作为每组的生长对照,在B1~B6孔中加入150 μL B液(含5 μg/mL多黏菌素);在A1和B1孔中分别加入50 μL 0.9%氯化钠溶液作空白对照,A2和B2孔中分别加入50 μL已配制好的大肠埃希菌(ATCC 25922)菌液作阴性对照,A3和B3孔中分别加入50 μL奇异变形杆菌菌液作阳性对照,其余每组的A和B孔中分别加入50 μL待测菌株菌液,B孔中多黏菌素终浓度为3.75 μg/mL,在36 ℃条件下孵育4 h,观察并记录颜色变化。结果判读:当空白对照2孔均为橙色,其余各组生长对照(A孔)均为黄色,则实验结果有效;若B孔溶液由橙色变为黄色,表示Polymyxin NP实验结果为阳性,提示该菌对多黏菌素耐药。
1.4 PCR扩增
采用高温煮沸法裂解细菌,提取总DNA为模板,采用PCR扩增质粒介导的多黏菌素耐药基因mcr,扩增引物见表1,扩增产物经测序进一步验证;采用PCR扩增肺炎克雷伯菌染色体上的pmrA、pmrB、phoP、phoQ和mgrB基因,引物设计参考文献[9],PCR扩增产物测序后与NCBI数据库(www.ncbi.nlm.nih.gov)中的信息进行比对,分析序列变异性。

表1 扩增多黏菌素耐药基因mcr引物序列
1.5 qRT-PCR
采用qRT-PCR检测phoP、phoQ、pmrD、pmrC、pmrA、pmrB和pmrK基因的转录水平。首先将菌株培养至对数期[600 nm处吸光度(A)值为0.8~0.9],取1 mL培养物,按RNA抽提试剂盒(德国Qiagen公司)说明书要求提取总RNA。采用SYBR PrimeScript RT-PCR试剂盒(日本Takara公司)进行逆转录和基因转录的定量检测,引物设计参考文献[9],以多黏菌素敏感的肺炎克雷伯菌标准株(ATCC 13883)(购自上海临床检验中心)为参考,分析耐药菌株中双组分调控系统相关基因的表达水平。
1.6 统计学方法
采用Excel 2016及GraphPad Prism 6软件进行统计分析。计数资料采用率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Polymyxin NP实验结果及多黏菌素耐药肠杆菌科细菌检出情况
461株肠杆菌科细菌中,Polymyxin NP实验筛查显示13株为阳性,耐药率为2.81%。其中肺炎克雷伯菌10株,阴沟肠杆菌2株,大肠埃希菌1株,Polymyxin NP实验阳性菌株MIC见表2,部分Polymyxin NP实验结果见图1。微量肉汤稀释法药物敏感试验结果显示,Polymyxin NP实验阳性的菌株对多黏菌素的MIC值均达到耐药水平,符合率为100%。未发现2种方法结果不一致的情况。

表2 Polymyxin NP实验阳性菌株信息和多黏菌素MIC结果
2.2 体外药物敏感性试验结果
461株肠杆菌科细菌对多种头孢菌素(头孢唑啉、头孢呋辛、头孢噻肟和头孢吡肟)、环丙沙星、哌拉西林的耐药率>75%,对替加环素的耐药率为7.16%。多黏菌素耐药菌株和敏感菌株对多种常用抗菌药物(庆大霉素、头孢唑啉、头孢呋辛、头孢噻肟、头孢美唑、头孢他啶、亚胺培南、美罗培南和替加环素)的耐药率差异无统计学意义(P>0.05)。见表3。

图1 部分Polymyxin NP实验结果
2.3 多黏菌素耐药菌株的耐药机制分析
13株多黏菌素耐药肠杆菌科细菌中,mcr基因扩增后,经1%琼脂糖凝胶电泳分析及测序确认,大肠埃希菌ECO1500携带质粒介导的多黏菌素耐药基因mcr-1(图2)。对多黏菌素耐药菌株进行双组分调控系统相关基因PCR筛查发现,10株肺炎克雷伯菌均含有pmrA/pmrB和PhoP/PhoQ双组分调控系统,2株阴沟肠杆菌和1株大肠埃希菌为阴性。对10株双组分调控系统阳性的肺炎克雷伯菌进行pmrA、pmrB、phoP、phoQ和mgrB基因测序及qRT-PCR,结果显示有3株(KP1305、KP1542和KP1543)mgrB基因有ISKpn14插入突变,KP340的pmrB位点出现了R256G突变;其余6株pmrK基因表达水平均有不同程度的上调,最低为9.6倍,最高为31倍,KP1202和KP199的pmrA、pmrD、phoP和phoQ基因也明显上调。各基因的相对表达水平见表4。
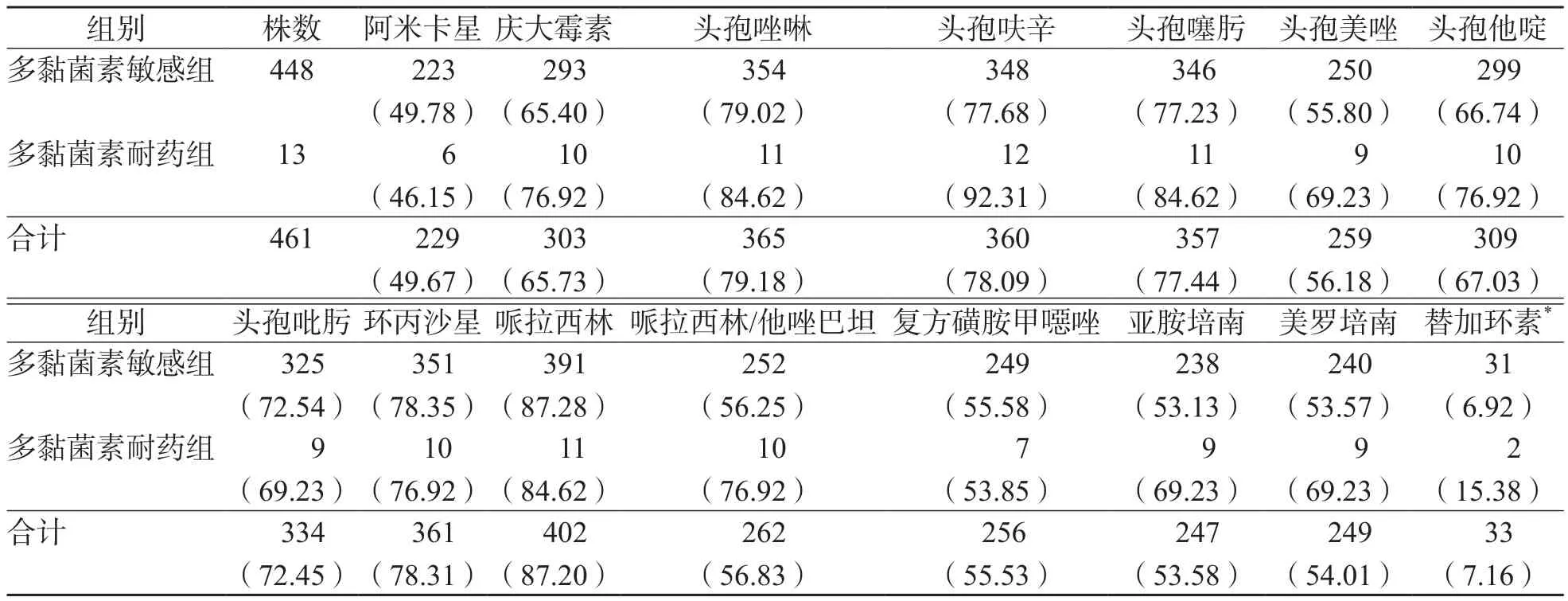
表3 肠杆菌科细菌对临床常用抗菌药物的耐药情况
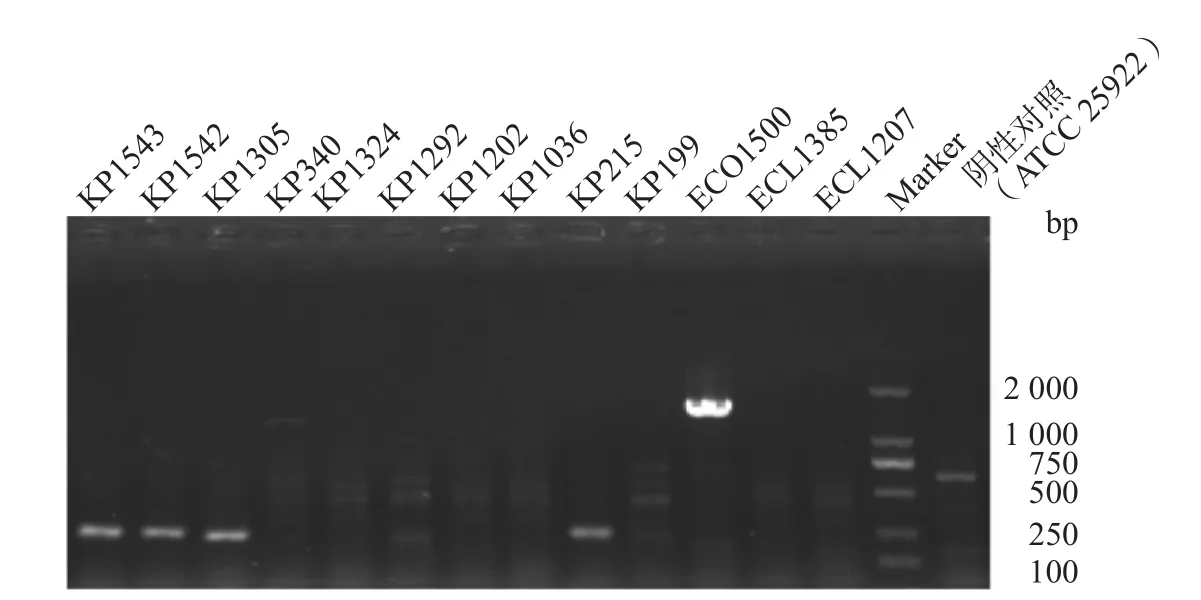
图2 mcr基因检测结果电泳图
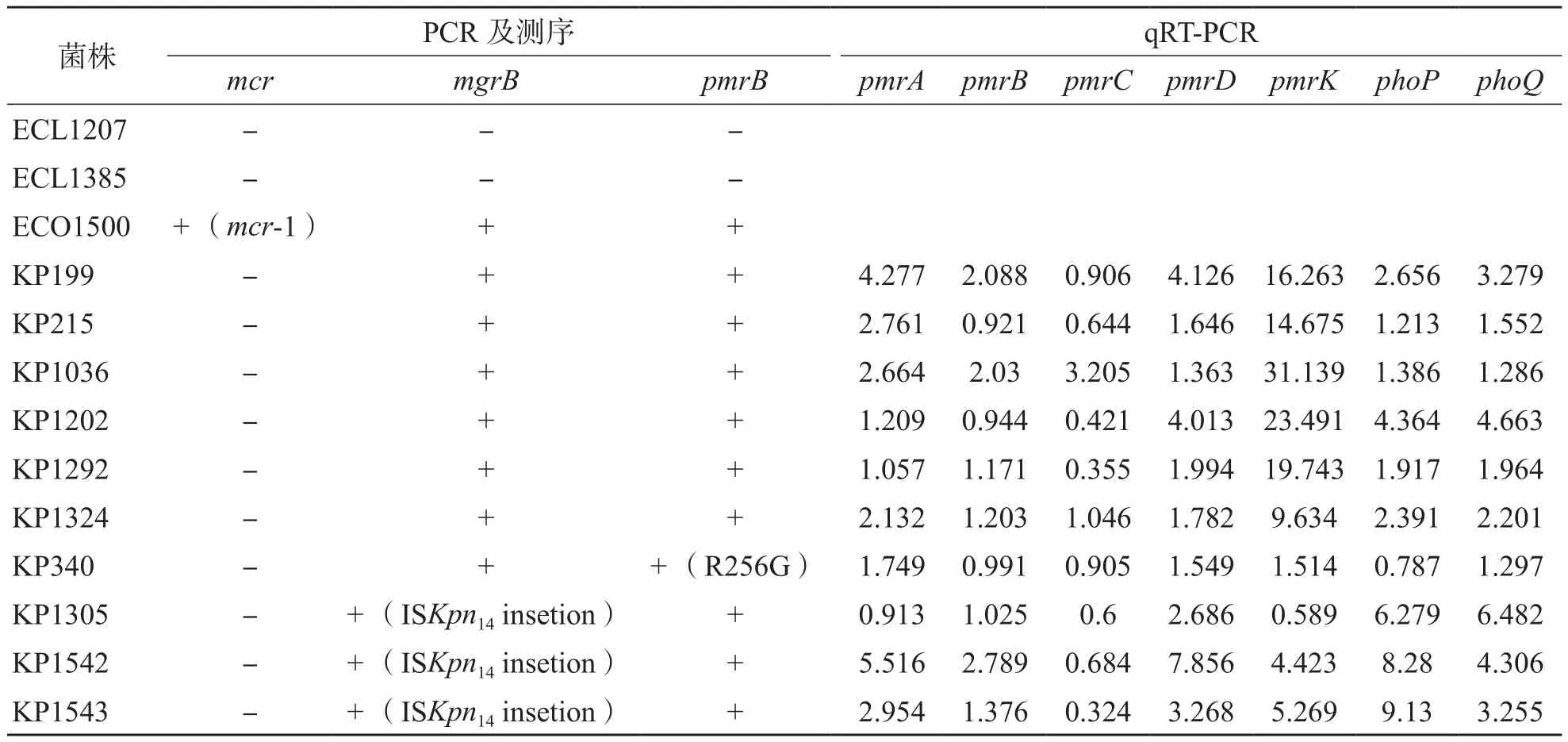
表4 13株多黏菌素耐药菌株的耐药机制分析
3 讨论
肠杆菌科细菌是临床主要的条件致病菌,可引起严重的非社区性感染,如肺炎、血流感染、腹腔感染和中枢神经系统感染等[10]。多重耐药肠杆菌科细菌在全球范围内的广泛流行已成为临床抗感染治疗的一大难题[11]。多黏菌素(E和B)被认为是治疗多重耐药肠杆菌科细菌感染的最后一道防线[12-13]。近年来,多黏菌素耐药肠杆菌科细菌在全球的报道逐渐增多,尤其是质粒介导的多黏菌素耐药基因mcr在社区和医院环境的出现和快速播散,使得肠杆菌科细菌的耐药形势更为严峻,尤其是在CRE流行的国家和地区,因此有必要在临床工作中进行多黏菌素药物敏感性监测[5,14]。
目前临床实验室的常规检测方法,如纸片扩散法、E试验或仪器法等均无法有效检出多黏菌素耐药菌株。微量肉汤稀释法操作繁琐、耗时长,难以在实验室日常工作中进行。此外,由于染色体介导的多黏菌素耐药机制复杂多样,分子检测方法同样不适用于多黏菌素耐药菌株的检测[2,5]。
Polymyxin NP实验可以在2~4 h内快速检出对多黏菌素耐药的肠杆菌科细菌,该方法利用肠杆菌科细菌生长过程中的糖类代谢特征,即肠杆菌科细菌发酵葡萄糖产酸,pH值改变使酸碱指示剂酚红由橙色转变为黄色,从而达到检测的目的[12]。Polymyxin NP实验结果与CLSI和EUCAST推荐的微量肉汤稀释法结果一样可靠,但更加简单、快速,且不需要苛刻的实验条件,一般的临床微生物实验室均可开展,是非常理想的多黏菌素耐药菌株监测方法。本研究纳入的461株肠杆菌科细菌中,13株多黏菌素耐药株在2 h内均表现为Polymyxin NP实验阳性,所有多黏菌素敏感菌株均表现为阴性结果。13株多黏菌素耐药株中,肺炎克雷伯菌主要由染色体上的mgrB基因发生插入突变和双组分调控系统pmrA/pmrB、PhoP/PhoQ突变或表达上调介导,大肠埃希菌则由质粒携带的mcr-1基因介导,而以上多黏菌素耐药相关基因在阴沟肠杆菌中均未被检出,提示阴沟肠杆菌对多黏菌素的耐药性由其他机制介导。上述结果表明,Polymyxin NP实验对不同机制的介导的多黏菌素耐药肠杆菌科细菌均具有良好的检出率和准确性,可以用于多黏菌素耐药肠杆菌科细菌的临床筛查。
相较于欧美国家,我国的多黏菌素耐药率较低[15-16]。多黏菌素耐药一般由染色体上的基因突变pmrA/pmrB和PhoP/PhoQ表达上调引起,常出现在肺炎克雷伯菌中,但近年来随着质粒介导的mcr基因的出现和播散,多黏菌素耐药性可通过质粒介导的基因水平转移在种属内和不同种属之间传播,mcr基因主要流行于大肠埃希菌和肺炎克雷伯菌中[5,9,16-17]。此外,鲍曼不动杆菌、铜绿假单胞菌等革兰阴性菌对多黏菌素耐药的报道和研究也日益增多,但不动杆菌属、假单胞菌属等非发酵菌无法酵解葡萄糖产酸,因而无法通过Polymyxin NP实验进行临床筛查和监测[6,12,18]。
综上所述,Polymyxin NP实验是一种快速、有效的多黏菌素耐药肠杆菌科细菌筛查方法,尽管目前我国肠杆菌科细菌对多黏菌素的耐药率显著低于欧美国家,但耐药菌株的日益增多,尤其是质粒介导的mcr基因的播散使耐药性难以控制,应当引起足够的重视。多黏菌素耐药肠杆菌科细菌严重影响着临床抗感染治疗,有必要进行多黏菌素耐药性监测,对该类耐药细菌的防控至关重要。
