风心病患者瓣膜置换术后肺动脉压变化及其与肺氧合的相关性
2020-11-06肖宗位谢飞马辰
肖宗位,谢飞,马辰
成都市第二人民医院胸心外科,四川 成都 610017
尽管体外循环技术和肺保护不断进步,但体外循环术后的肺氧合不良仍是心脏外科最常见的并发症和导致死亡的最主要原因之一[1]。风心病患者长期病程导致肺血管损伤以及体外循环肺缺血再灌注、全身炎症反应综合征、输注大量血制品、肺不张、鱼精蛋白过敏等所致肺毛细血管部分阻塞和肺血管损伤加重是心脏手术后发生肺氧合不良的主要原因[2]。既往常用氧合指数反映肺氧合情况,但其仅能反映肺氧合即时情况,对短时间内肺氧合总体情况目前尚无良好指标反映。肺动脉压增高是风心病二尖瓣病变自然病程中出现的病理性改变[3]。风心病患者术前出现肺动脉高压是手术后出现呼吸系统并发症以及短期和长期生存率下降的重要危险因素,其与心肺结构改变密切相关,是心肺疾病严重程度的标志[4-5],欧洲心脏病学会和欧洲心胸外科协会已将其作为判断二尖瓣、主动脉瓣疾病是否具有手术指征的一个指标[6]。本研究通过测定我院风心病二尖瓣病变患者围术期肺动脉压和肺氧合变化,评估围术期肺动脉压对术后肺氧合情况的预测价值。
1 资料与方法
1.1 一般资料 前瞻性选取2019 年2 月至2020年2月在成都市第二人民医院胸心外科入院治疗的55例患者,心脏彩超检查均确诊为风湿性二尖瓣病变。根据术毕时肺动脉收缩压(SPAP)测定值分为肺动脉压正常组(正常组)31 例和肺动脉高压组(高压组)24例。排除标准:甲状腺功能代谢异常者;术前合并无法控制的感染性疾病;肝肾功能衰竭、慢性阻塞肺疾病、肺纤维化等疾病;术前使用糖皮质激素及其他抑制免疫功能的药物;围手术期使用肺血管扩张剂、鱼精蛋白过敏;非计划重返手术者。本研究经成都市第二人民医院医学伦理委员会审查通过。
1.2 手术方法 全麻后患者取仰卧位,做胸部正中切口长约20 cm,切开皮肤、皮下组织,沿胸骨中线纵向锯开胸骨,彻底止血后,纵向切开并悬吊心包,3 mg/kg肝素静脉注射,全身肝素化后,上下腔静脉及升主动脉远端分别插管,连接体外循环机,建立体外循环。人工阻断升主动脉血流后,在阻断钳近端升主动脉处插灌注针顺行灌注冷血心脏停搏液,心脏停搏满意后切开右心房、房间隔,显露二尖瓣和三尖瓣,行二尖瓣置换和/或三尖瓣成形术。瓣膜手术完成后结束体外循环,鱼精蛋白中和肝素,手术创面彻底止血后逐层关胸。术后患者送ICU监护,患者麻醉清醒前常规给呼吸机辅助呼吸,同时用血管活性药物维持血流动力学稳定。
1.3 观察指标 肺动脉收缩压(SPAP)、左室射血分数(LVEF)、主动脉阻断时间、心肺转流时间、术后机械通气时间、有效瓣口面积指数(iEOA)、自体血、血浆、红细胞悬液、氧合指数(OI)、白介素-6(IL-6)。
1.4 检测方法 (1)肺动脉收缩压测定:分别于手术前(T1)、术毕(T2)、术后24 h(T3)、术后72 h(T4)采用超声心动图连续多普勒三尖瓣反流压差法测定SPAP值。(2)氧合指数测定:分别于T1、T2、T3和T4时点从患者桡动脉分别抽取2 mL血液,行血气分析,计算OI值。(3)IL-6测定:分别于T1、T2、T3和T4时点从患者桡动脉分别抽取2 mL动脉血,用酶联免疫吸附试验法测定样本中的IL-6含量。由于体外循环血液稀释,采用校正公式予以校正,即校正值=测得值×转流前红细胞压积(HCT)/测定时HCT。
1.5 统计学方法 性别为计数资料,两组间比较用Pearson χ2检验;年龄、体质量指数、术前LVEF、体外循环时间、iEOA、术前SPAP 为计量资料,符合正态分布,以均数±标准差(±s)表示,两组间比较用t检验;阻断时间、自体血、机械辅助时间、输注的红细胞悬液和血浆量、IL-6 为计量资料,不符合正态分布,以中位数[M(P25,P75)]表示,两组间比较用秩和检验;肺动脉压、氧合指数为计量资料,符合正态分布,以均数±标准差(x-±s)表示,先行重复测量方差分析,若差异有统计学意义,则再行不同组同一时点两两比较,两组间比较采用t 检验。肺动脉压与氧合指数间关系采用Pearson 相关分析。采用SPSS21.0 统计软件,统计检验水准取α=0.05,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者术前一般资料比较 两组患者术前的年龄、性别、体质量指数、术前SPAP、术前LVEF值比较差异均无统计学意义(P>0.05),见表1。
表1 两组患者术前一般资料比较(±s)
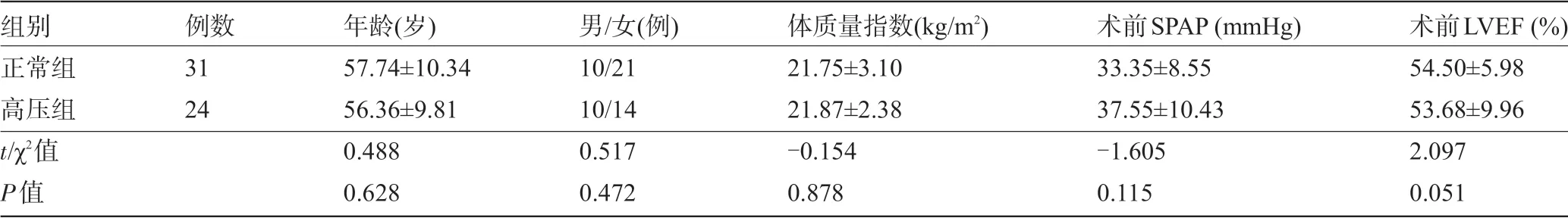
表1 两组患者术前一般资料比较(±s)
注:1 mmHg=0.133 kPa。
组别正常组高压组t/χ2值P值例数31 24年龄(岁)57.74±10.34 56.36±9.81 0.488 0.628男/女(例)10/21 10/14 0.517 0.472体质量指数(kg/m2)21.75±3.10 21.87±2.38-0.154 0.878术前SPAP(mmHg)33.35±8.55 37.55±10.43-1.605 0.115术前LVEF(%)54.50±5.98 53.68±9.96 2.097 0.051
2.2 两组患者术中观察指标比较 两组患者术中均无鱼精蛋白过敏反应,且自体血回输量比较差异也无统计学意义(P>0.05),但高压组患者的阻断时间和体外循环时间明显长于正常组,差异均有统计学意义(P<0.05),见表2。
2.3 两组患者术后观察指标比较 两组患者术后无死亡病例,无低心排和严重感染,术后补充红悬和血浆量比较差异无统计学意义(P>0.05)。两组患者二尖瓣人工瓣iEOA 无人工瓣膜P>患者-不匹配(PPM)现象(iEOA<1.2 cm2/m2定义为二尖瓣位出现PPM 现象)。两组间比较差异无统计学意义(P>0.05)。高压组术后机械辅助通气时间比正常组长6 h,两组间比较差异有统计学意义(P<0.05),见表3。
2.4 两组患者围术期肺动脉压比较 两组患者术前肺动脉压均小于65 mmHg,实验期间肺动脉压经重复测量方差分析显示,4个时点组内比较F=69.052,P=0.000,两组间比较F=19.529,P=0.000,因此肺动脉压组内、组间总体效应比较差异有统计学意义(P<0.05)。肺动脉压行单因素单独效应比较,术前肺动脉压两组间比较差异无统计学意义(P>0.05),但手术结束后两组患者的肺动脉压均比术前低,随后又逐渐升高,超过术前水平,术后24 h达到高峰,然后又逐渐下降,术后三个时点两组间比较差异均有统计学意义(P<0.05),见表4和图1。
表2 两组患者术中观察指标比较[±s,M(P25,P75)]

表2 两组患者术中观察指标比较[±s,M(P25,P75)]
组别正常组高压组t/Z值P值例数31 24阻断时间(min)91.00(68.00,134.00)117.50(83.75,158.50)-2.194 0.028体外循环时间(min)146.03±38.08 178.00±57.29-2.284 0.029自体血(mL)500.00(500.00,1 200.00)650.00(400.00,1 225.00)-0.247 0.805
表3 两组患者术后观察指标比较[±s,M(P25,P75)]
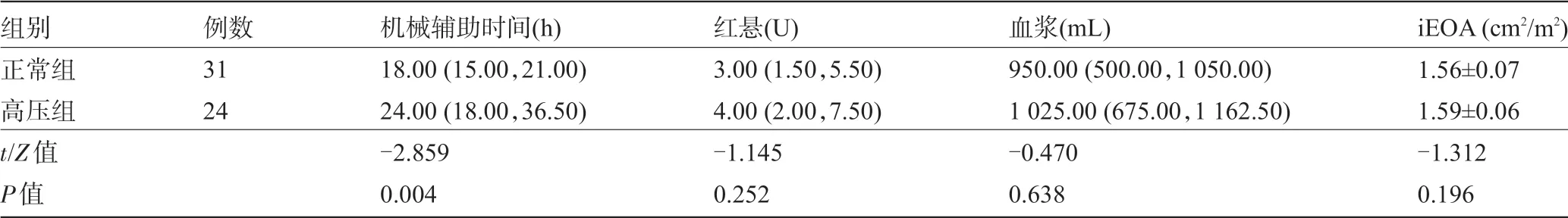
表3 两组患者术后观察指标比较[±s,M(P25,P75)]
组别正常组高压组t/Z值P值例数31 24机械辅助时间(h)18.00(15.00,21.00)24.00(18.00,36.50)-2.859 0.004红悬(U)3.00(1.50,5.50)4.00(2.00,7.50)-1.145 0.252血浆(mL)950.00(500.00,1 050.00)1 025.00(675.00,1 162.50)-0.470 0.638 iEOA(cm2/m2)1.56±0.07 1.59±0.06-1.312 0.196
表4 两组患者围术期不同时点的肺动脉压变化比较(±s,mmHg)
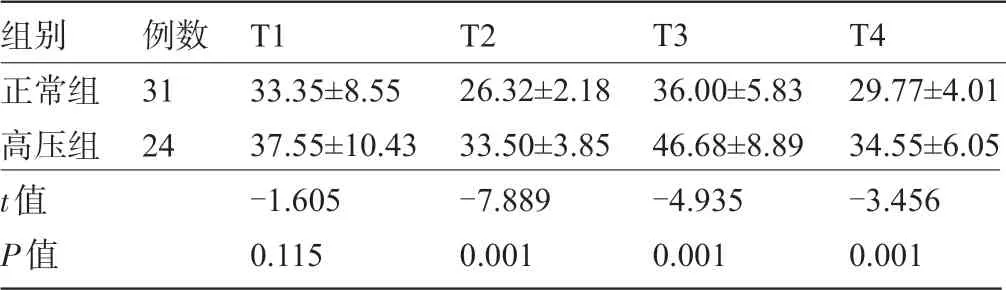
表4 两组患者围术期不同时点的肺动脉压变化比较(±s,mmHg)
组别正常组高压组t值P值例数31 24 T1 33.35±8.55 37.55±10.43-1.605 0.115 T2 26.32±2.18 33.50±3.85-7.889 0.001 T3 36.00±5.83 46.68±8.89-4.935 0.001 T4 29.77±4.01 34.55±6.05-3.456 0.001
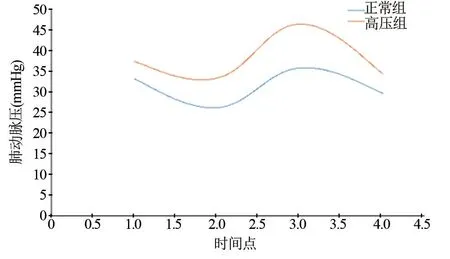
图1 两组患者围术期肺动脉压变化趋势图
2.5 两组患者围术期氧合指数比较 两组患者氧合指数经重复测量方差分析显示,4 个时点组内比较F=109.597,P=0.000,两组间比较F=12.648,P=0.001,因此氧合指数组内、组间总体效应比较差异有统计学意义(P<0.05)。氧合指数行单因素单独效应比较,两组患者术前氧合指数比较差异无统计学意义(P>0.05),但手术结束后两组患者的氧合指数逐渐降低,术后24 h 达到最低点,然后又逐渐上升,术后三个时点间比较差异均有统计学意义(P<0.05),见表5和图2。
表5 两组患者围术期不同时点的氧合指数比较(±s)
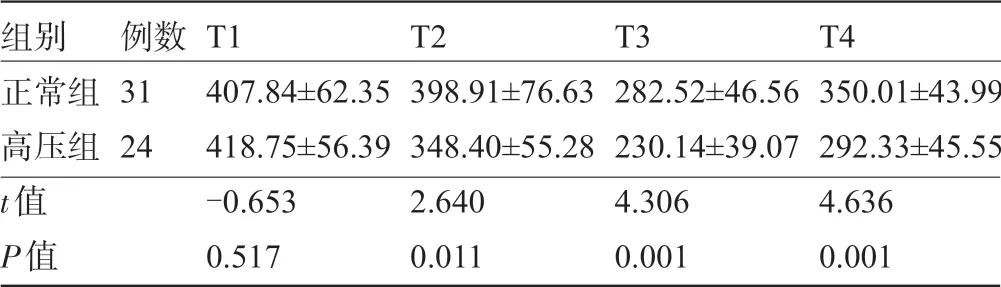
表5 两组患者围术期不同时点的氧合指数比较(±s)
组别正常组高压组t值P值例数31 24 T1 407.84±62.35 418.75±56.39-0.653 0.517 T2 398.91±76.63 348.40±55.28 2.640 0.011 T3 282.52±46.56 230.14±39.07 4.306 0.001 T4 350.01±43.99 292.33±45.55 4.636 0.001
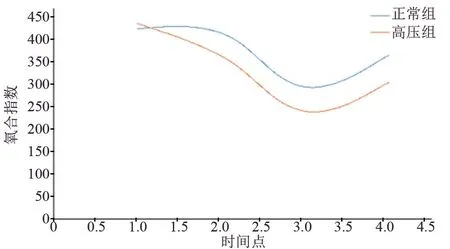
图2 两组患者围术期氧合指数变化趋势图
2.6 两组患者肺动脉压与氧合指数的相关性 两组患者术前肺动脉压与氧合指数做直线相关分析,相关系数为-0.036,P 值为0.798,两者间不呈相关关系,而T2、T3、T4 及术后3 个时点肺动脉压与氧合指数间呈负相关关系,相关系数分别为-0.279、-0.401、-0.281、-0.550,见表6。

表6 肺动脉压与氧合指数相关性
2.7 两组患者围术期不同时点的IL-6 水平比较 两组患者术前IL-6 比较差异无统计学意义(P>0.05),但手术结束后两组患者的IL-6 逐渐升高,术后24 h 达到最高值,正常组为术前的17.47 倍,而高压组为术前的25.49倍,然后又逐渐下降,术后72 h未降至正常值,术后三个时点间比较差异均有统计学意义(P<0.05),见表7和图3。
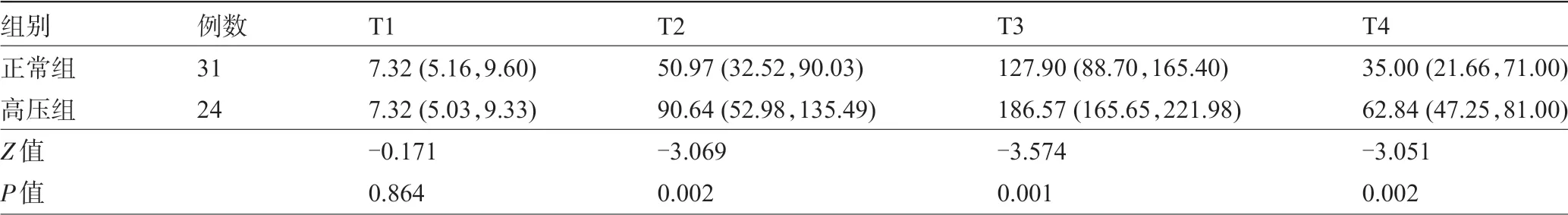
表7 两组患者围术期不同时点的IL-6水平比较[M(P25,P75),pg/mL]
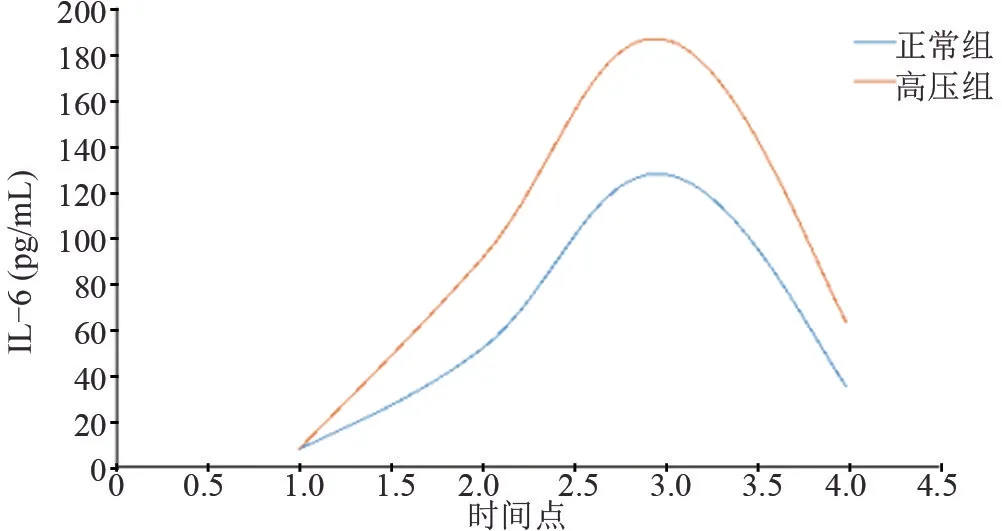
图3 两组患者围术期IL-6的变化趋势图
3 讨论
肺动脉高压(PH)是通过右心导管测的肺动脉平均压≥25 mmHg的血流动力学状态,其可出现于心脏瓣膜病患者自然病程的中后期阶段[7]。在自然病程中发生PH的机制为:狭窄和/或反流的二尖瓣导致前向血流动力学障碍,引起左房压增高、肺静脉瘀血,造成肺静脉压随之上升,随后顺次影响肺毛细血管床、肺动脉,出现肺血管反应性痉挛、压力升高;长时间过高的压力刺激导致肺动脉内皮细胞功能障碍,对一氧化氮利用率降低,而内皮素-1表达增加,神经激素上调,发生肺血管床不可逆的器质性重塑损伤改变,肺动脉压进一步升高[8-9]。因此,心脏瓣膜病患者自然病程早中期出现的肺动脉高压较多是由肺血管功能性改变所致,术前肺动脉高压程度较轻,而后期出现的肺动脉高压更多是由于肺血管器质性重塑损伤改变所致,术前肺动脉高压程度较重。CORCIOVA等[10]在有肺动脉高压的风心病患者中研究发现术前肺动脉压>65 mmHg对预测围手术期死亡率有最高特异度和敏感度,曲线下面积为0.782,同时术前肺动脉压>65 mmHg 患者呼吸机辅助时间更多超过24 h,更有可能出现呼吸系统并发症,ICU停留时间更长。目前国内外学者认为术前肺动脉压>65 mmHg患者肺动脉高压与肺血管床不可逆器质性重塑改变密切相关,解除前向血流动力学障碍的瓣膜手术对降低术前肺动脉压作用较小,而手术操作甚至加重其肺血管损伤,影响肺氧合,是围手术期患者出现呼吸系统并发症的预测指标[11]。然而,术前肺动脉压<65 mmHg的风心病患者围术期肺动脉压变化尚有争议,目前研究也不明确术前肺动脉压值与肺血管重塑损伤程度相关性以及对呼吸系统出现并发症的预测价值。
风心病患者术后肺动脉压值主要由三个因素确定:(1)手术前因素:长期瓣膜病变导致肺血管床发生器质性不可逆重塑程度;(2)手术因素:由体外循环因素引起的全身炎症反应,导致IL-6等细胞因子升高,出现肺血管内皮细胞功能障碍等[12-14];(3)手术后因素:人工瓣膜-患者-不匹配(PPM)现象—人工瓣膜的有效孔面积相对于患者的身体表面积过小,左心瘀血,肺动脉压力升高。本研究中所有风湿性二尖瓣病变患者术前肺动脉压均<65 mmHg,行瓣膜手术后出现术毕肺动脉压较术前下降,因此,术前肺动脉压<65 mmHg患者术前肺动脉压值部分是肺血管功能性改变所致,手术操作可降低其水平,术毕肺动脉压值才可反映肺血管重塑改变程度;两组患者iEOA 均>1.2 cm2/m2,未出现PPM 现象。IL-6 是由淋巴细胞、单核/巨噬细胞等产生的细胞因子,是反映全身炎性反应程度的良好生物学标志物[15]。本研究结果显示两组患者IL-6 术后均升高,术后24 h 达高峰,正常组为术前的17.47 倍,而高压组为术前的25.49倍,术后72 h未降至正常,而高压组IL-6升高比正常组多,其原因是高压组体外循环时间和阻断时间更长、产生更重的全身炎症反应综合征所致。围术期全身炎症反应综合征可造成风心病患者肺血管损伤加重,出现急性继发性肺动脉压不同程度升高,低消瓣膜手术降低肺静脉压所致肺动脉压下降的效果,甚至出现急性继发性肺动脉高压[16],但患者术后若未短时间内输入大量库血和发生低心排、严重感染,围术期急性肺血管损伤所致的继发性肺动脉压升高,又可随机体应激反映减退,肺动脉压值可逐渐降低。因此,本研究结果表明对于术前肺动脉压<65 mmHg的风心病患者术毕肺动脉压值在排除术前肺血管功能性改变与术后因素影响后出现下降,术毕肺动脉压值仅反映术前肺血管器质性重塑损伤和手术操作造成肺血管急性损伤的程度。术毕肺动脉压出现高压的患者肺血管损伤较重,其可作为短期内肺血管损伤程度的临床评估指标。
左心系统疾病所致的肺血管重塑损伤影响肺弥散功能和肺通气/血流比例[17]。体外循环的各种管道和氧合器等非生理性材料都是很强的外源性刺激因素,一方面引起凝血系统激活,形成微栓,阻塞肺毛细血管,另一方面又可刺激机体释放炎性介质,导致肺血管内皮损伤,两者最后造成肺泡萎陷不张、肺间质水肿、出血,最后影响肺的通气、换气功能[18]。因此,术前肺血管重塑损伤和手术操作引起的肺血管损伤均影响肺氧合、影响患者预后。OI 是评估肺通气、换气功能,反映肺泡与肺血管床的气体交换状态的常用临床指标,动态监测其变化可有效反映机体即时氧合情况,判断机体缺氧严重程度[19],但其无法反映短时间内肺氧合总体情况。本研究结果显示体外循环手术后两组患者OI 出现下降,术后24 h 达到最低值,随后逐渐恢复,术毕出现肺动脉高压的患者OI 下降更明显,恢复更慢,术后呼吸机辅助时间更长。对肺动脉压和OI间行相关分析显示术前的肺动脉压与OI间无相关关系,而术后三个时点,随肺动脉压值增高出现OI 下降,两者间呈负直线相关关系。本研究结果表明术前肺动脉压<65 mmHg的风心病患者术后肺动脉压值才能良好反映肺氧合情况,术毕出现肺动脉高压的患者肺氧合更差,出现呼吸系统并发症可能增加,而且其仅反映术前肺血管器质性重塑损伤和手术操作造成肺血管急性损伤的程度。因此,术毕肺动脉压值可较好地早期反映短时期内肺氧合总体情况。
总之,二尖瓣手术会出现肺动脉压降低,但由于体外循环炎症反应综合征影响又会出现短暂升高,术后肺动脉压值与OI呈负相关关系,术毕出现继发性肺动脉高压的患者肺氧合更差。因此,术毕肺动脉压值可作为早期评估围术期肺氧合总体情况的参考指标。
