方铅精矿中脉石成分在Na2CO3熔盐中的反应行为研究
2020-11-06胡宇杰陈艺锋王宇菲唐志波周正华夏中卫
胡宇杰,陈艺锋,王宇菲,唐志波,周正华,夏中卫
(1.湖南工业大学 冶金与材料工程学院,湖南 株洲 412007;2.株冶集团股份有限责任公司,湖南 株洲 412008)
1 研究背景
铅是重要的战略资源之一,其初级资源消耗主要集中在铅酸蓄电池、铅管、铅板、化工、焊料和合金等领域[1]。方铅精矿(硫化铅精矿)是原生铅冶炼的主要原料,方铅矿在天然矿床中常和闪锌矿(ZnS)紧密共生,主要伴生元素包括锌、铜、银、金、硫、铋及锑等[2]。当前,火法冶金仍然是原生铅冶炼的唯一工艺,其主要包括鼓风炉还原熔炼、富氧熔池氧化-还原熔炼和基夫赛特直接炼铅工艺等。这些工艺一般需要经历烧结焙烧、还原熔炼和炉渣烟化3个过程[3],操作温度均在1 473 K 以上,不仅能耗高、副产物处理工艺复杂[4-5],且不可避免存在着铅和铊等金属蒸气和粉尘的外逸,危害大气环境和人体健康。斯米尔洛夫完成了在773 K 左右NaOH 熔体中冶炼硫化铅精矿的工业试验后,发现低温碱性熔炼不产生SO2和铅蒸气,工作环境和周围环境大为改善[6]。为推广该工艺,国内学者徐盛明等[7]也曾开展过碱法直接炼铅研究,其工艺流程类似,只是增加了碱再生的工序,主要过程包括低温熔炼和碱的再生。该工艺在技术指标和环境效益方面优势明显,但由于NaOH 直接参与反应,导致固体烧碱再生难度大且成本增加。近几年来,中南大学又将低温碱性熔炼技术向前推进一步[8-11],将低温碱性炼铅扩展到锑铋的低温冶炼,并用苏打代替大部分或全部烧碱,且以ZnO 等亲硫金属氧化物作为固硫剂,大幅度降低了生产成本和熔盐再生量[12-15]。
但是,方铅矿的成分较为复杂,除主金属硫化铅外还包含杂质硫化物和脉石,其中脉石成分在精矿中的比例高达40%以上,其在熔炼过程中的行为还不清楚。因此,本文拟在热力学计算的基础上,研究方铅精矿中常见脉石成分SiO2、Al2O3、CaCO3和MgCO3等物质在Na2CO3熔盐体系中的反应行为。通过对脉石成分与熔盐的反应进行热力学分析,再通过单一脉石成分与熔盐反应产物的X 射线衍射(X-ray diffraction,XRD)表征结果,讨论在低温熔盐炼铅过程中,脉石成分可能发生的化学反应及其所得产物,以期为开发方铅精矿的低温清洁熔炼工艺提供一定的参考。
2 热力学分析
与传统的高温火法炼铅工艺(温度高于1 473 K)不同,低温熔盐炼铅过程中的熔炼温度一般控制在973~1 173 K。Na2CO3熔盐具有较强的碱性和化学活性,而脉石在原矿中的主要成分大多为酸性氧化物,因此在低温熔盐炼铅的反应体系中,脉石中的二氧化硅SiO2、碳酸钙CaCO3、氧化铝Al2O3及碳酸镁MgCO3等化合物可能参与如下反应:

在火法冶金过程中,预测反应过程的有效方法通常是反应的热力学分析,而反应的标准吉布斯自由能变化值(ΔGTθ)是判断反应自发进行方向及反应趋势的主要依据,其计算公式为

式中:ΔGTθ为反应标准吉布斯自由能变化值;
ΔHTθ和ΔH θ298分别为温度T(K)和298 K下的反应标准焓变;
ΔSTθ和ΔS θ298分别表示温度T(K)和298 K下的反应标准熵变;
ΔCp为反应热容变化值;
T为热力学温度。
本研究依据式(6)和Thermochemical Properties of Inorganic Substances数据库中的热力学数据,计算反应式(1)~(5)在700~1 300 K 温度范围内的反应的吉布斯自由能变化值(ΔGTθ),并绘制相关反应的ΔGTθ-T关系曲线,如图1所示。

图1 脉石组分参与反应的ΔGTθ与温度关系曲线Fig.1 ΔGTθ-T graphs of related reactions with gangue involved in the concentrates
由图1可以看出,反应式(1)和式(3)的吉布斯自由能值在温度900~1 150 K 区间都是负值,说明SiO2和Na2CO3反应生成Na2SiO3的可能性较大,而MgCO3在反应体系中很不稳定,容易热分解为MgO;反应式(2)的吉布斯自由能值在温度约为1 150 K时变为负值,此温度即为CaCO3发生热分解反应生成CaO的初始温度,这一结果说明在反应温度低于1 150 K时,CaCO3在体系中能稳定存在;Al2O3也会参与反应,产物可能是NaAlO2和Na2Al2O4,从热力学反应趋势看生成Na2Al2O4的可能性更大,其初始生成温度约为900 K,而NaAlO2则要在温度大于1 100 K 左右时才开始生成。
3 实验
本实验所用的Na2CO3、SiO2、CaCO3、MgCO3及Al2O3等物料均为分析纯,且所有物料在实验前均在150℃下的干燥箱中烘干处理24 h,然后装于干燥器中备用。
样品焙烧实验的设备是一台6 kW 通有氩气保护的管式电阻炉,反应器为刚玉坩埚,采用Rigaku 公司生产的TTR-Ш 型X 射线粉末衍射仪检测样品物相。首先,将Na2CO3分别与脉石成分按一定的比例进行配置,混合均匀后装入反应器中。然后将反应器送入管式电阻炉中,在一定温度下焙烧后,取出坩埚,并在室温下急冷,取样。最后,对反应完成后的样品进行XRD 物相检测,考察在不同温度下产物的变化情况,从而确定脉石成分与Na2CO3可能发生的化学反应及其产物。
4 实验结果分析与讨论
4.1 SiO2与Na2CO3的反应行为
将Na2CO3与SiO2按反应式(1),以物质的量之比为1:1 进行配置,混合均匀后,在通有氩气保护的管式电阻炉中将样品煅烧2 h,反应完成后对产物进行XRD 检测,考察在不同反应温度下产物的变化情况,所得结果如图2所示。
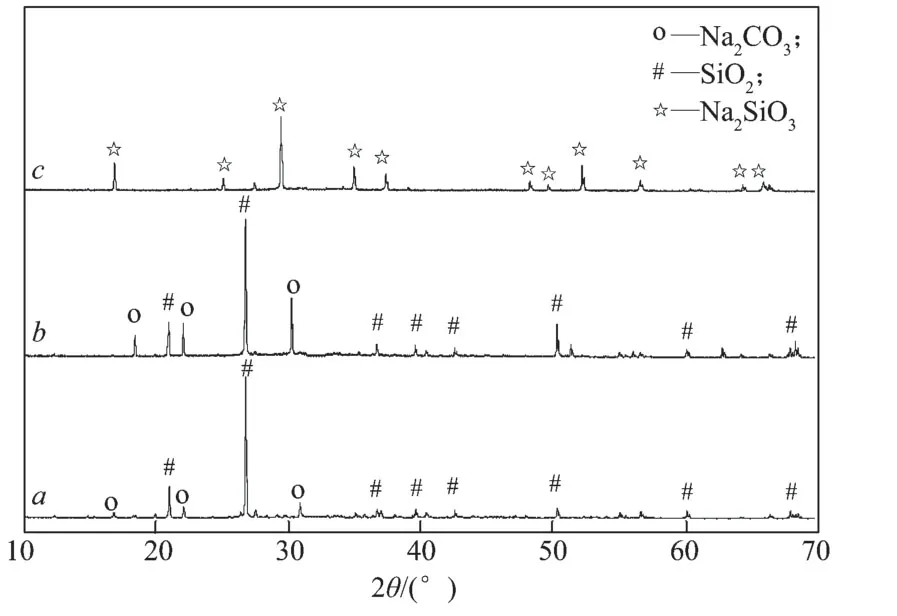
图2 SiO2与Na2CO3 在不同温度下的产物XRD 衍射图谱Fig.2 XRD patterns of SiO2 and Na2CO3 products at different temperatures
由图2可以看出,在反应温度低于1 123 K时,体系中混合物的物相成分基本上没有变化,全是SiO2和Na2CO3的衍射峰,说明SiO2没有与Na2CO3发生反应,均能稳定存在;当反应温度达到1 173 K时,SiO2和Na2CO3的衍射峰均完全消失,体系中几乎都是Na2SiO3的衍射峰,说明在该温度条件下,SiO2和Na2CO3发生了式(1)所示反应,全部生成Na2SiO3。因此,低温熔盐炼铅的反应温度宜控制在1 173 K 以下,以降低SiO2对熔盐的消耗。
4.2 CaCO3与Na2CO3的反应行为
将Na2CO3与CaCO3按物质的量之比为1:1 进行配置,混合均匀后,在通有氩气保护的管式电阻炉中将样品煅烧2 h,完成后对产物进行XRD 检测,考察在不同反应温度下产物的变化情况,所得结果如图3所示。

图3 CaCO3与Na2CO3 在不同温度下的产物XRD 衍射图谱Fig.3 XRD patterns of CaCO3 and Na2CO3 products at different temperatures
由图3可以看出,在温度为773 K时,体系中只有CaCO3和Na2CO3的衍射峰,没有出现新的物质,说明二者没有发生反应,均能稳定存在于体系中。当温度为923 K时,体系中增加了新的物相Na2Ca(CO3)2的衍射峰,该物相为CaCO3与Na2CO3结合而成的复合物。当温度升高到1 123 K时,体系中稳定存在的主要物相仍然是CaCO3、Na2CO3和Na2Ca(CO3)2,但Na2Ca(CO3)2的衍射峰相对减弱,说明该复合物在高温下并不能稳定存在。因此,在低温熔盐炼铅过程中,可以通过适当升高温度来抑制复合物Na2Ca(CO3)2的生成,以降低熔盐的消耗量。整个反应温度区间,没有出现CaO的衍射峰,说明CaCO3没有发生分解反应,因而不会参与传统火法炼铅过程中的造渣反应。
4.3 MgCO3与Na2CO3的反应行为
将Na2CO3与MgCO3按物质的量之比为1:1 进行配置,混合均匀后,在通有氩气保护的管式电阻炉中将样品煅烧2 h,完成后对产物进行XRD 检测,考察在不同反应温度下产物的变化情况,所得结果如图4所示。

图4 MgCO3与Na2CO3 在不同温度下的产物XRD 衍射图谱Fig.4 XRD patterns of MgCO3 and Na2CO3 products at different temperatures
由图4可看出,在温度分别为873 K和1 123 K时,体系中稳定存在的物相均是MgO和Na2CO3,说明MgCO3的热稳定性较差,在较低的温度下就会发生热分解反应,生成MgO。而MgO的热稳定性较好,在低于1 123 K的反应温度内不会和Na2CO3发生反应,能稳定存在于体系中。
4.4 Al2O3与Na2CO3的反应行为
由热力学分析可知,在低温熔盐炼铅的反应温度区间,Al2O3与Na2CO3反应生成Na2Al2O4的热力学趋势要远大于生成NaAlO2的。因此,本实验将Na2CO3与Al2O3按反应式(5)所示的物质的量之比为1:1 进行配置,混合均匀后,在通有氩气保护的管式电阻炉中将样品煅烧2 h。反应完成后,对产物进行XRD 检测,考察在不同反应温度下产物的变化情况,所得结果如图5所示。

图5 Al2O3与Na2CO3 在不同温度下的产物XRD 衍射图谱Fig.5 XRD patterns of the reactive products between Al2O3 and Na2CO3 at different temperature for 2 h
由图5可以看出,当温度为873 K时,体系中稳定存在的物相只有Al2O3与Na2CO3,说明二者没有发生化学反应;当温度升高到973 K时,体系中出现大量的Na2Al2O4的衍射峰,而Al2O3与Na2CO3的衍射峰则基本消失,且反应后的产物呈现玻璃态,结晶性变差,说明在该温度条件下,Al2O3与Na2CO3发生了反应式(5),全部生成了Na2Al2O4,这一实验结果与热力学分析结果一致。从反应动力学考虑,低温熔盐炼铅工艺的温度一般都要控制在1 073 K以上,且温度越高越有利于增加反应速度,提高生产效率,因此熔炼过程中不可避免地会生成Na2Al2O4,造成熔盐的消耗和损失。
5 结论
本文主要对Na2CO3熔盐与SiO2、CaCO3、MgCO3及Al2O3等脉石成分在不同温度下反应产物的物相进行了研究,结果表明:
1)SiO2在温度低于1 123 K时,不与熔盐发生反应,而当温度高于1 173 K时,则会和熔盐反应,生成Na2SiO3;
2)CaCO3在温度为1 173 K 以内不会发生热分解,但是当温度超过923 K时会和Na2CO3结合成Na2Ca(CO3)2,而Na2Ca(CO3)2在温度超过1 123 K时又会发生热分解;
3)MgCO3在较低的温度下就会发生热分解反应,生成MgO,而MgO 不会和Na2CO3发生反应,能稳定存在于体系中;
4)Al2O3与Na2CO3在温度超过973 K时会发生反应,生成铝酸钠。
基于以上结论,可知为控制脉石成分与熔盐的反应,降低熔盐的消耗,低温熔盐炼铅的温度宜控制在1 073~1 173 K。
本文的研究结果对于开发方铅精矿的低温清洁熔炼工艺有重要意义。
