miR-551b在甲状腺癌中的表达及对SW579细胞增殖和凋亡的影响
2020-11-06张双元
措 羊,张双元
(1青海省交通医院普外科,西宁 810000;2青海大学附属医院肿瘤外科)
甲状腺癌是一种内分泌系统常见的恶性肿瘤,恶性程度较低,在女性中发病率较高,流行病学研究显示,近30年来,其发病率一直呈上升趋势[1]。甲状腺癌的发病机制目前尚不明确,但随着分子生物学技术的不断发展,其病因、发生发展等方面的研究也在不断深入[2]。微小RNA(microRNA,miRNA)是在线虫研究中发现的一种高度保守的非编码小RNA分子,主要通过调控靶基因转录水平在生理、病理过程中发挥调控作用,是最近肿瘤研究领域的热点[3,4]。有研究证实,多个miRNA在甲状腺癌中表达异常,与甲状腺癌临床特征密切相关[5]。研究发现,miR-551b在胃癌组织中表达下降,能够抑制胃癌细胞的增殖、侵袭等细胞生物学功能,发挥类似抑癌基因的作用[6,7]。但miR-551b在甲状腺癌中的作用尚不清楚。本研究旨在探讨miR-551b在甲状腺癌中的表达及其对细胞增殖、凋亡的影响,以期为寻找甲状腺癌治疗的新靶点提供一定依据。
1 材料与方法
1.1 试剂与仪器
人甲状腺癌细胞SW579(货号:HZ-CC100702)购自美国ATCC细胞库;胎牛血清(货号:FBS500-S)购自澳大利亚AusGeneX公司;DMEM培养基(货号:KL-P0032)购自德国merck/sigma公司;Lipofectamine 2000转染试剂(货号:11668019)购自美国Invitrogen公司;CCK-8试剂(货号:CK-04)购自日本同仁化学研究所;Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(货号:S0185)购自哈尔滨新海基因检测有限公司;miRNA逆转录试剂盒(货号:QP013/QP014)购自美国GeneCopoeia;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒(货号:K1002S)购自美国Promega公司;nonsense siRNA、miR-551b siRNA、negative control-miR-551b、hsa-miR-551b mimic序列和miR-551b、U6引物均由生工生物工程(上海)股份有限公司合成;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、细胞周期蛋白D1(Cyclin D1)抗体、GAPDH抗体(货号:ab18197、ab53154、ab226977、ab181602)购自Abcam公司;辣根过氧化物酶标记的羊抗兔(货号:0295G-HRP)购自美国Santa公司;恒温培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司;荧光定量PCR仪(型号:ABI 7500)购自美国Applied Biosystems公司;流式细胞仪(型号:BD FACSCanto Ⅱ)购自美国BD公司;酶标仪(型号:MODEL550)、化学发光成像系统(型号:ChemiDocXRS)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 qRT-PCR法检测miR-551b在甲状腺癌中的表达情况 收集2017年10月至2019年10月本院获得的28例甲状腺癌组织及其癌旁正常组织标本,均经病理诊断确诊,标本获取均获得患者知情同意,且均于化放疗等治疗前经手术切除获得,保存于液氮中。所有手术标本的采集均取得本院伦理委员会批准。
使用TRIzol试剂提取组织中总RNA,经逆转录合成cDNA,参照qRT-PCR试剂盒说明配制反应体系,在荧光定量PCR仪上进行扩增,以2-ΔΔCt法表示miR-551b表达水平,Ct值为扩增产物的荧光信号达到临界阈值时对应的循环数,内参基因为U6。反应程序:95 ℃预变性10 min;95 ℃变性10 s,55 ℃退火35 s,72 ℃延伸1 min,循环40次。miR-551b逆转录颈环引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTGAAA-3′。miR-551b上游引物:5′-CTGAGCGACCCATACTTGG-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;内参U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.2 SW579细胞培养及分组 将SW579细胞培养于含10%胎牛血清DMEM培养基中,在37 ℃、5% CO2饱和湿度培养箱中培养至细胞融合率达到80%左右,用胰蛋白酶消化、传代培养。
取对数期SW579细胞,以1×105个/ml、100 μl/孔的密度接种于96孔培养板,分为对照组、siRNA NC组、miR-551b siRNA组、mimic NC组和miR-551b mimic组,其中对照组SW579细胞不进行转染,siRNA NC组、miR-551b siRNA组、mimic NC组和miR-551b mimic组SW579细胞使用Lipofectamine 2000转染试剂分别转染nonsense siRNA、miR-551b siRNA、negative control-miR-551b和hsa-miR-551b mimic,转染后培养48 h,收集细胞,qRT-PCR法检测各组SW579细胞中miR-551b表达情况。
1.2.3 CCK-8法检测各组SW579细胞增殖情况 经相应处理后,将SW579细胞培养48 h,加入CCK-8试剂后继续培养2 h,使用全自动酶标仪测定450 nm波长时各孔的吸光度(optical density,OD)值。
1.2.4 流式细胞仪检测各组SW579细胞凋亡情况 经相应处理后,将SW579细胞培养48 h,收集细胞,胰蛋白酶消化、PBS洗涤后,使用400 μl 1×结合缓冲液将SW579细胞调整成1×106个/ml的细胞悬浮液,按照Annexin Ⅴ-FITC/PI凋亡检测试剂盒操作说明书步骤,加入Annexin Ⅴ-FITC、PI各5 μl,避光孵育1 h,使用流式细胞仪检测细胞凋亡率。
1.2.5 流式细胞仪检测各组SW579细胞周期分布情况 经相应处理后,将SW579细胞培养48 h,收集细胞,PBS洗涤,用-20 ℃预冷的70%乙醇固定1 h,离心除去乙醇,PBS洗涤,用500 μl RNase/PI重悬细胞,避光染色20 min,使用流式细胞仪检测细胞周期分布情况,统计G0/G1期、S期、G2/M期细胞的百分比。
1.2.6 蛋白印迹(Western blot)法检测各组SW579细胞中PCNA、Bax、Cyclin D1蛋白表达情况 经相应处理后,将SW579细胞培养48 h,收集细胞,使用蛋白提取试剂盒提取各组细胞总蛋白,测定蛋白浓度并进行定量。SDS-PAGE电泳分离蛋白质,转至PVDF膜上,用含5%脱脂奶粉的TBST封闭1 h,分别加入PCNA抗体(1 ∶500)、Bax抗体(1 ∶500)、Cyclin D1抗体(1 ∶500)、GAPDH抗体(1 ∶500),4 ℃孵育过夜,TBST洗涤后加辣根过氧化物酶标记的羊抗兔二抗(1 ∶1 000),室温孵育1 h,ECL显色,凝胶成像分析仪采集图像并分析条带灰度,目的蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。
1.3 统计学分析

2 结果
2.1 miR-551b在甲状腺癌组织及癌旁正常组织中的表达
miR-551b在甲状腺癌组织及癌旁正常组织中的表达水平分别为0.73±0.09和1.02±0.14,甲状腺癌组织中miR-551b表达水平较癌旁正常组织显著降低(t=9.220,P<0.05)。
2.2 各组SW579细胞中miR-551b表达情况
对照组、siRNA NC组、mimic NC组间SW579细胞中miR-551b表达水平差异无统计学意义(P>0.05);与siRNA NC组相比,miR-551b siRNA组SW579细胞中miR-551b表达水平显著降低(P<0.05);与mimic NC组相比,miR-551b mimic组SW579细胞中miR-551b表达水平显著升高(P<0.05,见表1)。
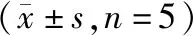
表1 各组SW579细胞中miR-551b表达水平比较
2.3 各组SW579细胞增殖情况
对照组、siRNA NC组、mimic NC组间SW579细胞OD值差异无统计学意义(P>0.05);与siRNA NC组相比,miR-551b siRNA组SW579细胞OD值显著升高(P<0.05);与mimic NC组相比,miR-551b mimic组SW579细胞OD值显著降低(P<0.05,见表2)。
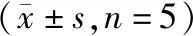
表2 各组SW579细胞OD值比较
2.4 各组SW579细胞凋亡情况
对照组、siRNA NC组、mimic NC组间SW579细胞凋亡率差异无统计学意义(P>0.05);与siRNA NC组相比,miR-551b siRNA组SW579细胞凋亡率显著降低(P<0.05);与mimic NC组相比,miR-551b mimic组SW579细胞凋亡率显著升高(P<0.05,见表3、图1)。
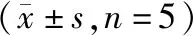
表3 各组SW579细胞凋亡率比较

图1 各组SW579细胞凋亡情况Figure 1 Apoptosis in each SW579 cells groups
2.5 各组SW579细胞周期分布情况
对照组、siRNA NC组、mimic NC组间G0/G1期、S期、G2/M期SW579细胞比例差异无统计学意义(P>0.05);与siRNA NC组相比,miR-551b siRNA组G0/G1期SW579细胞比例显著降低(P<0.05),S期、G2/M期SW579细胞比例显著升高(P<0.05);与mimic NC组相比,miR-551b mimic组G0/G1期SW579细胞比例显著升高(P<0.05),S期、G2/M期SW579细胞比例显著降低(P<0.05,见图2、表4)。

图2 各组SW579细胞周期分布情况Figure 2 Cell cycle distribution of SW579 cells in each group
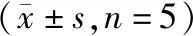
表4 各组SW579细胞周期分布情况比较
2.6 各组SW579细胞中PCNA、Bax、Cyclin D1蛋白表达情况
对照组、siRNA NC组、mimic NC组间SW579细胞中PCNA、Bax、Cyclin D1蛋白表达水平差异无统计学意义(P>0.05);与siRNA NC组相比,miR-551b siRNA组SW579细胞中PCNA、Cyclin D1蛋白表达水平显著升高(P<0.05),Bax蛋白表达水平显著降低(P<0.05);与mimic NC组相比,miR-551b mimic组SW579细胞中PCNA、Cyclin D1蛋白表达水平显著降低(P<0.05),Bax蛋白表达水平显著升高(P<0.05,见图3、表5)。

图3 各组SW579细胞中PCNA、Bax、Cyclin D1蛋白表达情况Figure 3 Expression of PCNA,Bax, Cyclin D1 proteins in SW579 cells in each group
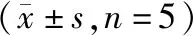
表5 各组SW579细胞中PCNA、Bax、Cyclin D1蛋白表达水平比较
3 讨论
miRNA是由20-22个核苷酸组成的、不编码蛋白质的小分子RNA,广泛存在于动植物体内,通过与靶基因mRNA的3′UTR互补匹配,影响靶基因的转录水平,参与调控个体发育、细胞增殖、凋亡、分化等一系列重要的生理过程[8]。虽然miRNA分子小、数量少,但能调控大量基因的表达,在肿瘤的发生、发展过程中发挥重要作用[9]。在甲状腺癌研究中,已有大量miRNA被发现在甲状腺癌中异常表达,参与甲状腺癌增殖、凋亡、迁移、侵袭等过程[10,11]。
miR-551b作为一种miRNA,有研究发现其与胃癌发生发展密切相关[12]。温馨等[13]研究表明,miR-551b-3p在胃癌组织中低表达,并且能够抑制胃癌细胞系HGC-27的增殖、迁移和侵袭。王娅南等[7]研究表明,miR-551b能够抑制胃癌细胞的增殖和侵袭等细胞生物学功能。除了胃癌,郭欣等[14]在胰腺癌研究中发现,miR-551b-3p在4种胰腺癌细胞中的相对表达量均低于正常胰腺导管上皮细胞,其在胰腺癌组织中的表达低于癌旁组织,且其表达与胰腺癌的分化程度、淋巴结转移以及TNM分期相关。然而,miR-551b在不同肿瘤中发挥的作用亦不同,在胃癌中发挥抑癌基因作用,在其他癌症中可能发挥促癌基因作用[15]。Wei等[16]研究表明,miR-551b可能通过抑制Foxo3和TRIM31这两个重要的肿瘤抑制因子,促进卵巢癌细胞、卵巢癌干细胞的增殖、侵袭及化学耐药性。Chaluvally-Raghavan等[17]研究表明,miR-551b-3p表达增加与高级别浆液性上皮性卵巢癌的预后恶化有关,其在体外和体内均有助于抵抗癌细胞的凋亡,增加癌细胞的存活和增殖,沉默其表达可抑制裸鼠卵巢癌肿瘤的生长。
本研究检测miR-551b在甲状腺癌组织与癌旁正常组织中的表达发现,miR-551b在甲状腺癌组织较癌旁正常组织中表达显著降低。体外细胞实验研究发现,与siRNA NC组相比,miR-551b siRNA组SW579细胞OD值显著升高,miR-551b表达水平、细胞凋亡率显著降低;与mimic NC组相比,miR-551b mimic组SW579细胞OD值显著降低,miR-551b表达水平、细胞凋亡率显著升高,这表明miR-551b在甲状腺癌中可能发挥抑癌基因作用,可以抑制SW579细胞增殖并诱导其凋亡。进一步研究发现,与siRNA NC组相比,miR-551b siRNA组G0/G1期SW579细胞比例显著降低,S期、G2/M期SW579细胞比例显著升高;与mimic NC组相比,miR-551b mimic组G0/G1期SW579细胞比例显著升高,S期、G2/M期SW579细胞比例显著降低,提示miR-551b可能通过抑制SW579细胞向S期、G2/M期进展,并将细胞周期阻滞于G0/G1期,从而发挥抑制SW579细胞增殖、促进细胞凋亡的作用。PCNA是增殖相关基因,在甲状腺癌增殖过程中发挥作用[18]。Bax是Bcl-2家族中的促凋亡成员,参与调控甲状腺癌细胞凋亡[19]。Cyclin D1参与细胞周期进展,进而参与细胞的增殖、凋亡过程[20]。本研究结果显示,与siRNA NC组相比,miR-551b siRNA组SW579细胞中PCNA、Cyclin D1蛋白水平显著升高,Bax蛋白水平显著降低;与mimic NC组相比,miR-551b mimic组SW579细胞中PCNA、Cyclin D1蛋白水平显著降低,Bax蛋白水平显著升高,提示miR-551b可能通过影响PCNA、Bax、Cyclin D1等表达参与对SW579细胞增殖、凋亡、细胞周期进展的调控。
综上所述,miR-551b在甲状腺癌组织中表达下调,可能通过将细胞周期阻滞于G0/G1期,抑制SW579细胞增殖并诱导其凋亡,有望成为甲状腺癌治疗的新靶点。
