牛星状病毒和牛诺如病毒双重PCR 检测方法的建立及应用
2020-11-05王文佳邓廷贤徐照学孟红丽王亚州兰亚莉师志海
王文佳,邓廷贤,徐照学,张 彬,孟红丽,王亚州,兰亚莉*,师志海*
(1. 河南牧业经济学院动物医药学院,河南 郑州 450046;2. 河南省农业科学院畜牧兽医研究所,河南 郑州 450002;3. 中国农业科学院水牛研究所,广西 南宁 530001)
星状病毒(Astrovirus,AstV)是单股正链无囊膜的RNA 病毒,有2 个病毒属:哺乳动物星状病毒属(Mamastrovirus)和禽星状病毒属(Avastrovirus),分别感染哺乳动物和禽类[1]。1978 年,在英国急性腹泻的犊牛粪便中首次发现牛星状病毒(Bovine astrovirus,BAstV)[2],随后,苏格兰[3]、日本[4]、加拿大[5]等也相继报道了BAstV。BAstV 感染会引起犊牛腹泻,且常与其它腹泻病原,如牛轮状病毒(Bovine rotavirus, BRoV), 牛 环 曲 病 毒(Bovine torovirus,BToV),尤其是牛诺如病毒(Bovine norovirus,BNoV)等共感染,增加疾病的严重性。近年来BAstV 感染可引起牛发生脑炎,出现神经性疾病[6],因此BAstV感染越来越受到重视。
BNoV 是杯状病毒科、诺如病毒属的单股正链RNA 病毒,是引起新生犊牛腹泻的主要病毒性病原之一[7]。1978 年,BNoV 在英国急性腹泻犊牛的粪便中首次被发现[2],我国于2017 年首次在腹泻犊牛粪便中检测出该病毒[8]。诺如病毒有6 个基因群[9],BNoV 属于GIII 群,其中BNoV 又细分为2 个基因型,分别是以Bo/Jena/80/DE 株为代表的基因1 型和以Bo/Newbury2/76/UK 株为代表的基因2 型[10],目前我国普遍流行的是基因1 型BNoV。BNoV 感染犊牛后常引起腹泻、厌食和消化不良,3 周龄犊牛比新生犊牛症状严重。我国对BAstV 和BNoV 的相关报道较少,另外二者在犊牛腹泻中的作用还存在争议,有待于更多的研究求证。因此,本研究建立了同时检测BAstV 和BNoV 的双重PCR 方法,并检测了采集自河南省规模化牛场的腹泻粪便样品,为BAstV和BNoV 的早期临床检测和流行病学调查提供了技术支持。
1 材料与方法
1.1 主要实验材料BNoV、BAstV、BToV、BRoV、牛冠状病毒(Bovine coronavirus,BCoV)、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、牛嵴病毒(BovineKobuvirus,BKoV)cDNA 均由本实验室鉴定保存;221 份粪便样品采集自2017 年9 月~2019年5 月采集自河南省规模化养牛场出现腹泻症状的犊牛,犊牛月龄均为3 月龄以下;全部样品单独分装,详细记录牛的品种、年龄、采样日期、样品数量等信息,用冰袋带回实验室立即检测,或置-80 ℃保存。
MiniBEST Viral RNA/DNA Extraction Kit、Prime-ScriptTMII1st Strand cDNA Synthesis Kit、克隆载体pMD18-T、大肠杆菌JM109 感受态细胞、2×Premix Taq、DL2000 DNA Marker 等购自TaKaRa 公司;胶回收试剂盒和质粒小提试剂盒购自OMEGA 公司。
1.2 引物设计与合成根据GenBank 登录的BAstV ORF1a 基因(KJ620980)和BNoV RdRp 基因(NC029645)的保守序列,利用oligo6.0 软件分别设计2 对引物,预期扩增BAstV 片段大小为376 bp,上游引物AF1:GCACGTTCGTCCTCGATGT/下游引物AR1:ATACGT TTGGCCTCGCTCACA;扩增BNoV 片段大小为542 bp,上游引物NF1:GGCAAACCACGCAAACAAC/下游引物NR1:CTTCCGAAAGGGCACAGA。引物由上海生工生物工程技术服务有限公司合成。
1.3 单一PCR 的扩增以BAstV 和BNoV 的cDNA为模板,分别进行各自单一PCR 扩增,扩增体系为20 μL:模板cDNA 2 μL,2×Premix Taq 10 μL,上、下游引物各1 μL(10 μmol/L),ddH2O 补足20 μL;扩增程序为:94 ℃5 min;94 ℃40 s、52 ℃40 s、72 ℃40 s,30 个循环;72 ℃5 min。扩增产物经1.0%琼脂糖凝胶电泳检测。
1.4 重组质粒标准品的构建与鉴定利用胶回收试剂盒分别回收1.3 中扩增的目的条带,克隆于pMD18-T载体,构建重组质粒pMD-BAstV 和pMD-BNoV,分别转化至E. coli JM109 感受态细胞,选取阳性克隆菌由上海生工生物工程技术服务有限公司测序。将测序正确的样品扩大培养后采用质粒提取试剂盒分别提取pMD-BAstV 和pMD-BNoV,用超微量核酸蛋白分析仪测定其浓度并换算为换贝数,分别作为双重PCR 反应的重组质粒标准品。
1.5 双重PCR 反应体系及条件的优化以pMDBAstV 和pMD-BNoV 的混合质粒为模板,采用方阵法分别对退火温度(50 ℃~55 ℃)、循环次数(25 次~35 次)、引物用量(0.2 μL~1 μL)、模板量(0.5 μL~4 μL)等进行优化,PCR 产物经1.0%琼脂糖凝胶电泳检测。
1.6 特异性试验以BRoV、BToV、BCoV、BVDV、BKoV 的cDNA 为模板,分别以重组质粒pMD-BAstV、pMD-BNoV 以及二者的混合物为阳性对照,以ddH2O 为阴性对照,利用本研究建立的双重PCR 方法进行检测,以评估该方法的特异性。
1.7 敏感性试验采用ddH2O 对pMD-BAstV、pMDBNoV 进行10 倍倍比稀释,利用已优化的双重PCR方法和单一PCR 方法分别进行检测,设ddH2O 为阴性对照,以确定该方法的敏感性。
1.8 重复性试验利用所建立的双重PCR 方法分别进行批内和批间试验。批内试验:以拷贝数分别为1.09×106拷贝/μL 的pMD-BAstV 和1.42×106拷贝/μL的pMD-BNoV 为模板,一次试验做4 个重复;批间试验:不同时间段分别从阳性克隆菌JM109 中提取pMD-BAstV、pMD-BNoV 两种重组质粒,同一实验条件下分别进行4 次试验。以此确定检测结果的可靠性和重复性。
1.9 临床样品的检测用PBS 按1∶10(w∶v)分别混悬221 份粪便样品,漩涡震荡,4 ℃8000 r/min 离心5 min,收获上清,利用MiniBEST Viral RNA/DNA Extraction Kit 提取病毒RNA,利用PrimeScriptTMII1st Strand cDNA Synthesis Kit 反转录获得cDNA,以其为模板,利用本研究建立的双重PCR 方法和单一PCR方法分别进行检测,比较两种方法的符合率,同时调查河南省腹泻犊牛BAstV 和BNoV 的感染情况。
2 结 果
2.1 重组质粒标准品的鉴定结果经测序鉴定正确的pMD-BAstV 和pMD-BNoV 重组质粒采用超微量核酸蛋白分析仪测定浓度分别为36.5 ng/mL 和50.3 ng/mL,经计算分别为1.09×1010拷贝/μL、1.42×1010拷贝/μL。
2.2 双重PCR 方法的构建及优化优化后的反应体系为20 μL:包括2×Premix Taq 10 μL,AF1、NF1 各0.5 μL(10 μmol/L),AR1、NR1 各0.5 μL(10 μmol/L),模板2 μL,ddH2O 补足20 μL;最佳反应条件为:94 ℃5 min;94 ℃30 s、52 ℃30 s、72 ℃40 s,30 个循环;72 ℃10 min。以pMD-BAstV 和pMD-BNoV 的混合重组质粒标准品、pMD-BAstV、pMD-BNoV 重组质粒标准品为模板,利用优化后的双重PCR 反应体系和条件进行扩增,以ddH2O 为阴性对照。结果显示,该方法可同时扩增出了约400 bp 和550 bp 的目的条带(图1),扩增的目的片段均经测序鉴定正确。表明本研究设计的引物能特异性地扩增出目的片段。

图1 双重PCR 扩增结果Fig.1 The amplification results of the duplex PCR
2.3 特异性试验结果利用已建立的双重PCR 反应方法对BRoV、BToV、BCoV、BVDV、BKoV 的cDNA 和重组质粒pMD-BAstV、pMD-BNoV 进行扩增,结果显示除重组质粒pMD-BAstV、pMD-BNoV 扩增出大小相符的目的片段外,其余病原均不能扩增出目的片段(图2),表明本研究建立的双重PCR 方法特异性强。

图2 双重PCR 方法的特异性试验结果Fig.2 Specificity assay of the duplex PCR
2.4 敏感性试验结果ddH2O pMD-BAstV 和pMDBNoV 重组质粒经10 倍倍比稀释(pMD-BAstV:1.09×107拷贝/μL~10.9 拷贝/μL;pMD-BNoV:1.42×107拷贝/μL~14.2 拷贝/μL)后作为模板,进行双重PCR 扩增。结果显示,该方法对BAstV 和BNoV 质粒标准品的检测下限分别为1.09×103拷贝/μL 和1.42×103拷贝/μL(图3),与单一PCR 方法对这两种质粒标准品的检测下限一致。表明本研究建立的双重PCR 方法敏感性高。

图3 双重PCR 方法的敏感性试验结果Fig.3 Sensitivityassay of the duplex PCR
2.5 重复性试验批内试验与批间试验结果均显示利用双重PCR 方法扩增出的条带亮度基本一致(图4),表明该方法具有良好的重复性。
2.6 临床样品检测利用本实验建立的双重PCR 方法与单一PCR 方法分别对221 份犊牛腹泻粪便样品进行检测,结果显示,BAstV 单一检出率为18.1%,BNoV 单一检出率为9.96%,BAstV 和BNoV 共感染的检出率为1.36%,表明河南省腹泻犊牛存在BAstV和BNoV 感染,且存在该两种病毒共同感染。将双重PCR 与单一PCR 对临床样品的检测结果进行对比分析,二者符合率为100%(表1);表明本研究所建立的双重PCR 方法可用于BAstV 和BNoV 感染的临床检测及疾病的流行病学调查。

图4 双重PCR 的重复性试验结果Fig.4 Repeatability assay of the duplex PCR
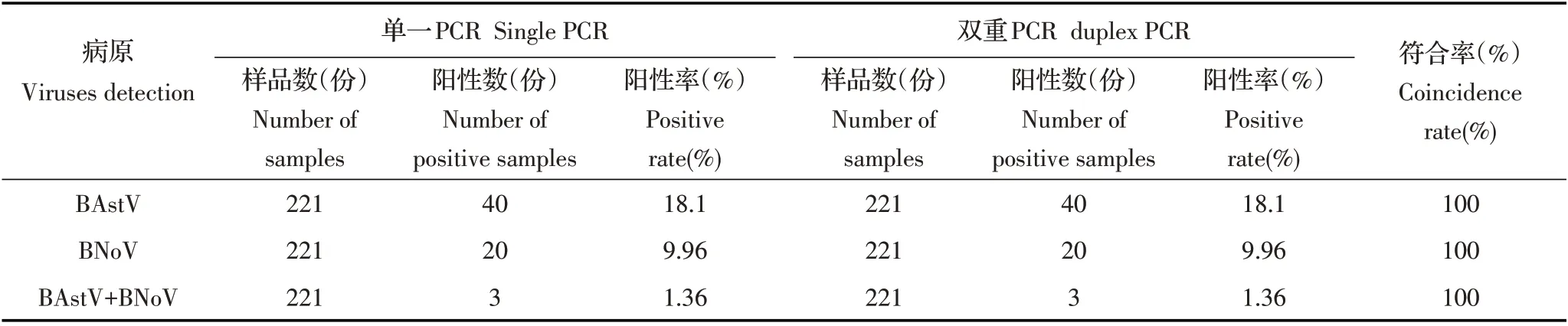
表1 临床样品的检测结果Table 1 Detection of clinical samples
3 讨 论
随着规模化养殖业的迅速发展,动物疫病流行方式也在发生变化,尤其是病原的混合感染愈发严重。近年来随着我国养牛业的迅猛发展,犊牛腹泻和牛呼吸道疾病综合征等病症也成为困扰养牛业的难题,这可能与病原的种类增加、新发病原感染率高、混合感染严重等因素有关。
犊牛腹泻是犊牛尤其是30 日龄以下犊牛最为严重的常见疾病,会引起犊牛死亡,犊牛生长发育延缓,母牛初产年龄增大,疾病治疗和护理成本增加,给牛养殖业带来严重经济损失。2007 年美国动物健康监测系统指出57%的断奶前犊牛死亡都是由犊牛腹泻引起,如韩国[11]和伊朗[12]。星状病毒和诺如病毒是引起食源性疾病的主要病原。BNoV 感染犊牛后,可引起犊牛急性、间歇性、持续性腹泻[13],严重者伴有肠上皮坏死和肠绒毛萎缩[14],并可长期通过粪便排毒。BAstV 感染犊牛后,通常不会引起犊牛发生严重腹泻,但高达60%~100%的犊牛常呈隐性感染且可长期带毒[15]。近年来星状病毒被发现与人类脑炎有关,BAstV 感染引起牛发生脑炎的病例也相继被报道[6,16],且存在星状病毒跨物种传播的可能[17],应该引起人们重视。
作为最具代表性的现代检测和诊断新技术,PCR 技术一直被广泛应用,并衍生出多重PCR 等技术。多重PCR 技术与单一PCR 技术相比,不仅极大地缩短了临床混合感染病例的鉴别和诊断时间,还省时、省力、经济,对临床检测和诊断具有极高实用价值[18]。而BAstV 和BNoV 均属于RNA 病毒,这为建立双重PCR 方法提供了便利。目前关于BNoV 的检测方法鲜有报道,而能够同时检测BAstV 和BNoV的方法国内尚无相关报道。本研究分别以BAstV ORF1a 基因和BNoV RdRp 基因为靶标,设计了两对特异性引物,并通过对PCR 扩增体系和条件的优化,在国内首次建立了针对该两种病毒的双重PCR方法。试验结果表明该方法具有较强的特异性、高敏感性和良好的重复性,临床应用也表明该方法同样适用于大规模的病毒检测。其中对河南省规模化牛场的腹泻粪便样品检测结果显示,BAstV 和BNoV在河南省的牛场中已经存在,且存在同一犊牛共同感染BAstV 和BNoV 的情况。
本研究建立的BAstV 和BNoV 的双重PCR 检测方法,为这两种病毒感染早期的临床诊断和流行病学调查提供了技术支持,对这两种病毒混合感染及生物学关系的进一步研究具有重要意义。
