金黄色葡萄球菌重组酶聚合酶扩增方法的建立
2020-11-05吴华华王锦鑫谷庆花司鑫鑫董井泉
吴华华,王锦鑫,谷庆花,孙 奥,司鑫鑫,董井泉
(江苏海洋大学江苏省海洋药物活性分子筛选重点实验室,江苏 连云港 222000)
金黄色葡萄球菌(Staphylococcus aureus),又称“嗜肉菌”,是仅次于大肠杆菌的人畜共患致病菌,可寄生于人和动物的皮肤、鼻腔、咽喉、肠胃、痈、化脓疮口中。其生存对环境要求不高,既能耐受80 ℃的高温也能存活于15%的NaCl 溶液中[1-2]。金黄色葡萄球菌污染肉、鱼、蛋类等食物和水、牛奶等饮品后,会引起严重感染,如:肺炎、伪膜性肠炎、心包炎、败血症、脓毒症等,甚至危害生命[3-4]。因此,建立快速、灵敏、特异的金黄色葡萄球菌检测方法对于人畜公共卫生和食品安全管理至关重要。
目前检测金黄色葡萄球菌的方法主要有金标准传统培养法、PCR 方法、环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)等[5-6]。但均存在耗时长,不能为感染者提供及时诊断等缺点。重组酶聚合酶等温扩增(Recombinase polymerase amplification,RPA)是一种能够在37 ℃~42 ℃恒温扩增的技术。它利用重组酶UvsX 打开DNA 分子的双链,并通过具有链置换活性的Bsu 聚合酶来扩增靶标DNA,约30 min 内就可获得大量的扩增产物[7]。该方法不依赖于昂贵的仪器,仅接近人体温度就可以进行目的基因的扩增,操作简单,不需要专业的技术人员。因此,特别适用于基层实验室和资源匮乏地区的检测要求。基于此,本研究根据金黄色葡萄球菌的nuc 基因保守序列设计特异性引物,建立了一种RPA 检测金黄色葡萄球菌的方法,为金黄色葡萄球菌快速检测提供可行技术手段。
1 材料与方法
1.1 菌株与检测样品金黄色萄球菌(ATCC 6538)、人葡萄球菌(CICC 23976)、沙门氏菌(ATCC 14028)、副溶血弧菌(ATCC 17802)、单增李斯特菌(ATCC 19115)、肠致病性大肠埃希氏菌(ATCC 43888)、创伤弧菌(ATCC 27562)均由武汉食品化妆品检验中心从ATCC 菌种保藏中心购买,并用于本研究。26 份纯牛奶购自当地超市;25 份猪肉样品购自当地农贸市场。
1.2 主要试剂TwistAmpTMDNA Amplication Kit 购自英国TwistDx 公司;MonPureTMGel&PCR Clean Kit 和MonTrackTMDL2000 Plus DNA Ladder 均购自江苏莫纳生物科技有限公司。
1.3 引物的设计与合成根据金黄色葡萄球菌耐热核酸酶nuc 基因(NZ_CP020020.1)的保守序列,结合RPA 的引物设计要求利用Primer 3.0 软件设计特异性引物:nuc-F:5'-ATCACAAACAGATAACGGCGTAAATAGA- 3'/nuc- R: 5'- TTCGTAAATGCACTTGCTT CAGGACCAT-3',预期扩增片段大小为246 bp。引物由通用生物(安徽)有限公司合成。
1.4 细菌培养和基因组DNA 提取挑取营养琼脂斜面金黄色葡萄球菌标准菌株(ATCC 6538)培养物接种到液体LB 培养基中,37 ℃振荡培养过夜,取1 mL 菌液涂布平板计数后,将菌液稀释至106cfu/mL,并置100 ℃裂解10 min,获得金黄色葡萄球菌的基因组DNA(106cfu/mL),-20 ℃冷冻保存备用。
1.5 RPA 反应体系和反应条件的优化根据Twist-Amp®Liquid DNA Amplification Kit 使 用 说 明,配 置RPA 反应体系:46.5 μL 反应混合物,1 μL 1.4 制备的模板和2.5 μL 280 mmol/L 醋酸镁。反应混合物包括25 μL 反应缓冲液(2×)、5 μL Basic e-mix(10×)、2.5 μL Core mix(20×)、nuc-F/nuc-R 引物(10 μmol/L)各2.4 μL 和9.2 μL 蒸馏水。将2.5 μL 280 mmol/L 乙酸镁和1 μL 模板加入反应管的盖子中。瞬时离心后,按照说明书推荐的反应条件,将反应混合物立即在37 ℃下孵育30 min 进行nuc 基因的RPA 扩增。采用方阵法确定RPA 反应的最佳反应温度(26 ℃、30 ℃、34 ℃、37 ℃、40 ℃、42 ℃、45 ℃),反应时间(5 min、10 min、15 min、20 min、25 min、30 min、35 min、40 min)。
1.6 RPA 的特异性试验将金黄色葡萄球菌、人葡萄球菌、沙门氏菌、副溶血弧菌、单增李斯特菌、肠致病性大肠埃希氏菌、创伤弧菌均在100 ℃裂解10 min,获得相应细菌的基因组DNA,以其为模板,按照优化的反应条件,进行RPA 扩增反应,以评估该方法的特异性。
1.7 RPA 检测金黄色葡萄球菌的灵敏度试验取1 mL 金黄色葡萄球菌菌液涂布平板计数后,依次10倍倍比稀释至107cfu/mL~101cfu/mL,并将菌液于100 ℃裂解10 min 提取其基因组DNA。以不同浓度的基因组DNA 为模板,采用优化的反应条件,进行金黄色葡萄球菌RPA 方法的灵敏度试验。
1.8 RPA 检测金黄色葡萄球菌人工污染牛奶样品的灵敏度试验从超市购买1 份纯牛奶,经国标培养法(GB4789.10-2016)检测无金黄色葡萄球菌污染。取1 mL 新鲜培养的金黄色葡萄球菌菌液(浓度为2×106cfu/mL)10 倍倍比稀释,取2×106cfu/mL~2×101cfu/mL 的菌液各1 mL,分别与1 mL 牛奶混匀,每个稀释度制备5 个平行样品,将污染的牛奶样品置于100 ℃孵育10 min,取1 μL 作为模板按照本研究建立的RPA 方法进行灵敏度试验。以未污染金黄色葡萄球菌的热失活牛奶作为阴性对照。
1.9 牛奶和肉制品的检测从超市购买5 种不同品牌的纯牛奶,每种品牌选取5 个不同生产批次,共计25 份牛奶样品。每份样品取1 mL 置于100 ℃孵育10 min 后,取1 μL 作为模板按照本研究建立的RPA方法检测。同时利用国标培养法(GB4789.10-2016)对未热失活处理的牛奶样品进行细菌的分离鉴定;从农贸市场购买25 份猪肉样品,每份猪肉样品取30 mg 研磨成糜状后,使用基因组DNA 提取试剂盒提取其总DNA,取1 μL 作为模板按照本研究建立的RPA 方法检测。同时利用国标培养法(GB4789.10-2016)对猪肉样品进行鉴定[8]。比较两种方法的检测结果,并计算二者的符合率。
2 结 果
2.1 金黄色葡萄球菌nuc基因RPA 扩增结果利用特异性的nuc 基因RPA 引物,以金黄色葡萄球菌的基因组DNA 为模板,扩增金黄色葡萄球菌nuc 基因。结果显示,得到一条246 bp 的目的条带,与预期大小一致(图1)。表明特异性RPA 引物nuc-F/nuc-R 可用于检测金黄色葡萄球菌。
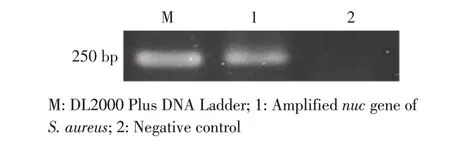
图1 金黄色葡萄球菌nuc 基因的RPA 扩增结果Fig.1 Amplification results of Staphylococcus aureus targe gene using RPA
2.2 RPA 反应温度与反应时间的优化结果采用方阵法进行最适反应温度、反应时间的筛选。结果显示:不同的温度经RPA 均可获得目的产物,且扩增产物产量随着温度升高先增加后减少,而当温度在37 ℃时扩增产量最多,因此,该反应体系的最佳反应温度为37 ℃(图2);将RPA 反应体系在37 ℃孵育15 min~40 min 均可以获得目的产物,其中,孵育15 min 时扩增条带较暗,但随着反应时间的延长扩增条带逐渐变亮,而扩增时间为35 min 时扩增条带最亮(图3),因此RPA 最佳反应时间为35 min。
2.3 RPA 的特异性试验结果利用已优化好的RPA 反应条件分别对金黄色葡萄球菌、人葡萄球菌、沙门氏菌、副溶血弧菌、单增李斯特菌、肠致病性大肠埃希氏菌、创伤弧菌7 种常见食源性致病菌的DNA 进行检测,结果显示仅金黄色葡萄球菌扩增得到目的产物,其它致病菌均无扩增条带(图4)。表明本研究建立的金黄色葡萄球菌RPA 检测方法特异性较强。

图2 RPA 反应温度的优化结果Fig.2 Optimization of amplification temperature
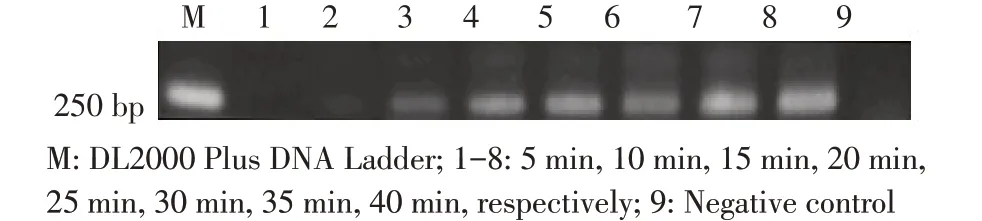
图3 反应时间的优化结果Fig.3 Optimization of amplification time

图4 RPA 的特异性试验结果Fig.4 Specificity test of RPA among different species
2.4 RPA 检测金黄色葡萄球菌的灵敏度试验结果依次以1 μL 浓度分别为101cfu/mL~107cfu/mL 的金黄色葡萄球菌基因组DNA 为模板,即每个RPA 反应分别加入10-2cfu、10-1cfu、100cfu、101cfu、102cfu、103cfu、104cfu 的模板,进行RPA 方法的灵敏度检测。结果显示该方法对金黄色葡萄球菌的最低检出限为10 cfu(图5),表明本研究建立的金黄色葡萄球菌RPA 方法敏感性较高。

图5 RPA 的灵敏度试验结果Fig.5 Sensitivity test of RPA
2.5 RPA 检测金黄色葡萄球菌人工污染牛奶样品的灵敏度试验结果将终浓度为106cfu/mL~101cfu/mL的金黄色葡萄球菌人工污染的牛奶样品经热失活后,取1 μL 作为模板即每个反应中加入污染金黄色葡萄球菌浓度为103cfu~10-2cfu,经本研究建立的RPA 方法进行灵敏度检测。结果显示:污染103cfu~101cfu金黄色葡萄球菌的牛奶样品经RPA 方法检测结果均为阳性,而污染100cfu~10-2cfu 金黄色葡萄球菌的牛奶样品经RPA 方法检测结果均为阴性(图6),表明该方法对人工污染金黄色葡萄球菌牛奶的最低检出限为10 cfu。

图6 RPA 检测污染金黄色葡萄球菌的牛奶样品灵敏度试验结果Fig.6 Sensitivity test of RPA using milk samplescontaminated with S.aureus
2.6 牛奶和肉制品的检测结果利用本研究建立的
RPA 方法分别对25 份牛奶样品和25 份猪肉样品的DNA 进行检测。结果显示:牛奶样品检测结果均为阴性,猪肉样品有24 份阴性和1 份阳性。上述结果和两种样品的国标培养法检测结果均一致。表明本研究建立的金黄色葡萄球菌RPA 检测方法可以用于乳制品和肉制品中金黄色葡萄球菌的检测。
3 讨 论
快速、准确、简单的检测技术对于食源性致病菌的监控尤为重要[9]。为控制金黄色葡萄球菌带来的危害和应对该菌引起食物中毒的突发事件,密切监测和快速检测金黄色葡萄球菌的方法的建立对人畜安全尤为重要。
目前检测金黄色葡萄球菌的方法主要有传统培养法、免疫学方法、PCR 法和LAMP 等[10-11]。李苗云等基于金黄色葡萄球菌nuc 基因建立了该菌的Taq-Man 荧光定量PCR 检测方法[12];荣蓉等基于nuc 基因保守序列同一目的片段设计了4 条引物,建立了检测实验动物金黄色葡萄球菌的LAMP 方法[13]。但这些方法均存在耗时长、依赖于昂贵的仪器设备和专业的技术人员、引物设计复杂、容易出现假阳性等缺点,不能满足基层医疗组织和资源匮乏地区的检测要求。
而RPA 技术是一种能够在常温扩增的分子诊断方法。该方法不依赖于昂贵的仪器设备和专业操作人员,只需在37~42 ℃反应15 min~40 min 即可获得大量的扩增产物。该方法简单易行,为基层医疗组织和资源匮乏地区快速、有效的检测病原菌提供了可能。刘立兵等利用荧光重组酶聚合酶方法快速检测志贺氏菌[14];Ren 等建立了检测布鲁氏菌的RPA 方法[15];Gao 等建立了快速检测单增李斯特菌的RPA 方法[16]。本研究基于金黄色葡萄球菌耐热核酸酶nuc 基因的保守区设计RPA 引物,对金黄色葡萄球菌进行了RPA扩增,并对反应时间(5 min~40 min)和反应温度(26 ℃~45 ℃)进行了优化。结果显示温度为37 ℃反应35 min 时扩增条带最亮,与RPA 体系中酶的最佳反应温度(37 ℃~39 ℃)一致。此外,该方法与人金黄色葡萄球菌、沙门氏菌、副溶血弧菌、单增李斯特菌、肠致病性埃希氏菌、创伤弧菌均不会出现交叉反应,表明其具有较强的特异性。该方法能够检测到低至10 cfu 的金黄色葡萄球菌,是已报道的常规PCR 检测方法灵敏度的50 倍[17]。金黄色葡萄球菌在乳制品、肉制品中较为常见[18-19],因此本研究将金黄色葡萄球菌污染牛奶样品,通过高温裂解制备模板后,利用建立的RPA 方法检测,结果获得了与检测纯菌液一致的灵敏度,即均为10 cfu。表明该方法可以在一定程度上耐受粗制模板(煮沸法获得细菌基因组),而不会影响其灵敏度。利用该RPA 方法检测购买的牛奶和猪肉样品,结果与国标培养法获得了一致的检测结果。表明本研究建立的金黄色葡萄球菌RPA 检测方法准确性较高,可以用于乳制品和肉制品中金黄色葡萄球菌的检测。
本研究建立的基于RPA 技术检测金黄色葡萄球菌的方法具有特异性强、灵敏度高、反应时间短和操作简单等优点,且具有很好的实际应用价值,为基层医疗组织和资源匮乏地区检测金黄色葡萄球菌提供了新的检测手段。
