黄芪总黄酮对巨噬细胞RAW264.7 抗炎免疫的双向调节研究
2020-11-05周鸿缘葛冰洁李海涛张雪梅
王 萌,郭 泽,周鸿缘,葛冰洁,王 政,李海涛,2*,张雪梅*
(1. 延边大学农学院动物医学系,吉林 延吉 133002;2. 中国农业科学院特产研究所,吉林 长春 130112)
炎症是机体免疫系统受到外界致病因素刺激后发生的一种复杂防御反应[1-2]。炎症具有两面性:适度的炎症反应能够刺激机体免疫系统、促进免疫细胞增殖活化、加快损伤修复等,益于机体机能的增强。而过度的炎症反应则会造成机体免疫系统功能紊乱[3],给机体带来损害,甚至可使机体器官衰竭导致死亡[4]。所以炎症和免疫反应二者是相互关联的过程,参与炎症反应的细胞因子、发生作用的机制通常都要受到机体免疫机制的调控。巨噬细胞(Macrophages,Mφ)是遍及机体血液、淋巴和组织中的一种免疫效应细胞[5],其作为免疫系统的重要效应细胞,在宿主免疫应答和宿主防御多种病原的感染中发挥着重要作用。其一方面具有抗原递呈、吞噬病原体、分泌多种细胞因子、激活免疫反应等生物学活性,另一方面通过释放各种炎症因子、参与炎症级联反应,加剧炎症的发生[6-8]。因此,巨噬细胞被认为是多种免疫调节和抗炎药物的靶细胞。
目前临床上采用的抗炎药物多为西药,其副作用大,易产生抗药性、药物依赖性、损害机体功能等不良反应。而中药具有低毒低耐药性、药食同兼、应用灵活等优势,越来越被现代医学所认可。黄芪是临床上常见的一味传统中药,药理学研究表明,黄芪具有保护肝脏、利尿、增强机体免疫、降低血压、降糖降脂、抗菌抗炎、抗氧化和抗肿瘤等作用。黄芪化学成分丰富,含黄芪多糖类、黄酮类、皂苷类、氨基酸、亚油酸、香草酸、硒、铁、锌等多种微量元素,其中黄芪总黄酮(Total flavonoids of Astragalus,TFA)是黄芪的主要活性成分,具有明显的抗肿瘤、抗损伤、抗突变和抗炎等作用[9]。本实验室的研究已表明,TFA 具有一定的体内抗炎免疫调节作用[10-11],但其体外抗炎免疫作用及其机制还不清楚。因此,本实验以TFA 为研究对象,以正常培养和LPS 刺激的巨噬细胞RAW264.7 为体外模型,研究TFA 的体外抗炎免疫双向调节作用及其作用机制,旨在为TFA 的临床应用提供参考依据和抗炎免疫药物的研发奠定基础。
1 材料与方法
1.1 主要实验材料TFA(纯度≥98%)购自南京泽朗公司;小鼠单核巨噬细胞RAW264.7 购自上海细胞库;MTT、LPS 购自Sigma 公司;FBS、DMEM 购自Gibco 公司;细胞因子ELISA 检测试剂盒购自Biovision 公司;TRIzol 试剂购自Invitrogen 公司;Prime-ScriptTMRT-PCR Kit 购自宝生物公司;浆蛋白、核蛋白提取试剂盒购自索莱宝公司;蛋白裂解液、BCA购自碧云天生物研究所;引物由Invitrogen 公司合成;鼠抗人IκBα、p-IκBα、IKKα/β、p-IKKα/β、C-NF-κB p65、N-NF-κB p65、β-Actin 等单克隆抗体(MAb)以及HRP 标记的山羊抗鼠IgG 等均购自CST 公司。
1.2 TFA 安全剂量的筛选将RAW264.7 细胞接种于96 孔培养板,12 h 后分别加入0、10 μg/mL、20 μg/mL、 50 μg/mL、 100 μg/mL、 150 μg/mL、200 μg/mL TFA,每组设5 个复孔,37 ℃孵育24 h,按20 μL/孔加入MTT,继续培养4 h 后,加入150 μL DMSO,振荡10 min,测定各组细胞的OD570nm值,计算细胞存活率:细胞存活率=(试验组OD570nm值-调零组OD570nm值)/(对照组OD570nm值-调零组OD570nm值)。进而筛选TFA 对RAW264.7 细胞的安全剂量用于后续试验。
1.3 细胞因子IL-1β、IL-6 和TNF-α含量的测定分别按正常培养的RAW264.7 细胞和LPS 刺激的RAW264.7 细胞分组。正常培养条件下RAW264.7 细胞的药物处理和分组:取对数生长期细胞,分别加入10 μg/mL、25 μg/mL、100 μg/mL TFA 作用12 h 后分别取细胞上清液,同时设未加TFA 的细胞作为对照组;LPS 刺激的RAW264.7 细胞药物处理和分组:取对数生长期细胞,分别加入10 μg/mL、25 μg/mL、100 μg/mL TFA培养1 h后,分别加入终浓度为1 μg/mL的LPS 刺激,同时设1 μg/mL LPS 刺激的RAW264.7细胞作为LPS 刺激组,设未加TFA 的细胞为对照组。加入LPS 刺激12 h 后取细胞上清液,利用ELISA 试剂盒分别测定不同浓度的TFA 对正常培养和经LPS 刺激的RAW264.7 细胞上清液中IL-1β、IL-6 和TNF-α 分泌水平。
1.4 细胞因子IL-1β、IL-6 和TNF-αmRNA 转录水平的检测按照1.3 进行试验分组与给药,12 h 后以TRIzol 法提取各组RAW264.7 细胞总RNA,测得RNA 纯度与浓度后,反转录为cDNA,以其为模板,利用表1 中的引物,PCR 扩增各组细胞中的细胞因子基因。PCR 产物通过琼脂糖凝胶电泳成像,经Quantity one 软件进行条带灰度分析,检测不同浓度的TFA 对正常培养和LPS 刺激的RAW264.7 细胞中IL-1β、IL-6 和TNF-α 转录水平。
1.5 NF-κB 信号通路关键蛋白表达的检测按照1.3 试验分组与给药,12 h 后经RIPA 裂解液裂解各组细胞后,采用各蛋白提取试剂提取各组RAW264.7 细胞的总蛋白、浆蛋白和核蛋白,经BCA法检测各蛋白浓度后,分别以鼠抗人IKKα/β(1∶750)、p-IKKα/β(1∶1 000)、IκBα(1∶1 000)、p-IκBα(1∶1 000)、C-NF-κB p65(1∶1 000)、NNF-κB p65(1∶1 000)和β-actin(1∶1 000)MAb 为一抗,山羊抗鼠HRP-IgG(1∶1 000)为二抗,western blot 检测各组RAW264.7 细胞NF-κB 信号通路关键蛋白IKKα/β、p-IKKα/β、IκBα、p-IκBα、C-NF-κB p65 和N-NF-κB p65 的表达。
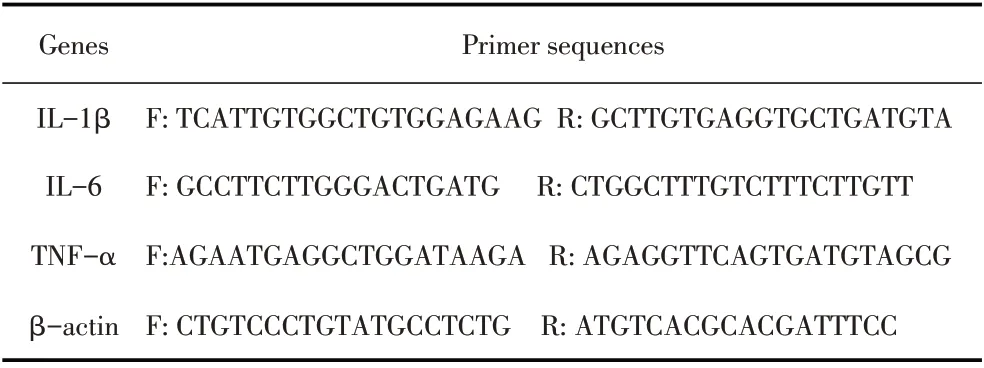
表1 扩增各细胞因子的引物序列Table 1 Primer sequences of cytokines
1.6 数据统计处理实验数据以平均数±标准差(±s)表示,采用SPSS 20.0 统计学软件分析各组数据,经Dunnet’s t-test 检验法进行组间数据差异比较,多组比较采用方差分析,p<0.05 表示具有统计学意义。
2 结 果
2.1 TFA 的安全剂量的筛选结果设7 个TFA 浓度分别作用RAW264.7 细胞24 h,经MTT 法检测细胞活力并根据公式计算各组细胞的存活率。计算结果显示,7 个浓度TFA(0、10 μg/mL、20 μg/mL、50 μg/mL、100 μg/mL、150 μg/mL、200 μg/mL)作用后的RAW 264.7 细胞的存活率分别是100%、102.03%、102.89%、101.15%、98.26%、91.01%和83.18%。0~150 μg/mL TFA 作用细胞的存活率与未加TFA 的空白对照组相比无显著差异(p>0.05);200 μg/mL TFA 作用细胞的存活率与空白对照组相比差异显著(p<0.05)(图1)。表明TFA在0~150 μg/mL对细胞无明显毒性作用,所以本实验选用10 μg/mL、25 μg/mL、100 μg/mL浓度的TFA 进行后续试验。
2.2 TFA 对正常培养的RAW264.7 细胞中IL-1β、IL-6和TNF-α含量影响的检测结果以不同浓度TFA作用12 h 后取正常培养的RAW264.7 细胞上清液,采用相应ELISA 试剂盒检测各细胞因子的含量。结果显示,与未加TFA 的对照组相比,10 μg/mL TFA 极显著增加了细胞因子IL-1β、IL-6 及TNF-α 的分泌量(p<0.01),25 μg/mL 和100 μg/mL TFA 也增加了细胞因子的分泌,但作用均不显著(图2)。表明TFA 可以刺激正常培养的RAW264.7 细胞中细胞因子IL-1β、IL-6 和TNF-α 的分泌,且以10 μg/mL 剂量为最优。
2.3 TFA 对LPS 刺激的RAW264.7 细胞各细胞因子含量影响的检测结果加入不同浓度TFA,再经1 μg/mL LPS 刺激12 h 后取RAW264.7 细胞上清液,采用相应ELISA 试剂盒检测各细胞因子的含量。结果显示,与空白对照组相比,LPS 刺激急剧升高了IL-1β、IL-6 及TNF-α 的含量(p<0.01),而25 μg/mL 和100 μg/mL TFA 显著和极显著降低了LPS 刺激引起的IL-1β 含量升高(p<0.05;p<0.01);各剂量TFA 显著和极显著降低了LPS 刺激引起的IL-6 含量升高(p<0.05;p<0.01);各剂量TFA 极显著降低了LPS 刺激引起的TNF-α 含量升高(p<0.01),且呈一定的剂量依赖关系(图3)。表明各剂量TFA 均能够明显抑制LPS 刺激的RAW264.7 细胞过度释放IL-1β、IL-6 及TNF-α。
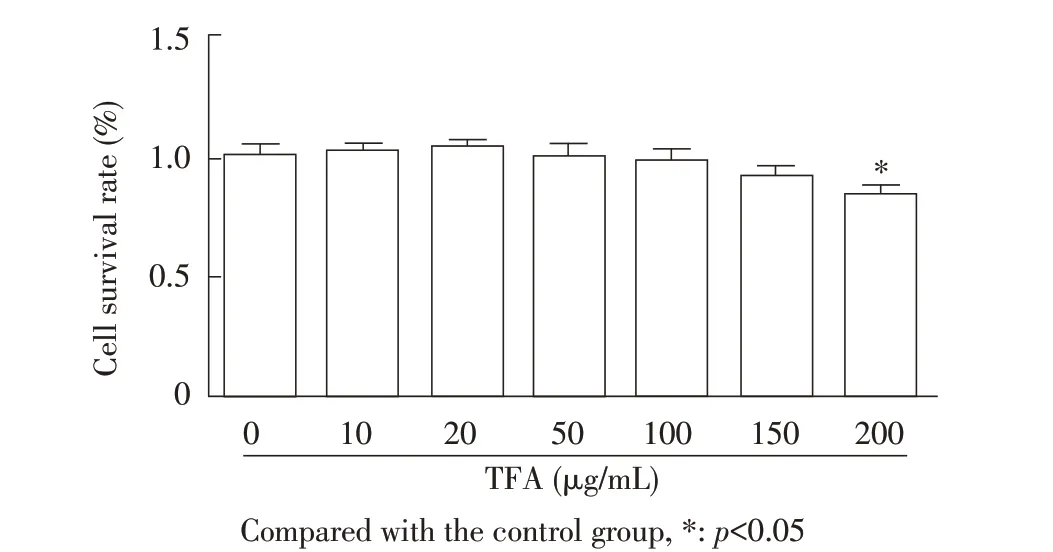
图1 不同浓度TFA 对RAW264.7 细胞活性影响的检测结果Fig.1 Cytotoxicity of TFA at different concentrations on RAW264.7 cell
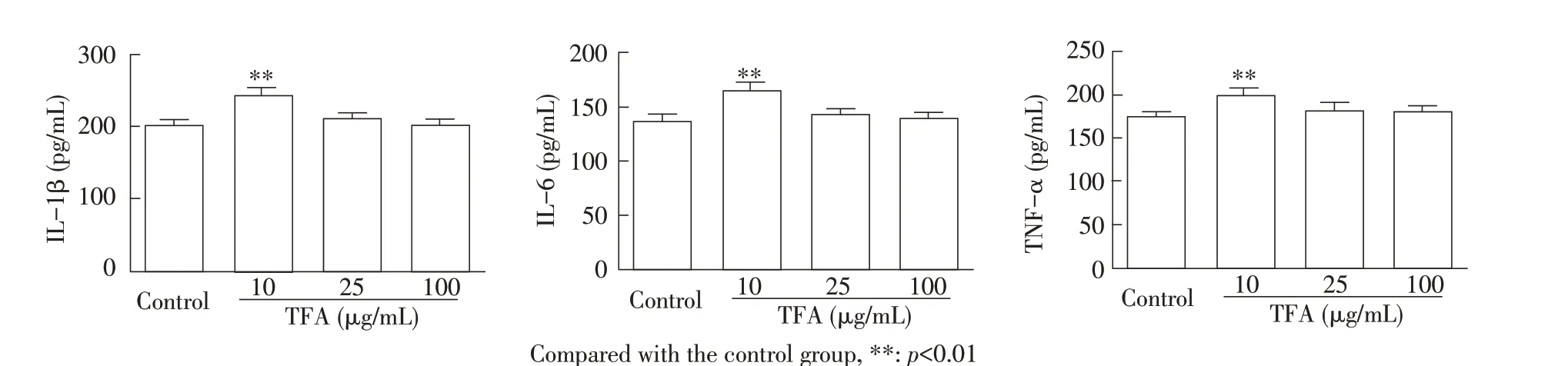
图2 TFA 对正常培养的RAW264.7 细胞IL-1β、IL-6 和TNF-α 含量影响的检测结果Fig.2 Effects of TFA on the production of IL-1β,IL-6 and TNF-α in RAW264.7 cells
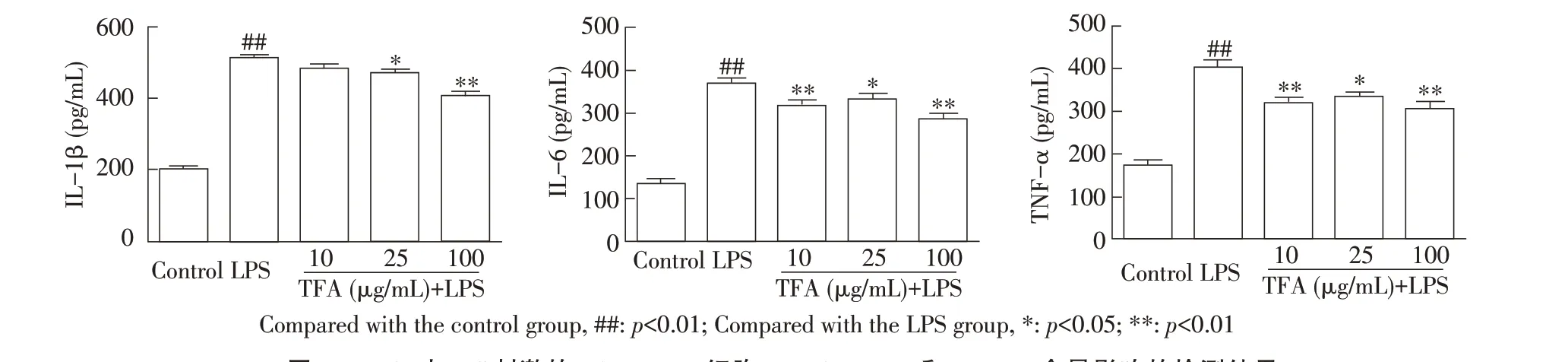
图3 TFA 对LPS 刺激的RAW 264.7 细胞IL-1β、IL-6 和TNF-α 含量影响的检测结果Fig.3 Effects of TFA on the production of IL-1β,IL-6 and TNF-α in RAW 264.7 cells stimulated by LPS
2.4 TFA 对正常培养的RAW264.7 细胞各细胞因子转录水平影响的检测结果通过RT-PCR 法检测不同浓度TFA 作用的正常培养的RAW264.7 细胞各细胞因子mRNA 转录水平,并经Quantity one 软件进行条带灰度分析。结果显示,与未加TFA 的对照组相比,25 μg/mL 和100 μg/mL TFA 显著和极显著提高了IL-1β mRNA 转录水平(p<0.05;p<0.01);各剂量TFA 均极显著提高了IL-6 mRNA 转录水平(p<0.01);各剂量TFA 显著和极显著提高了TNF-α mRNA 转录水平(p<0.05;p<0.01)(图4)。表明TFA 能够促进正常培养的RAW264.7 细胞中IL-1β、IL-6 及TNF-α mRNA 的转录水平,且呈一定的剂量依赖关系。
2.5 TFA 对LPS 刺激的RAW264.7 细胞各细胞因子转录水平影响的检测结果通过RT-PCR 法检测TFA 对LPS 刺激的RAW264.7 细胞各细胞因子mRNA的转录水平,并经Quantity one 软件进行条带灰度分析。结果显示,与空白组对照相比,LPS 刺激导致RAW264.7 细胞IL-1β、IL-6 及TNF-α mRNA 转录水平急剧增高(p<0.01),而25 μg/mL和100 μg/mL TFA极显著抑制了LPS 刺激的IL-1β mRNA 转录水平(p<0.01);各剂量TFA显著和极显著抑制了LPS刺激的IL-6 mRNA转 录 水 平(p<0.05;p<0.01);25 μg/mL 和100 μg/mL TFA显著和极显著抑制了LPS刺激的TNF-α mRNA转录水平(p<0.05;p<0.01)(图5)。表明TFA 能够抑制LPS 刺 激 的RAW264.7 细 胞IL-1β、IL-6 及TNF-α mRNA的转录水平,且呈一定的剂量依赖关系。
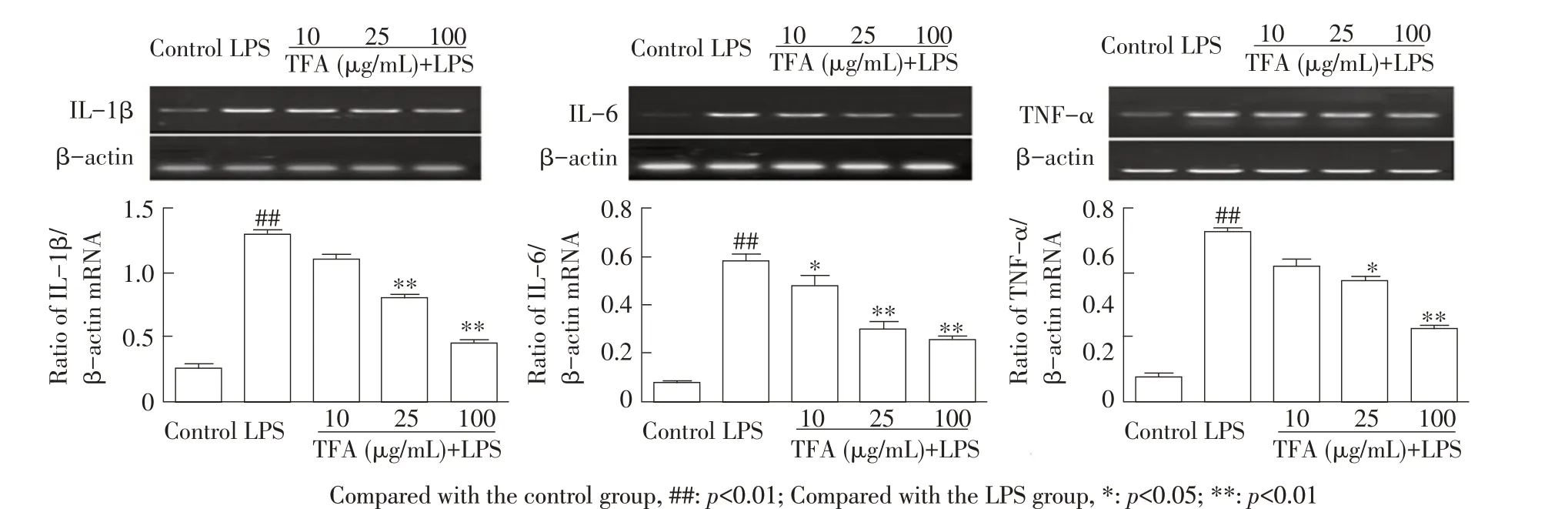
图5 TFA 对LPS 刺激的RAW264.7 细胞IL-1β、IL-6 和TNF-α mRNA 转录水平影响的检测结果Fig.5 Effects of the mRNA levels of TFA on IL-1β,IL-6 and TNF-α in RAW264.7 cells stimulated by LPS
2.6 TFA 对正常培养的RAW264.7 细胞NF-κB 信号通路中相关蛋白表达影响的检测结果通过western blot 检测不同浓度TFA 作用的正常培养的RAW264.7细胞NF-κB 信号通路中相关蛋白的表达变化,并经Quantity One 软件对目的蛋白条带进行光密度分析。结果显示,与未加TFA 的对照组相比,25 μg/mL TFA 显著下调正常培养的RAW264.7 细胞中IKKα/β、IκBα 蛋白的表达量(p<0.05)、极显著下调C-NF-κB p65 蛋白的表达量(p<0.01),100 μg/mL TFA 均极显著下 调IKKα/β、IκBα 和C-NF-κB p65 蛋 白 表 达 量(p<0.01);25 μg/mL TFA 极显著上调p-IKKα/β 和NNF-κB p65 蛋白的表达量(p<0.01)、显著上调p-IκBα 蛋白的表达量(p<0.05),100 μg/mL TFA 均极显著上调p-IKKα/β、p-IκBα 和N-NF-κB p65 蛋白的表达量(p<0.01)(图6)。表明TFA 能够抑制正常培养的RAW264.7 细胞NF-κB 信号通路中关键蛋白IKKα/β、IκBα及C-NF-κB p65的表达,促进p-IKKα/β、p-IκBα和N-NF-κB p65蛋白的表达,从而适度活化NFκB信号通路而增强免疫,且呈一定的剂量依赖关系。
2.7 TFA 对LPS 刺激的RAW264.7 细 胞NF-κB 信号通路中相关蛋白表达影响的检测结果通过western blot 检 测TFA 对LPS 刺 激 的RAW264.7 细 胞NFκB 信号通路中相关蛋白表达的变化,并经Quantity One 分析软件对目的蛋白条带进行光密度分析。结果显示,与空白对照组相比,LPS 刺激导致RAW264.7 细胞中IKKα/β、IκBα、C-NF-κB p65 蛋白的表达量极显著下调(p<0.01),p-IKKα/β、p-IκBα 及N-NF-κB p65 蛋 白 的 表 达 量 极 显 著 上 调(p<0.01)。10 μg/mL TFA 显 著 上 调 了LPS 所 致 的IKKα/β 蛋白表达量的下降(p<0.05),25 μg/mL 和100 μg/mL TFA 极显著上调了LPS 所致的IKKα/β 蛋白表达量的下降(p<0.01),10 μg/mL和25 μg/mL TFA显著上调了LPS 所致的IκBα 蛋白表达量的下降(p<0.05),100 μg/mL TFA 极显著上调了LPS 所致的IκBα蛋白表达量的下降(p<0.01),各剂量TFA均极显著上调C-NF-κB p65 蛋白的表达量(p<0.01);25 μg/mL TFA显著抑制了LPS所致的p-IKKα/β蛋白的过度表达(p<0.05),100 μg/mL TFA 极显著抑制了LPS所致的p-IKKα/β 蛋白的过度表达(p<0.01),10 μg/mL TFA显著抑制了LPS所致的p-IκBα和N-NF-κB p65蛋白的过度表达(p<0.05),25 μg/mL 和100 μg/mL TFA 均极显著抑制了LPS 所致的p-IκBα 和N-NF-κB p65 蛋白的过度表达(p<0.01)(图7)。表 明TFA 能 够 促 进LPS 刺 激 的RAW264.7 细胞NF-κB 信号通路中关键蛋白IKKα/β、IκBα、C-NF-κB p65 的表达,抑制p-IKKα/β、p-IκBα 及N-NF-κB p65 蛋白的过度表达,从而抑制NF-κB 信号通路的过度激活而起到抗炎作用,且呈一定的剂量依赖关系。
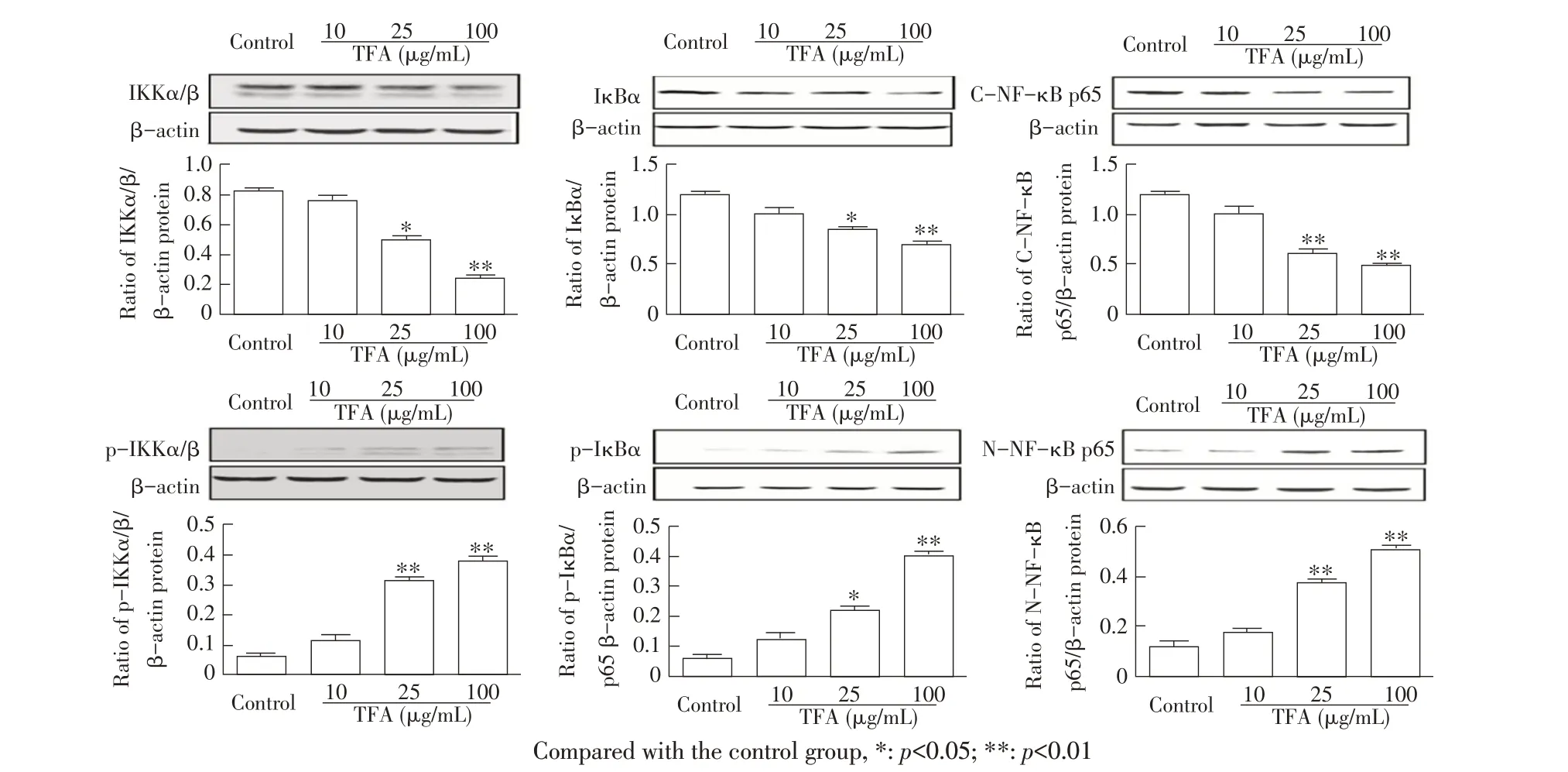
图6 TFA 对正常培养的RAW264.7 细胞NF-κB 信号通路中相关蛋白表达影响的检测结果Fig.6 Effects of TFA on the expression levels of the NF-κB signaling pathway related proteins in RAW264.7 cells
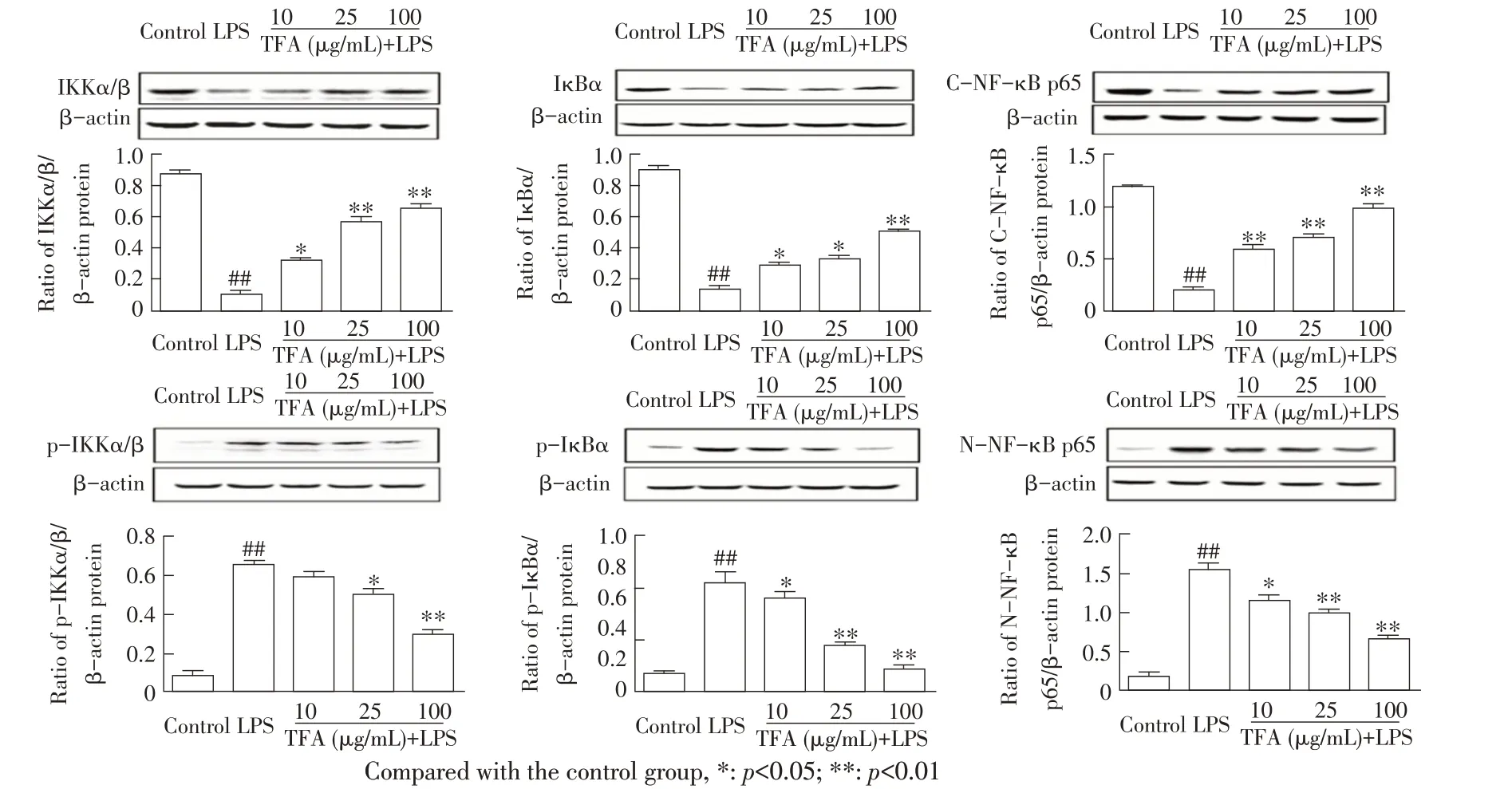
图7 TFA 对LPS 刺激的RAW264.7 细胞NF-κB 信号通路中相关蛋白表达影响的检测结果Fig.7 Effects of TFA on the expression levels of the NF-κB signaling pathway related proteins in RAW264.7 cells stimulated by LPS
3 讨 论
细胞因子是细胞间信息传递的信使,是反映机体免疫应答与炎症调控的重要指标。细胞因子具有双重性:当机体正常时,适量释放的细胞因子相互调控,激活免疫系统,进而调节机体的免疫功能;当机体受应激时,机体通过调控细胞因子及时参与炎症反应,常伴随有细胞因子表达的异常。TNFα、IL-6 和IL-1β 作为主要细胞因子,在机体免疫应答和炎症调节中发挥着重要作用。TNF-α 是一类在炎症调控中占据主导地位的双重活性细胞因子,机体正常时适量分泌的TNF-α 能够介导免疫应答,增强巨噬细胞杀伤活性等进而增强机体免疫机能,但大量释放的TNF-α 能够诱导其他炎性介质、氧自由基的分泌,加剧炎症的发展[12]。IL-1β 是IL-1 家族中最为重要的前炎性因子,适量释放可以提高机体免疫应答,也能协同IL-6 等炎性因子释放大量级联炎性因子或介质,加剧炎症过程[13-14]。体内研究结果显示,TFA 能够升高免疫功能低下的小鼠血清中细胞因子水平,从而增强小鼠的免疫功能[15]。本实验室前期研究也表明,TFA通过抑制佐剂诱导的关节炎大鼠血清中IL-1β、TNF-α 等炎性因子的过度释放,对大鼠关节炎修复起到免疫调节作用[16]。本实验从抗炎与免疫应答两方面经体外研究TFA对巨噬细胞RAW264.7 的细胞因子分泌的影响。结果显示,TFA能够促进正常培养的RAW264.7 细胞中细胞因子的含量及mRNA 转录水平,具有一定的免疫增强作用;其能够抑制LPS 刺激的RAW264.7 细胞细胞因子的含量及其mRNA 水平的过度转录,体现出明显的抗炎效果,表明TFA 对RAW264.7 细胞细胞因子具有抗炎免疫双向调节作用。本实验结果与以前研究报道的体内研究结果相一致[13-14]。
Toll 样受体是机体免疫应答中关键的识别性受体,现已发现其有15 种成员,其中Toll 样受体4(TLR4)是LPS 激活免疫应答所必需的特异性免疫受体,主要存在于巨噬细胞、T 和B 淋巴细胞、中性粒细胞等细胞表面[17]。LPS 与TLR4 受体结合通过髓样分化因子Myd88 途径激活NF-κB 信号通路是诱导巨噬细胞释放炎症介质的重要环节[18-19]。NF-κB 是机体关键的转录调节因子,能够参与调控免疫应答与炎症反应。NF-κB 信号通路受到诸多级联因子的调控,主要由NF-κB 抑制蛋白IκB、IκB 激酶IKKα/β 等级联反应调节各通路蛋白及其磷酸化活性,从而调控NF-κB 信号通路的活化。当细胞受到刺激后,IκBα 在IκBα 激酶作用下被快速磷酸化,随后NF-κB 被释放转位进入细胞核,激活NF-κB 靶位点基因,诱导炎症相关基因表达[20-23]。最近研究显示,TFA 抑制骨关节炎软骨细胞炎症因子的分泌机制与其下调NF-κB 信号通路有关[24]。为了进一步探究TFA 抗炎免疫应答的双向调节作用机制,本实验研究了TFA 对正常培养与LPS 刺激的RAW264.7 细胞NF-κB 通路中关键蛋白影响,结果表明TFA 可以调节正常和LPS 刺激的RAW264.7 细胞中关键蛋白的表达,适度活化正常情况下细胞中NF-κB 信号通路和抑制LPS 刺激后的细胞中NF-κB 信号通路的过度激活,从而调控细胞因子的分泌和表达。总之,本实验以正常条件下和LPS 诱导条件下的小鼠RAW264.7细胞作为体外模型,模拟机体在“正常”与“异常”的情形下,TFA 对免疫细胞分泌细胞因子的调控作用及调控机制进行了研究。结果表明,TFA 通过调节正常和LPS 刺激的RAW264.7 细胞NF-κB 通路中关键蛋白的表达,适度活化NF-κB 信号通路和抑制NF-κB 信号通路的过度激活,提高正常状态下细胞因子含量及mRNA 转录水平,抑制LPS 刺激下促炎因子的过度释放及mRNA 水平的过度转录,从而发挥其抗炎免疫双向调节作用。本研究为TFA 的临床应用提供参考依据和相关抗炎免疫药物的研发奠定基础。
