猪繁殖与呼吸综合征病毒在猪肺组织精细切片中感染特性的研究
2020-11-05崔红亮张洪亮汪孟航贾梅玉孟凡丹蔡雪辉
崔红亮,张洪亮,汪孟航,贾梅玉,孟凡丹*,蔡雪辉*
(1. 吉林农业大学动物科学技术学院,吉林 长春 130118;2. 中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的重要病毒性传染病,能够引起妊娠母猪早产、流产以及产死胎,同时还可造成仔猪呼吸障碍[1]。该病在全球范围内的主要养猪国家流行并暴发,给世界养猪业造成严重的经济损失。目前关于PRRSV 的分离、毒力测定等主要集中在利用传代细胞、原代肺泡巨噬细胞(PAM)以及动物实验作研究。肺组织精细切片(PCLS)作为一种呼吸系统体外培养体系,可以在体外高度重现肺脏组织在动物体内环境中的多种生物学功能与特性,因此是研究呼吸道病原体(病毒和细菌)在呼吸系统中的感染特性以及宿主天然免疫反应的良好工具[2-3]。PCLS 含有呼吸系统中多种类型的细胞且每种细胞仍分布于原有的组织结构上,能够释放辅助因子以保持其特有的生物学功能[4],如纤毛细胞位于呼吸道上皮表面,呈睫毛状排列且具有特定方向性摆动功能[5];杯状细胞主要分散于柱状上皮细胞之间,能够分泌黏液以维持呼吸道上皮湿润[6];PAM主要存在于肺泡以及呼吸道黏膜表面,具有重要的免疫调节作用,在天然免疫中扮演着重要角色[7]。因此PCLS 与传代细胞相比,在细胞构成和拥有呼吸系统生物学功能等方面更具有优势。目前国际上已经建立了多种动物PCLS 体外培养体系,并应用于多种呼吸道病原体的体外研究以及相关药物的筛选工作[8-9]。因此,为进一步了解PRRSV 在呼吸系统中的感染特性,本研究建立了猪PCLS,以及PRRSV在该培养体系中的感染模型,并初步探讨了PRRSV在该培养模型中的感染特性。本研究为PRRSV 的体外研究提供了新的模型与方法,同时也为其它的猪呼吸道病原体提供了新的体外研究平台。
1 材料与方法
1.1 主要实验材料 PRRSV 分离株(XD-15、WK-34、WK-38、LCL-75、DL-1510、HuN4)、Marc-145细胞由本实验室保存;3 月龄SPF 猪购自中国农业科学院哈尔滨兽医研究所牧场;低熔点琼脂糖购自Promega 公司;DMEM 和1640 细胞培养基、β-微管蛋白抗体购自Sigma 公司;胎牛血清购自CLARK 公司;青霉素和链霉素购自中国农业科学院哈尔滨兽医研究所诊断中心;卡那霉素购自北京索莱宝科技有限公司;黏蛋白抗体购自Vector Laboratories 公司;CD163 蛋白抗体购自Mybiosource 公司;逆转录酶(PrimeScriptTMRT Master Mix)和荧光定量酶(Premix EX TaqTM)购自TaKaRa 公司;冰冻切片包埋剂购自Leica公司;活/死细胞染色试剂盒购自US Everbright®Inc.公司;核酸提取试剂盒购自硕世生物科技有限公司。
1.2 猪PCLS 的制备 取3 月龄SPF 猪的新鲜肺脏组织,分别分离5 个肺小叶,并向各肺小叶中小心注入1.5%低熔点琼脂糖液,待凝固后制备精细切片。将制备好的猪PCLS 置于24 孔板中,每孔加入含有青霉素、链霉素、卡那霉素和两性霉素B 等抗生素的新鲜1640 培养基1 mL,于37 ℃,5% CO2的细胞培养箱中培养,每小时换液1 次,共换液3 次以去除肺脏组织中残留的低熔点琼脂糖。
1.3 支气管上皮纤毛活性评估 首先将1.2 步骤中制备的猪PCLS 中包含的支气管环平均分成10 份,按1%~10%计算每一部分纤毛摆动情况,将每部分纤毛摆动值相加作为整个支气管环纤毛活性值。在纤毛活性评估试验中,挑选10 张纤毛活性为100%的猪PCLS 进行评估试验。每天记录纤毛活性并换液,连续记录10 d。试验重复3 次。在后续的所有试验中均选用纤毛活性接近100%的猪PCLS。
1.4 猪PCLS 细胞活性鉴定选取纤毛活性为100%的猪PCLS 分成若干组置于24 孔板中培养,分别在制备后的第1 d、3 d、7 d 按照活/死细胞染色试剂盒说明书对猪PCLS 进行活/死细胞染色试验,设置Triton-X-100 处理过的100%死亡细胞为阴性对照组,染色后立即用ZEISS 高分辨率激光共聚焦显微镜观察检测结果。
1.5 支气管上皮细胞与PAM 的间接免疫荧光检测(IFA)将制备好的猪PCLS 用冰冻切片包埋剂包埋,在液氮中冻结后,利用冰冻切片机制备冰冻切片。冰冻切片首先用4%多聚甲醛固定,经0.2%Triton-X-100 透膜后,PBS 洗3 次,再用1%牛血清白蛋白(BSA)封闭。然后分2 组进行IFA 检测:第1组室温孵育β-微管蛋白(1∶300)荧光素标记抗体1 h,PBS 洗3 次,再室温孵育黏蛋白(1∶400)荧光素标记抗体1 h,PBS 洗3 次后用含DAPI 的封片剂封片;第2 组室温孵育PAM 表面标志物CD163(1∶100)鼠抗猪抗体1 h,PBS 洗3 次,再孵育羊抗鼠红色荧光二抗(1∶1 000),PBS 洗3 次,用含DAPI 的封片剂封片。β-微管蛋白和CD163 被标记为红色,黏蛋白被标记为绿色,细胞核被标记为蓝色。利用ZEISS高分辨率激光共聚焦显微镜观察检测结果。
1.6 PRRSV 感染猪PCLS 及病毒滴度测定分别利用PRRSV 分离株XD-15、WK-34、WK-38、LCL-75、DL-1510 和HuN4 感染猪PCLS,各病毒株感染剂量均为2.5×105TCID50/片,每株病毒感染3 张猪PCLS,所有试验均重复3 次以上。在37 ℃孵育2 h后,用PBS 洗3 次,加入2.5 mL 新鲜培养液培养,在不同时间点(0、8 hpi、12 hpi、24 hpi、48 hpi 和72 hpi)收集培养液上清,样品储存于-80 ℃条件下。利用Marc-145 细胞对培养液上清进行病毒滴度测定,Reed-Muench 法计算病毒的TCID50,以取样时间点为X 轴,各时间点病毒TCID50对数平均值为Y轴,绘制病毒生长曲线。
1.7 感染病毒量的荧光定量PCR 检测依据1.6 试验结果,选择具有代表性的时间点(12 hpi、24 hpi和48 hpi),测定PRRSV 各株感染猪PCLS 后培养液上清中的病毒基因拷贝数。利用核酸提取试剂盒提取病毒RNA,经逆转录得到cDNA,根据文献[10]中TaqMan 荧光定量PCR 方法检测病毒基因拷贝数。
2 结 果
2.1 支气管上皮纤毛活性评估连续记录10 d猪PCLS支气管环纤毛活性,结果显示精细切片制备后的第1 d至第3 d支气管环纤毛活性保持为100%,从第4 d开始纤毛活性略有下降,培养到第10 d 纤毛活性仍然能够保持在95%以上。支气管上皮细胞均保持良好的细胞活性(图1),表明在猪PCLS 的制备过程以及后续的体外培养过程对上皮细胞的生物学功能影响较小。
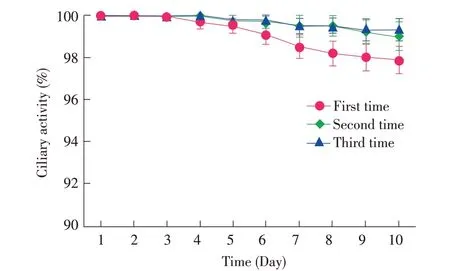
图1 猪PCLS 支气管纤毛活性评估Fig.1 Ciliary activity assay of bronchus in porcine PCLS
2.2 猪PCLS 细胞活性鉴定猪PCLS 在制备后进行活/死细胞染色试验,结果显示,活细胞被染成绿色,死细胞被染成红色。在猪PCLS 制备后的1 d(图2A、2E)、3 d(图2B、2F)和7 d(图2C、2G)支气管上皮细胞和肺泡细胞几乎全部为活细胞,而对照组中所有死亡细胞均被染成红色(图2D、2H)。表明制备后的猪PCLS 中纤毛与肺泡细胞状态良好,且在体外培养条件下仍能保持良好的细胞活性。
2.3 杯状细胞、支气管上皮细胞和PAM 鉴定分别利用黏蛋白、β-微管蛋白和猪PAM 表面标志物CD163 蛋白的荧光素标记抗体检测猪PCLS 支气管表面黏蛋白的表达、上皮细胞完整情况以及PAM 在猪PCLS 中的分布情况。结果显示,体外培养的猪PCLS 支气管上皮细胞保存完整,纤毛均匀分布于上皮细胞基顶部(图3A、3D、3H),该结果与图1 所示的纤毛活性评估试验结果一致。在体外培养的猪PCLS 中杯状细胞仍然可以分泌黏蛋白,主要分布于纤毛细胞之间或分布于支气管黏膜表面(图3B、3D、3H)。同时IFA 结果还显示,PAM 主要散在地分布于肺泡组织中(图3E~3G)。表明猪PCLS 中含有丰富的PAM,因此该培养体系可以用于PRRSV 在呼吸系统中感染特性的研究。

图2 活/死细胞染色评估猪PCLS 细胞活性Fig.2 Vitality of porcine PCLS evaluated by live/dead staining
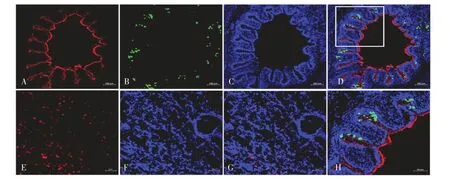
图3 黏蛋白、β-微管蛋白和CD163 的免疫荧光染色Fig.3 Immunofluorescence staining of Mucin,β-tubulin and CD163
2.4 PRRSV 在猪PCLS 中生长特性PRRSV 不同分离株感染猪PCLS 后,分别在0、8 hpi、12 hpi、24 hpi、48 hpi 和72 hpi 收集培养液上清,进行病毒滴度测定,并绘制各分离株的生长曲线。结果显示,各分离株在8 hpi 就可以检测到少量感染性病毒粒子,其中XD-15 和DL-1510 分离株在24 hpi 病毒滴度达到最大值,而HuN4、WK-34、WK-38和LCL-75等分离株在48 hpi达到峰值(图4)。结果表明,本试验使用的PRRSV 不同分离株均能够在猪PCLS 中增殖,但各病毒株之间的增殖速度存在差异。

图4 PRRSV 在猪PCLS 中的生长曲线Fig.4 Growth curve of PRRSV in porcine PCLS
2.5 PRRSV 在猪PCLS 中基因拷贝数的检测结果用PRRSV 分 离 株HuN4、XD-15、WK-34、WK-38、LCL-75 和DL-1510 感染猪PCLS,依据2.4 结果选取最具代表性的时间点(12 hpi、24 hpi 和48 hpi)收集培养液上清,提取病毒RNA,采用TaqMan 荧光定量PCR 方法检测病毒基因拷贝数。
结果显示在12 hpi 所有病毒株均可检测到较高的基因组拷贝水平(图5),6 株PRRSV 分离株在肺脏组织中的基因复制情况与病毒生长曲线相符。进一步表明,本试验使用的PRRSV 不同分离株均能够在猪PCLS 中增殖,但各病毒株之间的增殖速度存在差异。
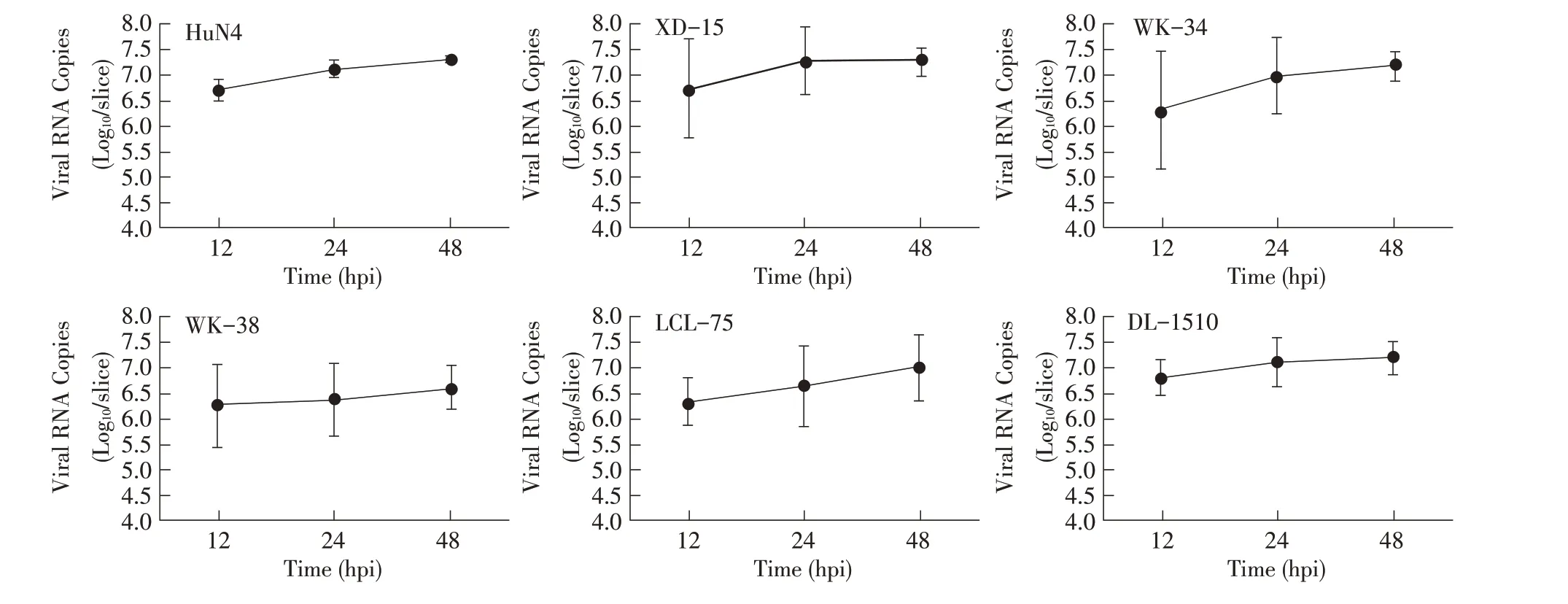
图5 病毒基因拷贝数的荧光定量PCR 检测Fig.5 Analysis of viral genome copy number by RT-qPCR
3 讨 论
PCLS 体外培养体系已被应用于多种哺乳动物和人的科学研究中[11],为解决呼吸道疾病相关的药理学、毒理学或生理学问题做出了突出贡献[12-13]。实验动物存在个体差异,影响试验的可重复性,目前缺少应用于研究PRRSV 体外感染的模型。建立一种用于PRRSV 研究的体外感染模型,将有利于在体外水平上研究PRRSV 的感染特性和致病机制。猪PCLS制备方法简便,能够在体外条件下连续培养,并且在体外培养条件下仍能够很好地维持呼吸系统多种生物学功能和生理学结构。猪PCLS 包含多种呼吸系统特有的原代细胞种类,可应用于在体外水平上研究多种呼吸道病原体在呼吸系统中的感染特性[14]。
纤毛摆动功能是呼吸道上皮细胞的重要生物学功能之一,纤毛活性的评估是评价猪PCLS 在制备后是否保持正常生物学功能的重要指标之一。通过对制备的猪PCLS 纤毛活性的连续观察,表明本实验制备的猪PCLS 在体外培养条件下可以较长时间维持呼吸道上皮细胞的生物学功能。猪PCLS 包含有多种肺组织特有的细胞种类,在体外条件下培养较长时间后,仍然具有较高的活细胞比例(图2),可应用于后续的病毒感染性研究。气管上皮细胞和杯状细胞对于维持支气管的物理屏障和生理学功能起到重要作用,通过IFA 检测β-微管蛋白和黏蛋白表明,本实验制备的猪PCLS 与正常的支气管生理结构保持一致。以上结果证明本研究制备的猪PCLS既具有正常的生理结构,也保持了各种原代细胞的细胞活性和生物学功能。
PRRSV 主要通过呼吸道和生殖道途径感染猪,猪PAM 主要存在于肺泡以及呼吸道黏膜表面,是PRRSV 在呼吸系统中感染宿主的重要靶细胞[15-17]。因此,通过对猪PCLS 中PAM 的分布情况进行检测,证明猪PCLS 中存在丰富的PAM,该培养体系可以用于PRRSV 在体外的感染性研究。为了进一步探究PRRSV 在呼吸系统中的感染特性,本研究以猪PCLS 为基础,建立了PRRSV 在呼吸系统中的体外感染模型。利用6 株本实验室保存的PRRSV 感染猪PCLS,结果表明,本实验使用的PRRSV 不同分离株均能够在猪PCLS 中增殖,但各病毒株之间的增殖速度存在差异。这可能与病毒在肺脏中感染的适应性以及细胞嗜性有关。虽然PRRSV 在猪PCLS 中增殖所产生的感染性病毒粒子的滴度并不是很高,但是检测病毒RNA 复制情况的结果说明,这6 株分离株的RNA 含量最大值均能够达到106拷贝/片。值得注意的是,尽管在PRRSV 感染后12 h 就可以检测到大量的病毒RNA,但是在相同时间点并不能够检测到大量感染性病毒粒子的释放。除此之外,感染性病毒粒子产生的数量也与猪PCLS 中存在的PAM 数量有关,当在猪PCLS 培养体系中增加PAM数量时,感染性病毒粒子的数量也有所升高(数据未展示)。
综上所述,本研究表明猪PCLS 可以用于PRRSV的体外感染研究并且能够反映出不同病毒株在猪肺组织中的增殖特性。本研究为PRRSV 的体外研究提供新的模型与方法,同时也为其它猪呼吸道病原体提供了新的体外研究平台。
