一株猪流感病毒A/swine/Shanghai/01/2019(H1N1)的分离鉴定及遗传进化分析
2020-11-05程靖华李本强刘惠莉
程靖华,陶 洁,李本强,石 迎,刘惠莉*
(1. 上海市农业科学院畜牧兽医研究所,上海 201106;2. 上海市农业遗传育种重点实验室,上海 201106;3. 上海市种猪工程技术中心,上海 201106)
猪流感病毒(Swine influenza virus,SIV)属正黏病毒科A 型流感病毒属,能够导致猪的急性、高度接触性呼吸道传染病。SIV 感染发病率高,临床症状主要表现为高热、咳嗽、呼吸困难,常突然发病,感染猪群多数或所有猪同时发病,而死亡率却相对较低。由于猪呼吸道上皮细胞同时具备α-2,3和α-2,6 两种唾液酸受体,所以猪是禽、猪、人流感病毒的共同易感宿主[1],不同流感病毒能在猪体内进行重组或重排形成新的病毒株。
目前,在世界范围内SIV 主要有H1N1、H1N2和H3N2 3 种亚型。此外,H1N7、H5N1、H9N2 等亚型流感病毒也能在猪体内分离到,其中H1N1 亚型SIV 主要包括经典型H1N1(Classical H1N1)、欧亚类禽型H1N1(Avian-like H1N1),类人型H1N1(Human-like H1N1)和2009 年在人群中大流行的H1N1(Pandemic H1N1)[2]。在2007 年,我国首次分离到欧亚类禽H1N1 SIV,殷秀辰等通过流行病学调查发现,在我国华东地区H1N1 SIV 感染情况比较严重[3]。H1N2 SIV 出现时间相对较晚,1978 年首次在日本的猪体内分离到H1N2 SIV[4],我国在2004 年首次发现双源重组H1N2 SIV[5],2009 年刘惠莉等也发现了一种新型的三源重组H1N2 SIV,其对禽类的致病性较弱而对哺乳动物致病性很强[6-7]。流感病毒一直存在较高的抗原变异,对SIV 流行株的变异趋势进行分析,有助于了解该病毒的变异进化趋势,预测新流感病毒毒株的出现。
本研究室持续对上海地区猪群中流感病毒进行监测,并于2019 年分离到1 株SIV,对该分离株进行遗传进化分析,发现其属于欧亚类禽型H1N1 SIV,与2017年报导的病毒特性基本一致[8],表明类禽型H1N1 SIV在上海地区猪群持续存在,变异幅度较小。
1 材料与方法
1.1 主要试剂和鸡胚PCR 试剂(2×Phanta Max Master Mix)、RNA 提 取 试 剂 盒(RNA isolator Total RNA Extraction Reagent)、反转录试剂(HiScript II 1st Strand cDNA Synthesis Kit)购自南京诺唯赞生物科技有限公司;反转录酶(M-MLV)购自宝生物工程(大连)有限公司;Blunt-3 平端连接载体购自北京Trans-Gen 公司;DL2000 DNA Marker 购自东盛生物有限公司;SPF鸡胚购自北京梅里亚实验动物技术有限公司。
1.2 样品采集及RNA 提取从上海地区养殖场采集临床具有咳嗽、流鼻涕及表现出上呼吸道症状的猪咽拭子样品40 份。采集的咽拭子样品经含双抗PBS 稀释后室温振荡,8000 r/min 离心10 min,取上清备用。吸取300 μL 上清,采用RNA isolator 试剂提取总RNA,利用HiScript II 1st Strand cDNA Synthesis Kit 将总RNA 反转录成cDNA,冻存于-80 ℃备用。
1.3 病毒分离鉴定以1.2 中的cDNA 为模板,参照祁贤等[9]建立的套式PCR 方法进行扩增。将PCR 鉴定为阳性的样品进一步接种9 日龄SPF 鸡胚,37 ℃培养,每12 h 观察鸡胚死亡情况,并收集死亡鸡胚尿囊液。72 h 后存活鸡胚置于-40 ℃冷冻后收集鸡胚尿囊液。按照上述方法,吸取适量尿囊液再次接种9 日龄SPF 鸡胚,进行盲传。收集第3 代鸡胚尿囊液,采用上述套式PCR 方法进行鉴定。对鉴定阳性的尿囊液,参照本实验室建立的SIV 亚型鉴定方法[10]进行病毒分型。
1.4 病毒全基因组扩增及序列分析参照Hoffmann等[11]建立的流感病毒全基因扩增方法,利用高保真酶分别扩增分离株的8 个基因节段,并将其克隆至平端载体后测序。测序结果采用BLAST、MegAlign 和MEGAX进行序列比对、同源性分析,并构建进化树。
2 结果与讨论
2.1 病毒分离及亚型鉴定采用套氏PCR 方法对40 份临床样品进行初步检测,共有3 个疑似阳性样品。将其接种9 日龄SPF 鸡胚,连续传代3 代并进一步验证。结果显示,接种鸡胚后72 h 内鸡胚均未出现死亡。收获鸡胚尿囊液经套氏PCR 鉴定,其中有一个样品能扩增出288 bp 的条带,与预期相符。采用SIV 亚型检测方法[10]鉴定该分离株为H1N1 亚型SIV,命名为A/swine/Shanghai/01/2019。对分离株的8 个基因节段进行扩增,PCR 产物经琼脂糖凝胶电泳检测结果符合预期大小(图1)。

图1 SIV 的分离鉴定(A)及8 个基因节段的扩增(B)结果Fig.1 Isolation andidentification of SIV(A)and eight segments(B)of SIV by PCR
2.2 全基因组同源性比较与进化分析对毒株A/swine/Shanghai/01/2019 的8 个基因节段进行序列测定分析,结果显示,分离株HA、PB2、PB1、PA 基因与A/swine/Jiangsu/49/2012(H1N1)的同源性最高,达99.2%~99.8%;而NA、NP、M 和NS 基因则与A/swine/Shanghai/3/2014(H1N1)毒株的同源性最高,达99.5%~100%。通过将分离株的8 个基因节段的核苷酸序列与GenBank 中的经典型H1N1、欧亚类禽型H1N1、类人型H1N1 和2009H1N1 分支代表毒株进行比对分析,结果显示,A/swine/Shanghai/01/2019 的8个基因节段均属于欧亚类禽型H1N1 进化分支,未出现不同基因型流感病毒片段之间的重组,与江苏省猪群中分离出的类禽型H1N1 SIV 亲源关系很近(图2)。结合近年来监测结果发现,欧亚类禽型H1N1 SIV 在我国猪群感染具有持续性,自2006 年后成为主要流行株,虽然其致病力相对较低,但可感染人类,并通过空气飞沫传播,因此值得长期持续检测。

图2 分离株HA、NA 基因进化树Fig.2 Phylogenetic trees of HA and NA genes of the SIV isolates
2.3 HA 蛋白关键氨基酸位点分析HA 蛋白是流感病毒最主要的表面糖蛋白,是最主要的毒力和宿主范围决定因素,主要发挥病毒结合受体及膜融合的功能。在分离株A/swine/Shanghai/01/2019 HA蛋白的裂解位点(aa339~aa350)具有PSIQSR↓GLFGAI 序列,具备低致病性流感病毒的分子特征。流感病毒氨基酸的抗原位点、受体结合位点和潜在糖基化位点的突变都有可能改变流感病毒的抗原特性、宿主适应性和致病力。关键位点分析发现,该分离株HA 蛋白有7 个潜在的糖基化位点,分别27NNS、28NST、40NVT、212NHT、291NCT、498NGT、557NGS,其中HA1 有5 个,HA2 有2 个。该分离株HA蛋白的受体结合位点为(H3numbering)130-Loop(133R、135T、136T、137V、138A), 190-Helix(190V,193T,198N),220-Loop(225E、226Q、227A、228G),与类禽型H1N1 A/swine/Shanghai/3/2014 株相比,该分离株在190位发生突变,与其余参考株相比差异较大(表1)。参考Caton 等确定的H1N1 流感病毒HA 蛋白Ca1、Ca2、Cb、Sa、Sb 5 个抗原性位点区域[12],本研究分离株与A/swine/Shanghai/3/2014 株抗原位点一致,但与经典型H1N1、2009 H1N1、类人型H1N1 存在多个抗原位点氨基酸差异(表2)。
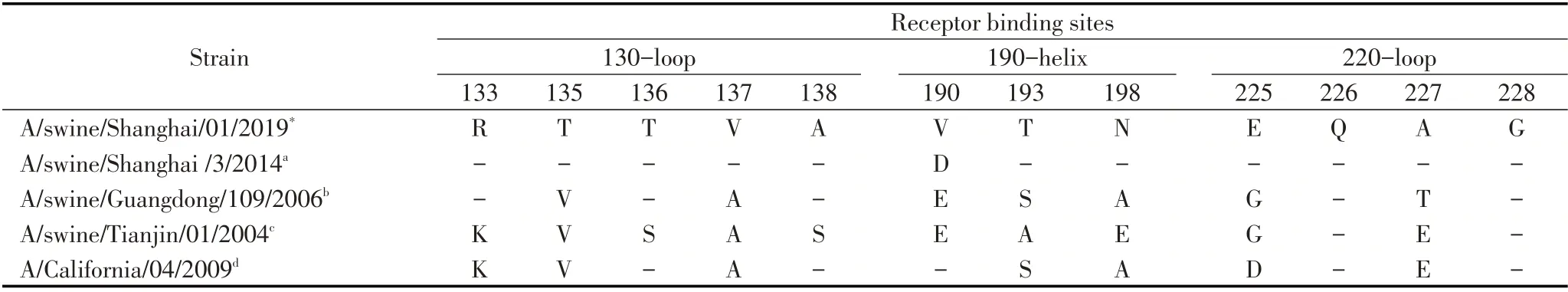
表1 分离株HA 蛋白受体结合位点分析(H3 numbering)Table 1 Receptor binding sites of HAproteins(H3 numbering)
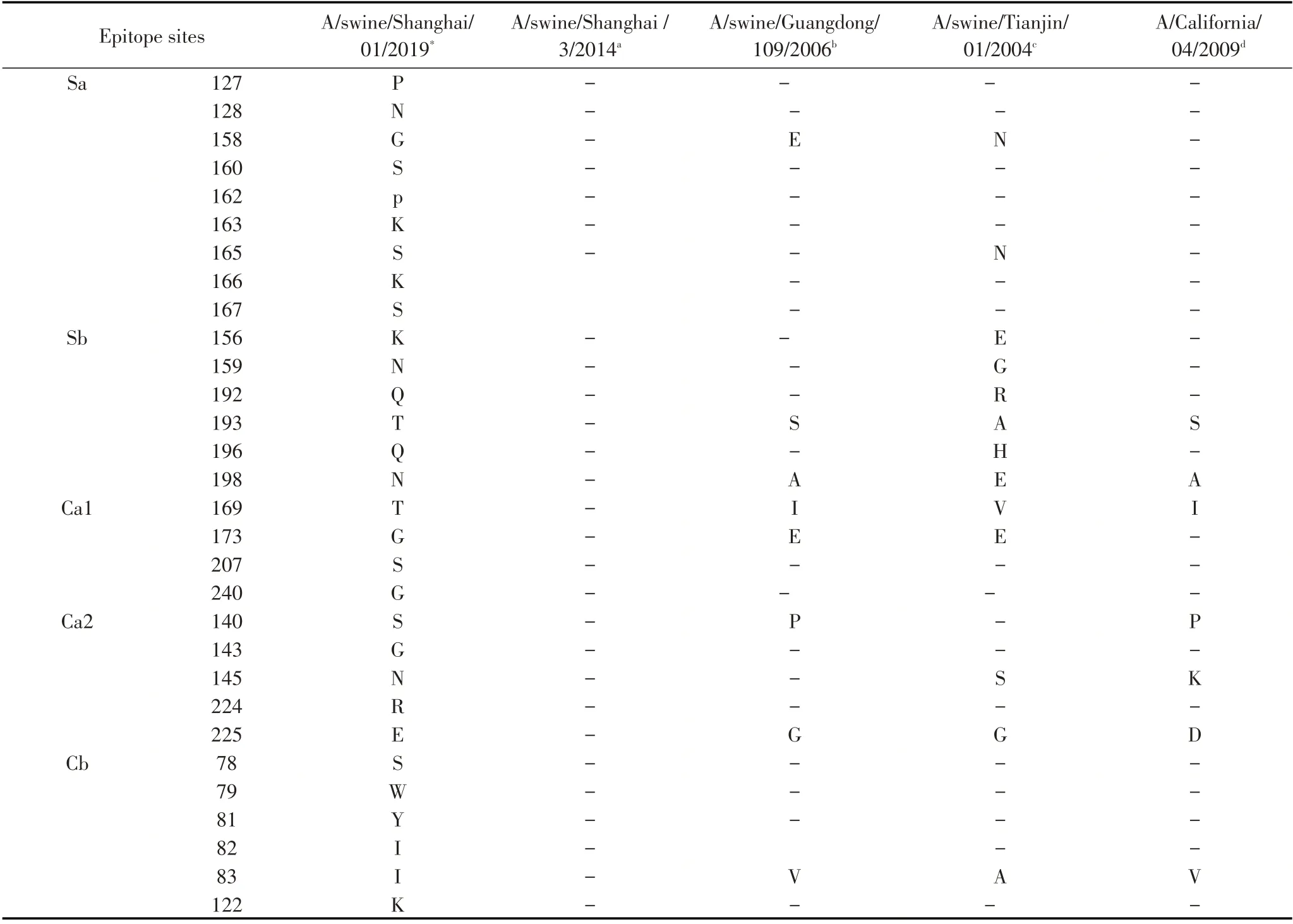
表2 分离株HA 蛋白抗原位点分析(H3 numbering)Table 2 Epitope sites of HA proteins(H3 numbering)
2.4 NA 蛋白关键氨基酸位点分析NA 蛋白是流感病毒的表面糖蛋白,参与病毒的出芽。A/swine/Shanghai/01/2019(H1N1)分离株NA 蛋白存在7 个潜在的糖基化位点,分别为44NQS、58NNT、63NQT、68NIS、88NSS、146NGT、235NGS。流 感 病 毒NA 蛋 白E119V、R152K、H275K、R293K 和N295S 氨基酸的变异与N1 亚型流感病毒对神经氨酸酶抑制剂类药物的耐药性病毒株的出现有关,该分离株的NA 基因中在119(E)、152(R)、275(H)、293(R)和295(N)位置未发生氨基酸位点突变,表明该病毒对神经氨酸酶抑制类药物敏感。
2.5 内部蛋白关键氨基酸位点分析内部蛋白也决定了流感病毒的毒力和对宿主的适应性。通常来说,PB2 蛋白D701N、E627K 突变是流感病毒在哺乳动物宿主内进行复制和传播的标志,并能够增强对哺乳动物的致病性,NS1 蛋白D92E 突变将提高流感病毒对猪和小鼠的致病性,PA 蛋白A70V 单突变或与P224S 共同突变,PB1 蛋白某些氨基酸突变如H99Y、V171M、R198K、T296R、M317I、N375S、L473V、L598P 等可改变H1N1 流感病毒的毒力[13-15]。本研究分离株PA蛋白第224 位为S,PB1 蛋白发生V171M、R198K 和L473V 突变,PB2 蛋白701 位为N,提示该分离株对哺乳动物的适应性增强,可能导致其致病性增强,需要加强对此类SIV 的监测。M2 蛋白V27A、A30T 和S31N 氨基酸变异会导致流感病毒对金刚烷胺类药物的耐药性。该分离株M2 蛋白aa31 位突变为N,表明该病毒株可能对金刚烷胺类药物具有一定的耐药性。
结合近年来监测结果发现,上海地区猪群中H1N1 亚型SIV 持续存在,本研究从猪群中分离到的SIV 是否能够在猪群中持续进化,发生不同亚型之间的重组及其是否会对猪具有更严重的致病性有待于进一步研究。本研究通过监测上海地区猪群中SIV 流行株的变异情况,并分析该病毒的遗传进化特征,对猪流感的防控具有重要意义。
