基于16S rDNA快速鉴定细菌的PCR测序方法的建立及其进化关系分析
2020-11-04宋路萍杨振苹邢体坤郝一楠王亚萍张静静
宋路萍 杨振苹 王 斌 邢体坤 郝一楠 江 魁 王亚萍 黄 帅 张静静▲
1.华兰生物工程股份有限公司研发中心,河南新乡 453003;2.华兰基因工程有限公司质量控制部,河南新乡 453000
微生物污染是制药企业生产过程控制及药品质量评估的重要指标,也是影响消费者用药安全的关键因素[1]。美国FDA公布的药品召回事件中,由微生物污染风险引起的召回事件占到了49%以上[2]。药品微生物控制是药品安全性保障的重要措施。因此加强药品生产过程微生物监管和风险控制是保障药品质量、降低用药风险的重要途径[3]。在药品生产的微生物质量控制中,实现微生物“属”及“种”水平的准确鉴定,对控制药品质量以及保障消费者用药安全具有重要意义[4-5]。随着分子生物学技术的快速发展,微生物鉴定技术也得到飞速发展。近年来,各种基因诊断技术在细菌检测中不断开发、利用,尤其是基于聚合酶链反应(polymerase chain reaction,PCR)的基因诊断技术发挥着越来越重要的作用,是细菌鉴定技术发展的主要趋势。研究表明,在细菌细胞中RNA碱基的变化比整个基因组的变化要慢得多,保守得多,这是因为RNA的功能一直没有发生变化。因此有细菌“活化石”之称[6]。现代微生物学中,利用16S rDNA序列来鉴定细菌的种类以及分析它们之间的进化关系正在被成功运用。基因型鉴定技术如16S rRNA序列比对方法可以鉴定多数细菌,已得到广泛应用[7-8]。但有研究表明,16S rRNA序列比对方法和RiboPrinter微生物鉴定系统,对一些近缘菌种有一定的鉴定局限性[9-10]。
1 材料与方法
1.1 供试品
细胞培养物中分离的未知菌种(编号为JY-01)与已知菌种(编号为JY-02),由华兰生物工程股份有限公司研发中心提供。
1.2 材料信息
Ezup柱式细菌基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒购自生工生物,Taq Plus DNA聚合酶、琼脂糖H、4S Red Plus核酸染色剂(10 000 ×水 溶 液)购 自 BBI,GeneRuLer DNA Ladder Mix 购自 Thermo Scientific。Taq Plus DNA 聚 合 酶、10×PCR Buffer(含 Mg2+)、dNTP(10mM)、灭菌去离子水购自生工生物,引物27F:AGAGTTTGATCMTGGCTCAG;1492R:GGTTACCTTGTTACGACTT;由生工生物合成。
1.3 仪器设备
洁净工作台购自江苏苏洁净化设备厂,PCR反应扩增仪购自BIO-RAD,高速微量离心机购自Eppendorf,电泳仪、电泳槽购自北京六一生物科技有限公司,凝胶成像系统购自ProteinSimple,微量分光光度计购自美国Thermo公司。涡旋混匀器购自美国精骐有限公司,恒温培养箱购自上海博讯实业有限公司,恒温振荡器购自美国Thermo公司,离心机购自德国赛多利斯公司。
1.4 样品处理
革兰染色法是细菌学中广泛使用的一种鉴别染色法,通过染色初步确定未知菌种为革兰阴性细菌或者革兰阳性细菌。阳性细菌需加入100μL Buffer Digestion和 80μL溶菌酶溶液(重悬菌液,37℃水浴 30min)。
1.5 基因组DNA的提取
利用试剂盒的方法进行基因组DNA的提取,采用裂解和相分离技术,结合DNA制备膜选择性地吸附DNA的方法达到纯化基因组DNA的目的。
1.6 DNA质量的电泳检测
1.6.1 制胶 根据目的片段的大小确定胶体浓度。以1%浓度为例:称取0.5g琼脂糖放入烧杯中,并加入50mL 1×TAE缓冲液,用微波炉加热溶解至溶液澄清透明。在凝胶托盘中插入梳子,倒入凝胶,待凝胶成形后使用。
1.6.2 上样 琼脂糖凝胶在使用前拔掉梳子,放入电泳槽中,点样孔在负电极方,加入适量的1×TAE缓冲液使其液面高出凝胶2~3mm,用移液枪取3μL DNA样品,加入0.2μL核酸染色液以及0.8μL 10×上样缓冲液,混匀后加4μL到凝胶点样孔中。
1.6.3 电泳 连接好导线(相同颜色的导线与插口相连),开启电泳仪,调节8V/cm(电压180V;电流300mA)电泳15~20min,停止电泳。
1.6.4 成像 使用ProteinSimple凝胶成像系统在UV模式下对电泳结束的琼脂糖凝胶进行成像拍照。
1.7 引物设计
16s rDNA的保守区为所有细菌共有,细菌之间无显著差异[11-12]。设计引物软件用Primer Premier 5,在保守区设计通用引物。PCR扩增产物长度:位点测序引物在150~300bp左右,离位点80~150bp,外显子检测引物离外显子上下游150bp左右;目的基因测序的PCR产物条带一般不超过1200bp。
1.8 PCR反应体系及条件
PCR 反应体系为:Taq Buffer(10×with MgCl2)5μL,dNTP(mix)2μL,引 物 F(10μM)2μL,引物 R(10μM)2μL,Taq酶(5U/μL)0.5μL,模板DNA(20~50ng/μL)2μL。PCR反应条件为:95℃10min激活Taq聚合酶;95℃变性15s,60℃退火和延伸1min,共40个循环。
1.9 电泳检测
PCR产物取5μL 1%琼脂糖凝胶电泳,电泳参数:150V,100mA,10~ 20min电泳成像。PCR产物电泳条带为所需DNA目的条带,PCR获得的DNA产物送交生工生物进行核酸序列测定。
1.10 数据分析
属于国家生物信息中心的核酸数据库有GenBank(www.ncbi.nlm.nih.gov)、核糖体Ⅱ期工程数据库(http://rdp.cme.msu.edu/html)、效基因 IDNS数据库(www.smartgene.ch)等,通常选两个或以上数据库进行横向比对[11]。将测序公司回馈的序列进行分析,测序图谱(.abl)使用说明:峰图文件(.abl)可用Chromas软件或SeqMan软件打开。在SeqMan软件中打开,去除峰型图不准的碱基,将上游引物和下游引物的测序结果拼接在一起,保存拼接好的序列。16S rDNA序列在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)上比对;利用BLAST软件从GenBank数据库中搜索相关菌株的16S rDNA全序列,采用Clustal X软件进行多序列比对和同源性分析,确定细菌的种属,并做系统发生树加以分析。
2 结果
2.1 革兰染色结果
将平板培养分离得到的微生物进行革兰染色,显微镜观察初步判断为革兰阳性杆菌,见图1。

图1 分离未知菌种革兰染色结果
2.2 DNA电泳检测
取5μL DNA溶液1%琼脂糖、1×TAE缓冲溶液电泳(电压120~180V)检测,见图2。单一条带说明DNA完整无降解,有明显的条带说明浓度可以满足PCR要求;并用分光光度计检测浓度和纯度,取 1μL检 OD 值,OD 260/280 在 1.7~ 2.0,说明DNA质量较好,小于1.7有蛋白污染,大于2.0有RNA污染。一般有少量的蛋白与RNA污染不影响普通PCR。
2.3 PCR电泳检测
取 5μL DNA 溶液 1%琼脂糖、1×TAE缓冲溶液电泳(电压120~180V)检测,PCR产物经过凝胶电泳显示出的条带图谱见图3。目的条带为1500bp左右,与理论值相符。单一条带说明无特异性扩增条带。

图2 JY-01和JY-02 DNA电泳检测图

图3 JY-01和JY-02 PCR电泳检测图
2.4 测序结果分析
该技术主要依赖生物遗传结构的多样性,对特定的靶基因通过PCR进行扩增后,将扩增产物片段进行测序。样本16S rDNA序列在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)及GenBank数据库(https://www.ncbi.nlm.nih.gov/BLAST)中进行比对,最终得出菌种鉴定结果。图4为JY-01样本16S rDNA序列在核糖体数据库比对结果。
未知菌种的PCR扩增产物经过测序,结果拼接为1500bp的片段。将JY-01与参考序列按照不同的结构基因和功能基因以及全基因组分别进行了核苷酸同源性分析,结果见图5(JY-01样本分离的未知菌株系统发生树分析结果)。
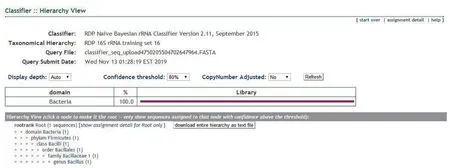
图4 JY-01样本16S rDNA序列在核糖体数据库比对结果
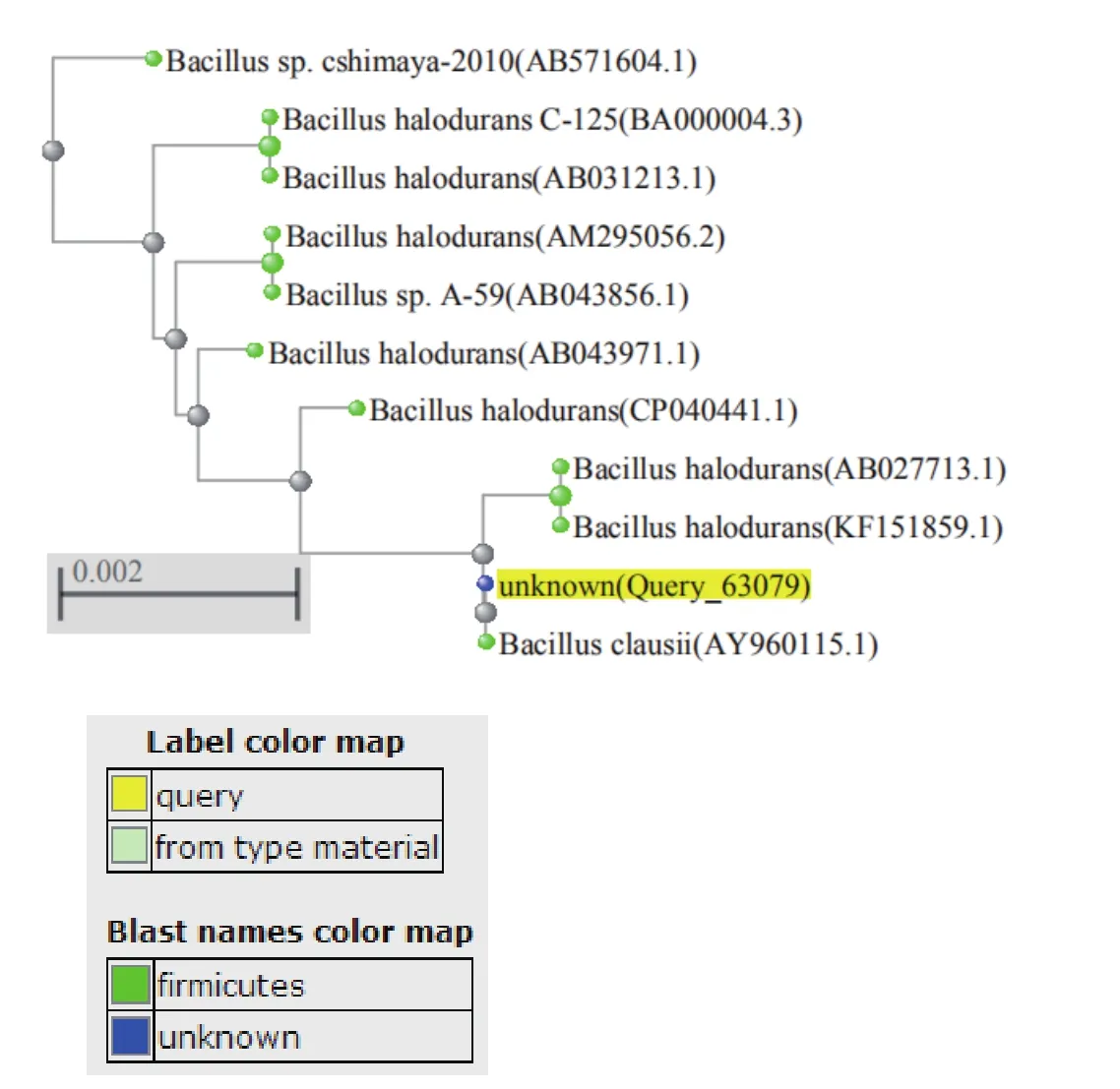
图5 JY-01样本分离的未知菌株系统发生树分析结果
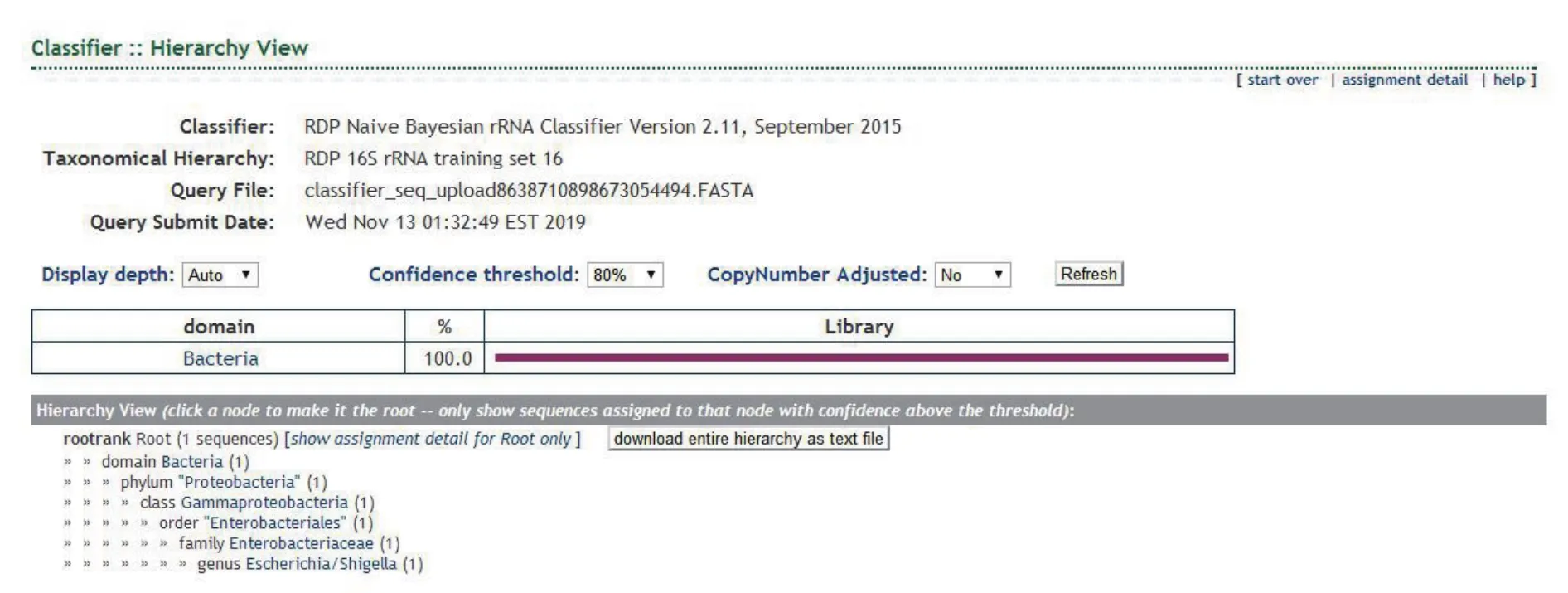
图6 JY-02样本16S rDNA序列在核糖体数据库比对结果

图7 JY-02样本分离的已知菌株系统发生树分析结果
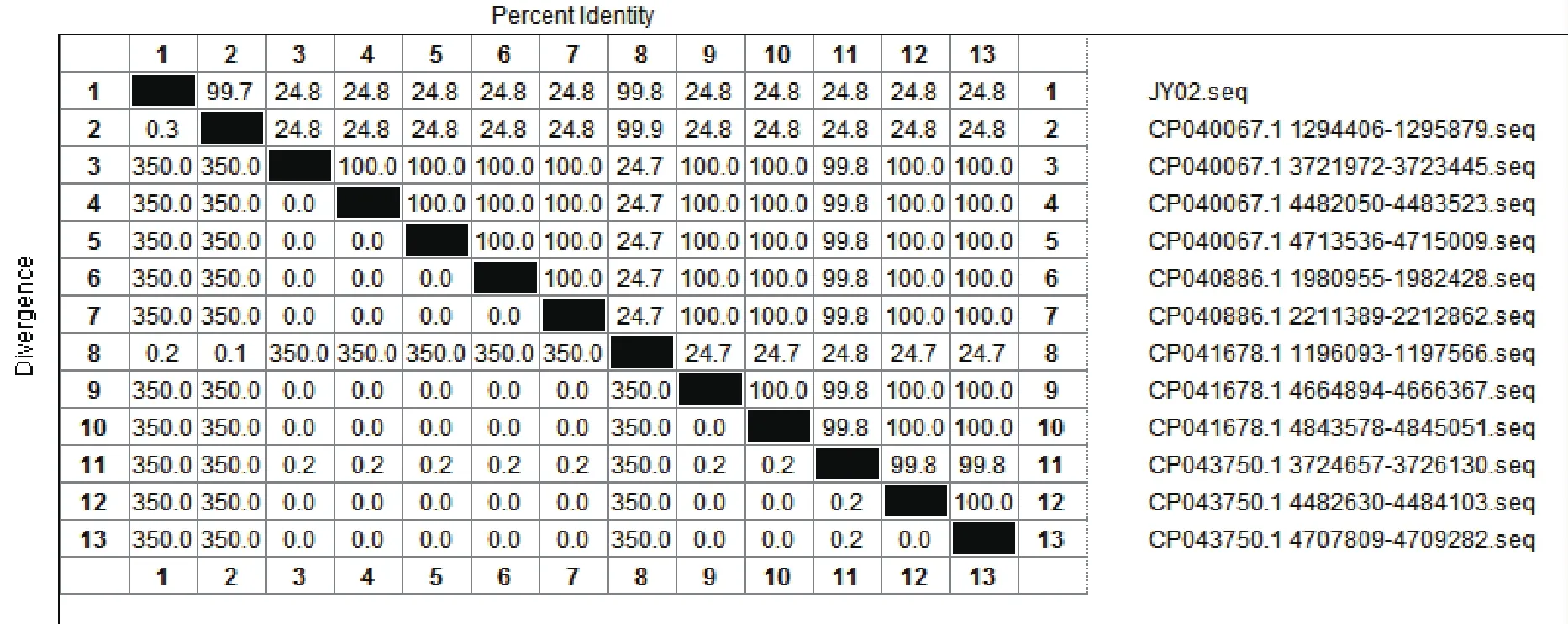
图8 JY-02样本与GenBank数据库中序列同源性比对结果
根据JY-01样本16S rDNA序列在核糖体数据库及GenBank数据库中比对结果,JY-01样本被鉴定为Bacillus(杆菌属),疑似为Bacillus halodurans(耐盐芽孢杆菌)或Bacillus clausii(克劳氏芽孢杆菌)。其分类单元为:Bacteria;Firmicutes;Bacilli;Bacillales;Bacillaceae;Bacillus。
图6为JY-02样本16S rDNA序列在核糖体数据库比对结果。图7为JY-02样本分离的已知菌株系统发生树分析结果。根据JY-02样本16S rDNA序列在核糖体数据库及GenBank数据库中比对结果,见图8。JY-02样本被鉴定为Escherichia coli(大肠埃希杆菌)。其分类单元为:Bacteria;Proteobacteria;Gammaproteobacteria;Enterobacterales;Enterobacteriaceae;Escherichia。鉴定结果与已知菌种信息一致,说明该方法可以用于微生物鉴定。
图8为JY-02样本16S rDNA序列在GenBank数据库中比对结果。结果显示JY-02样本与GenBank数据库中CP040067.1序列同源性高达99.7%。JY-02样本被鉴定为Escherichia coli(大肠埃希杆菌)。由于JY-01仅仅鉴定到属,根据实验要求,如需进行鉴定至种,需要进行二代测序。
3 讨论
鉴定病原细菌有多种方法,如形态学观察、血清分型、生化分析、遗传学分析等。遗传学分析法有基因序列分析、分子标记检测、核酸分子杂交等[13]。16S rRNA基因在基因序列分析中应用最多[14]。16S rDNA鉴定是指用利用细菌16S rDNA序列测序的方法对细菌进行种属鉴定。包括细菌基因组DNA提取、16S rDNA特异引物PCR扩增、扩增产物纯化、DNA测序、序列比对等步骤。是一种快速获得细菌种属信息的方法。16S rRNA普遍存在于原核生物中。rRNA参与生物蛋白质的合成过程,其功能是任何生物都必不可少的,而且在生物进化的漫长历程中保持不变,可看作为生物演变的时间钟。在16S rRNA分子中,既含有高度保守的序列区域,又有中度保守和高度变化的序列区域,因而它适用于进化距离不同的各类生物亲缘关系的研究。目前,传统鉴定技术存在敏感度低、耗时长的缺点,如通过表现型鉴定的生化分析过程存在较多不确定因素[14]。比较而言,基因型更稳定受环境因素影响较小[15-16]。因此,本研究建立的16S rRNA基因序列分析法较生化分析法更加稳定。同时建立一种快速可靠、成本低廉、操作简便的快速鉴定细菌的PCR测序方法的建立是非常有必要的。
