异海松酰基噻吩类磺酰胺的制备及其抗肿瘤活性研究
2020-11-03卢言菊赵振东毕良武陈玉湘
卢言菊, 赵振东, 毕良武, 陈玉湘*, 王 婧, 古 研
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室;江苏省林业资源高效加工利用协同创新中心,江苏 南京 210042; 2.中国林业科学研究院 林业新技术研究所,北京 100091)
天然产物是新药的重要来源,特别是在抗肿瘤和降血压领域[1-2]。对天然产物进行结构修饰改造获得低毒和环境友好的生物活性制剂已经成为天然产物研究的重要方向,也是开发新型农药和医药的重要研究内容。松香是我国重要的天然产物,异海松酸是其重要成分之一,异海松酸分子中C13位有一个甲基和一个乙烯基,分子中不存在共轭双键,这一特殊结构使得异海松酸及其衍生物都具有较好的生物活性;基于异海松酸独特的结构及其较强的生物活性优势,使得异海松酸在杀虫、抗肿瘤、抑菌、激活钾离子通道、抗病毒和抗结核等方面表现出明显的效果,近年来受到国内外学者的广泛关注,成为国内外研究的热点[3-5]。将具有生物活性的结构单元拼接到异海松酸结构上,会对异海松酸的生物活性具有加强作用。磺酰胺类化合物本身也具有较好的生物活性,对于磺酰胺类衍生物的制备及其应用,国内外专家进行了大量的研究,结果表明:磺酰胺类化合物具有广泛的抑菌、抗肿瘤、抗炎、抗病毒等生物活性[6-8]。岑波等[9]以α-蒎烯为原料制备得到α-蒎烯基苯基磺酰胺类化合物,此类化合物对黄瓜枯萎病菌、花生褐斑病菌、苹果轮纹病菌、小麦赤霉病菌以及番茄早疫病菌等 5种植物病原菌都具有较好的抑制活性;Wilkinson等[10]制备了含1,2,3-三唑结构的磺酰胺类化合物,此类化合物对结核分枝杆菌具有显著的抑制活性;Hu等[11]制备了咔唑类磺酰胺化合物,并将其应用于人白血病细胞的抑制活性测定,结果表明:该类化合物对白血病细胞表现出了很强的抑制活性,有望应用于白血病治疗药物的研发;马献力等[12]制备了11个新型樟脑酸基苯磺酰胺类化合物,通过生物活性测试验证了大部分化合物均具有一定的抑菌活性;唐燕玲等[13]合成了8个未见报道的 3-芳基-5-噻吩基二氢吡唑磺酰胺衍生物,研究表明:部分该类化合物具有潜在的体外抗炎活性。作者课题组前期的研究表明异海松酸酰基苯基芳磺酰胺类化合物有较好的抗肿瘤活性,鉴于噻吩类磺酰胺化合物具有更好的抗肿瘤活性,本研究拟利用活性拼接原理将含有噻吩的磺酰胺类化合物引入到异海松酸结构中,成功地合成了4种未见报道的异海松酰基噻吩类磺酰胺,并对其进行抗肿瘤活性筛选,以期为新药研发提供参考。
1 实 验
1.1 材料与试剂
异海松酸,自制[14];4-溴-2,5-二氯噻吩-3-磺酰氯、5-溴噻吩-2-磺酰氯、5-氯- 4-硝基噻吩-2-磺酰氯、噻吩-2-磺酰氯均购自上海阿拉丁生化科技股份有限公司,分析纯;三乙胺,分析纯。人体宫颈癌细胞(Hela)、乳腺癌细胞(MDA-MB-231)、前列腺癌细胞(PC-3)和肝癌细胞(Hep G2),江苏凯基生物技术有限公司;KGM12800型DMEM培养基,江苏凯基生物技术有限公司。
1.2 异海松酰基噻吩类磺酰胺化合物的合成
1.2.1合成路线 异海松酰基杂环类磺酰胺化合物的合成路线如图1所示。
1.2.2异海松酸酰氯(2)的制备 在冰浴下充入氮气保护,将草酰氯的二氯甲烷溶液滴加到异海松酸(1)的二氯甲烷溶液中,室温下搅拌反应3 h。反应结束后,减压蒸馏除去溶剂后得到淡黄色液体即为异海松酸酰氯(2)。
1.2.3化合物5a~5d的制备 将一定量的对苯二胺(3)、三乙胺和四氢呋喃加入烧瓶中,搅拌溶解,随后,将杂环磺酰氯溶解于四氢呋喃中,缓慢滴加到反应烧瓶中,常温反应1~2 h,TLC跟踪反应终点,得到中间产物(4);随后将1.2.2节制备的异海松酸酰氯(2)溶解于四氢呋喃溶液中,在冰浴下滴加至上述反应烧瓶中,常温搅拌反应2~5 h,TLC跟踪反应终点,反应结束后过滤除去生成的三乙胺盐酸盐,旋转蒸发除去溶剂得到固体粗产品,再经重结晶得产物5a~5d。
1.3 产物抗肿瘤活性实验
1.3.1细胞株培养 将待测人体肿瘤细胞株用胰蛋白酶-EDTA(0.25%)消化液消化后,与10%的胎牛血清、磷酸盐缓冲溶液(PBS)和DMEM培养基制成细胞悬浮液,置于37 ℃,5%CO2的饱和水汽二氧化碳培养箱中培养,3~4天传代一次。
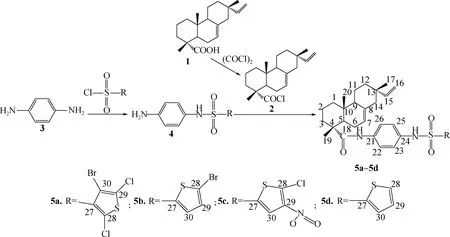
图1 异海松酰基噻吩类磺酰胺衍生物的合成路线
1.3.2受试化合物溶液的配制 用DMSO分别配制100 mmol/L异海松酸噻吩类磺酰胺化合物母液,液体样品经稀释配置成100和10 μmol/L的待测液。
1.3.3抑制活性测试 采用噻唑蓝(MTT)法测试化合物对肿瘤细胞的抑制活性[15]。细胞经消化、计数,配制细胞悬液(3.5×107个/L),在96孔细胞培养板中每孔加入100 μL细胞悬液,置于37 ℃,5%CO2培养箱中培养过夜;将提前配制好的不同浓度的待测化合物溶液加入到96孔板的每个微孔中,每孔100 μL,继续置于37 ℃,5%CO2培养箱中培养72 h后,每孔加入20 μL(5 g/L)MTT溶液,继续培养4 h。培养结束后弃去上清液,每孔加入150 μL DMSO溶解,摇床振荡10 min 混匀,用酶标仪测定490 nm处的吸光值(A)。根据下式计算样品的抑制率:
式中:η—抑制率,%;Ac—对照值;As—实验值;Ab—空白值。
2 结果与讨论
2.1 目标化合物的结构表征




2.2 目标化合物的抗肿瘤活性测试
2.2.1抑制率 采用MTT 法分别测定了异海松酰基噻吩类磺酰胺化合物在浓度为100 和10 μmol/L时对人体宫颈癌(Hela)、乳腺癌(MDA-MB-231)、前列腺癌(PC-3)和肝癌(Hep G2)这4种人体肿瘤细胞增殖的抑制活性,结果见表1。

表1 异海松酰基噻吩类磺酰胺化合物对肿瘤细胞的抑制率Table 1 Inhibitory rates of isopimaric thiophene sulfonamides derivatives against cancer cell lines
从表1可以看出,当异海松酰基噻吩类磺酰胺化合物的浓度为100 μmol/L时,化合物5b对Hela、MDA-MB-231及Hep G2肿瘤细胞的增殖抑制率均超过90%,其抑制率分别为91.36%、94.06%和92.26%,而对PC-3肿瘤细胞的抑制率为86.93%,也接近90%,说明化合物5b具有非常好的抗肿瘤活性;但化合物5a、5c和5d对4种人体肿瘤细胞的抑制率较差,均低于25%。当异海松酰基噻吩类磺酰胺化合物的浓度为10 μmol/L时,化合物5a~5d对4种人体肿瘤细胞的抑制率均较低,抗肿瘤效果不明显,说明药物浓度对抗肿瘤活性具有较大的影响。将表1的体外抗肿瘤活性进行初步构效关系分析,化合物5a的噻吩环上引入了1个溴原子和2个氯原子,其对4种肿瘤细胞的抑制率较低;化合物5b的噻吩环上引入了1个溴原子,其对4种肿瘤细胞的抑制率显著提高;化合物5c的噻吩环上引入了1个氯原子的同时还引入了1个硝基,其对4种肿瘤细胞的抑制率明显下降;而未有卤素原子引入的化合物5d,其抗肿瘤活性也较差。因此,可以看出噻吩环上取代基的种类以及取代位置,对化合物的抗肿瘤活性具有较大的影响。
2.2.2半数抑制浓度 根据表1中各化合物对4种人体肿瘤细胞的增殖抑制活性的测定结果,选取抗肿瘤活性较好的化合物5b运用 MTT 比色法测定其半数抑制浓度(IC50)值,并选用高效、广谱的天然产物抗癌剂紫杉醇和临床上应用较广的抗癌剂5-氟尿嘧啶(5-FU)作为阳性对照,结果见表2。

表2 异海松酰基杂环磺酰胺类化合物对肿瘤细胞的IC50值Table 2 IC50 values of isopimaric heterocyclic sulfonamides derivatives against cancer cell lines
从表2可以看出,化合物5b显示出较高的抗肿瘤活性,对人体肿瘤细胞Hela、 MDA-MB-231、 PC-3和Hep G2的IC50值分别为28.53、 32.54、 32.93和29.22 μmol/L,均低于阳性对照物5-FU,说明化合物5b的抑制效果优于阳性对照物5-FU;同时化合物5b对Hela的抑制活性优于天然产物抗癌剂紫杉醇,可作为抗肿瘤药物筛选参考。
3 结 论
3.1以异海松酸为原料,制备得到4个未见报道的异海松酰基噻吩类磺酰胺化合物:异海松酰基- 4-溴-2,5-二氯噻吩-3-磺酰胺(5a)、异海松酰基-5-溴噻吩-2-磺酰胺(5b)、异海松酰基-5-氯- 4-硝基噻吩-2-磺酰胺(5c)、异海松酰基-噻吩-2-磺酰胺(5d),并采用FT-IR、1H NMR、13C NMR和ESI-MS等方法对化合物结构进行了确证。
3.2选用人体宫颈癌(Hela)、乳腺癌(MDA-MB-231)、前列腺癌(PC-3)和肝癌(Hep G2)这4种人体肿瘤细胞研究了目标化合物的体外抗肿瘤活性,采用MTT 法分别测定了异海松酰基噻吩类磺酰胺化合物在浓度为100和10 μmol/L时对人体肿瘤细胞的抑制率。结果表明:化合物5b具有非常好的抗肿瘤活性,其对Hela、 MDA-MB-231及Hep G2的肿瘤细胞增殖抑制率均超过90%,噻吩环上取代基的种类及取代位置对化合物的抗肿瘤活性具有较大的影响,通过IC50值的测定得出化合物5b的抑制效果优于阳性对照物临床上应用较广的抗癌剂5-氟尿嘧啶(5-FU)。这些结果对后续异海松酸磺酰胺类化合物的结构优化与改造研究具有重要的指导意义。
