板栗壳棕色素对酪蛋白酸钠的荧光淬灭作用
2020-11-02郭城
郭城
武汉设计工程学院食品与生物科技学院(武汉 430205)
在众多天然色素中,棕色素在食品着色中占有重要地位,应用十分广泛,但品种并不多[1]。板栗壳是板栗加工过程中的废弃物,从中可提取得到一种天然棕色素,其主要活性成分为黄酮类化合物[2]。这种色素安全无毒、水溶性好、着色力强、性质稳定,可广泛用作食品、日用化学品和药品等产品的着色剂[3-5]。另外,黄酮类的物质具有抗氧化、抗衰老的功效,故板栗壳棕色素不仅具有着色功能,而且有一定药用价值,发展前景十分广阔[6]。
酪蛋白是乳蛋白的主要成分(约占80%)[7],酪蛋白酸钠是通过碱中和酸性酪蛋白产生的[8],其干粉完全溶解于水中,具有良好的表面活性、稳定性、成胶性、亲水性和自组装特性,是良好的制备纳米载体的材料[9]。
近年来,有将板栗壳棕色素应用于乳制品的研究[10-11],但对板栗壳棕色素与牛奶中蛋白质相互作用的研究还很少。因此,以酪蛋白酸钠与板栗壳棕色素复合体系为对象,通过调控质量比研究板栗壳棕色素对酪蛋白酸钠的荧光淬灭作用,探讨两者相互作用的机制。
1 材料与方法
1.1 材料与试剂
板栗壳(市售新鲜板栗,洗净后剥壳,板栗壳于60 ℃烘干,粉碎后过50目筛,去除绒毛,粉末备用);酪蛋白酸钠(生化试剂,上海阿拉丁生化科技股份有限公司);丙酮(分析纯,天津市凯通化学试剂有限公司);乙酸乙酯(分析纯,国药集团化学试剂有限公司);氯仿(分析纯,天津市凯通化学试剂有限公司);正丁醇(分析纯,天津市凯通化学试剂有限公司);氢氧化钠(分析纯,国药集团化学试剂有限公司);盐酸(分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备
SP-754PC型紫外-可见分光光度计(上海光谱仪器有限公司);RF6000型荧光分光光度计(日本岛津制造所);Nexus470型红外光谱仪(美国Nicolet公司);85-2型数显恒温磁力搅拌器(上海精风仪器有限公司);CyberScan pH 510型pH计(Eutech仪器有限公司);TGL-16G高速台式离心机(上海安亭科学仪器厂)。
1.3 试验方法
1.3.1 板栗壳棕色素的制备
参照文献[12]方法略有改动。板栗壳粉在40 ℃、固液质量比1︰15条件下,用0.5 mol/L NaOH水溶液浸提8 h;经尼龙网布过滤,在5 000 r/min条件下离心30 min,收集上清液;将正丁醇-氯仿混合液(1︰4V/V)与上清液混合,去除蛋白;收集水相,并用2 mol/L的HCl调节至pH 2.0,静置2 h后于5 000 r/min条件下离心30 min,收集沉淀;沉淀用pH 11的NaOH水溶液溶解,重复使用HCl处理上清液,收集沉淀,直至酸无色;沉淀用无水乙醇洗至无色,残渣进一步用乙酸乙酯洗3次,用丙酮洗3次,冷冻干燥获得板栗壳棕色素粉末。
1.3.2 板栗壳棕色素紫外-可见光谱测定
将一定量的板栗壳棕色素溶于Tris-盐酸缓冲液(50 mmol/L,pH 9.0),室温搅拌2 h,配制成1 mg/mL溶液。使用紫外-可见分光光度计在波长200~800 nm范围内每间隔1 nm定点测定其吸光度,并绘制紫外-可见光谱图。
1.3.3 板栗壳棕色素红外光谱测定
按固液质量比1︰50取板栗壳棕色素样品粉末与KBr研细均匀,制成透明薄片,利用傅里叶变换红外光谱仪对样品进行分析,测定波数400~4 000 cm-1,扫描次数32次,分辨率4 cm-1。
1.3.4 酪蛋白酸钠-板栗壳棕色素混合样品溶液配制
用Tris-盐酸缓冲液(50 mmol/L,pH 9.0)配制0.5 mg/mL酪蛋白酸钠溶液,向其中加入不同质量的板栗壳棕色素,使酪蛋白酸钠与板栗壳棕色素的质量比达到1︰0,1︰0.1,1︰0.2,1︰0.3,1︰0.5,1︰0.8,1︰1.0和1︰1.5,室温搅拌2 h,备用。
1.3.5 荧光光谱测定
采用岛津RF6000型荧光分光光度计进行荧光光谱扫描,激发波长分别设置成280和295 nm,激发缝宽10 nm,记录荧光强度的变化。
1.3.6 数据处理
结果应用Origin 8.5软件进行数据处理和作图。
2 结果与分析
2.1 板栗壳棕色素紫外-可见光谱分析
由图1可以看出,板栗壳棕色素具有典型的黑色素类紫外可见光谱图。最大吸收波长为208 nm,与其他报道的黑色素最大吸收波长210 nm一致[13]。此外,试验制备的板栗壳棕色素在279 nm处有典型的肩状峰,文献[14-15]表明,在270~280 nm区域的肩状峰,通常出现在天然黑色素光谱中,而在化学合成的黑色素中则不存在,这是由于与天然黑色素结合的蛋白质所致。

图1 板栗壳棕色素紫外-可见光谱图
由图2可知,波长在400~600 nm范围内,板栗壳棕色素的对数吸光度具有良好线性,并且斜率为-0.002 05。据报道,不同来源的黑色素也具有这种负斜率的特征对数吸光图[13]。

图2 板栗壳棕色素对数吸光图
2.2 板栗壳棕色素红外光谱分析
由图3可知,板栗壳棕色素在2 931 cm-1处具有吸收峰,这是由脂肪族C—H结构拉伸振动产生的;在1 721 cm-1处的峰是由COOH结构中C=O的拉伸振动产生的;1 615 cm-1处的峰是由芳香环中C=C结构拉伸振动产生的;1 372 cm-1处的峰是由酚羟基变形振动产生的;1 150和1 078 cm-1处的峰是由脂肪族基团的骨架振动产生的。这些主要吸收峰与文献[12,16]中报道的黑色素相似,说明试验制备的板栗壳棕色素属于黑色素类。
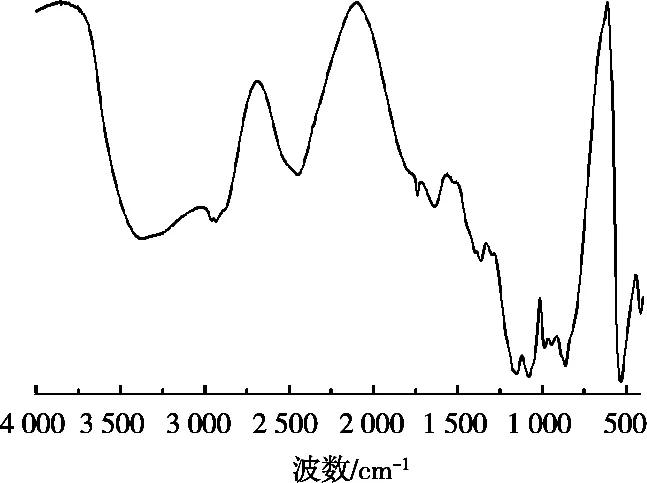
图3 板栗壳棕色素红外光谱图
2.3 酪蛋白酸钠-板栗壳棕色素混合样品荧光光谱分析
当一些小分子物质加入到蛋白质溶液形成复合物后,荧光强度降低,这种现象称为荧光淬灭[17]。荧光淬灭法是研究蛋白质与小分子相互作用的重要手段,研究蛋白质的荧光淬灭过程能够得到蛋白质与小分子相互作用的结合常数、作用区域及位置等信息[18]。
酪蛋白的荧光主要来自于色氨酸和酪氨酸,当淬灭剂无限接近色氨酸和酪氨酸残基时会发生荧光淬灭[19]。采用不同的激发波长研究复合物中色氨酸和酪氨酸基团,激发波长280 nm时,色氨酸和酪氨酸残基均能被激发,激发波长295 nm时,仅色氨酸被激发[20]。比较2种激发波长下的荧光淬灭情况,可以判断色氨酸和酪氨酸的变化。
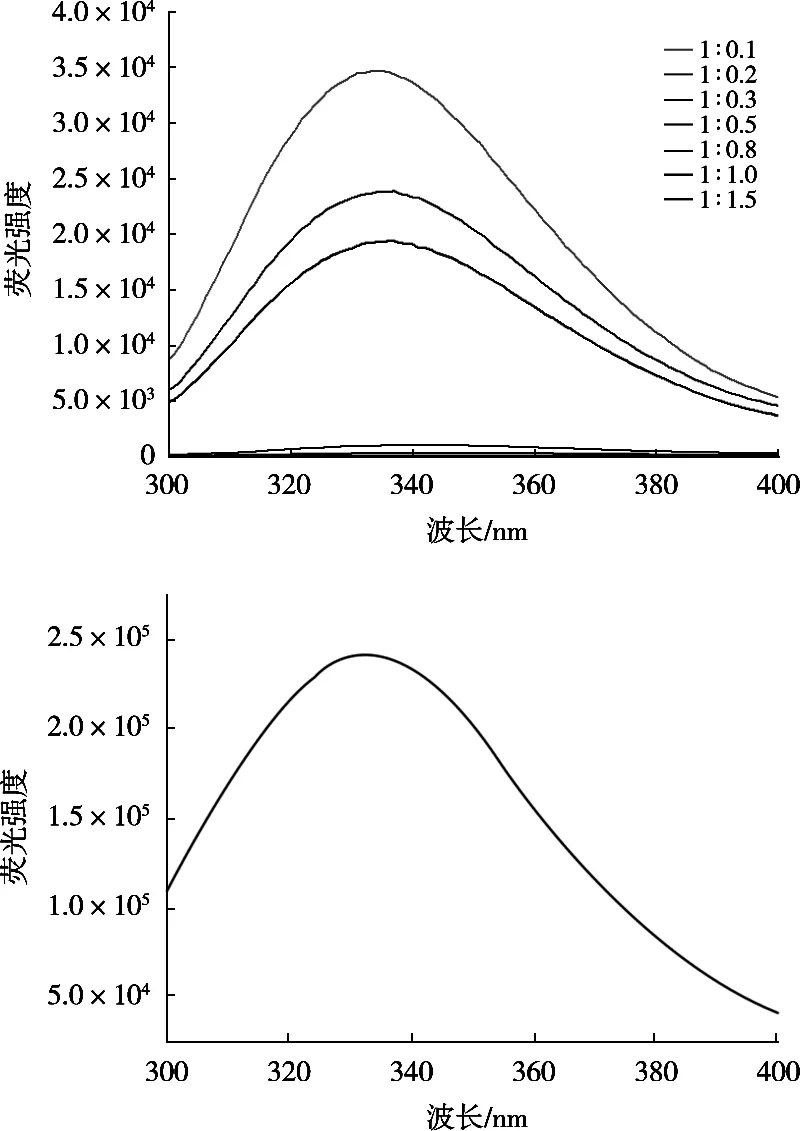
图4 酪蛋白酸钠-板栗壳棕色素复合物发射荧光光谱(激发波长280 nm)

图5 板栗壳棕色素-酪蛋白酸钠复合物发射荧光光谱(激发波长295 nm)
图4 和图5是激发波长280和295 nm时,不同添加量板栗壳棕色素色素诱导的酪蛋白酸钠-色素复合物的发射荧光光谱。单一的酪蛋白酸钠具有较高的荧光强度,激发波长280和295 nm时其最大发射峰分别位于337和334 nm处。随着色素的加入,酪蛋白酸钠-色素复合物的荧光强度明显降低,色素与酪蛋白酸钠比例超过0.5︰1后,荧光强度几乎完全消失。这种现象说明板栗壳棕色素对酪蛋白具有强烈的荧光淬灭效应,色素与蛋白之间可能形成非共价复合物。
F和F0分别为不加淬灭剂和加淬灭剂时酪蛋白酸钠的荧光强度。由图6可知,色素与酪蛋白酸钠比例低于0.5︰1时,色素在2种激发波长下对酪蛋白酸钠造成的荧光淬灭没有发生重叠,这表明酪蛋白中的色氨酸和酪氨酸均参与了与色素的作用[7]。色素添加量较大时,荧光淬灭强烈,使2种激发波长下荧光强度都非常低,导致曲线发生重叠。
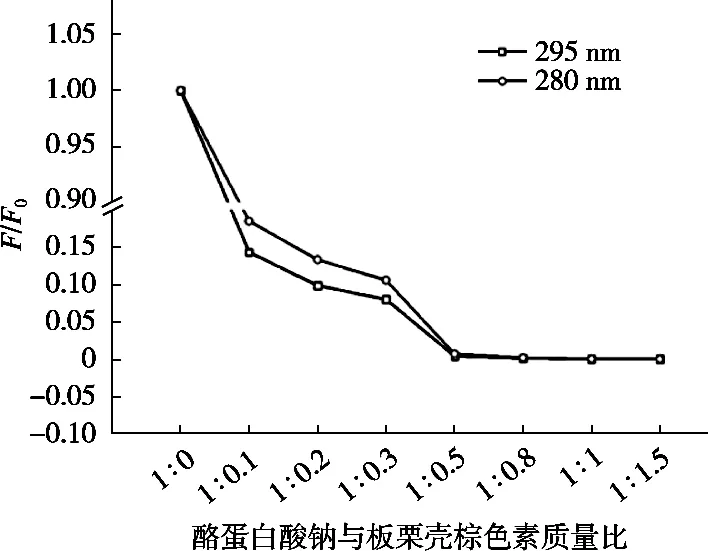
图6 不同质量比酪蛋白酸钠-板栗壳棕色素复合物Stern-Volmer图
3 结论
试验采用碱溶酸沉法从新鲜板栗壳中提取板栗壳棕色素,该色素的紫外-可见光谱在208 nm处具有最大吸收峰,并且在波长400~600 nm范围内的对数吸光度具有良好的线性关系(斜率为-0.002 05),其红外光谱也与文献报道中黑色素相似,说明试验制备的板栗壳棕色素属于黑色素类。将酪蛋白酸钠与板栗壳棕色素按不同质量比(1︰0,1︰0.1,1︰0.2,1︰0.3,1︰0.5,1︰0.8,1︰1.0和1︰1.5)混合后发现,随着色素的增加,酪蛋白酸钠的荧光强度大幅度降低,具有强烈的荧光淬灭效应,说明板栗壳棕色素与酪蛋白形成复合物,并且酪蛋白中的色氨酸和酪氨酸均参与了与色素间的相互作用。
