丹参植株邻苯二甲酸与立枯丝核菌菌丝生长互作研究
2020-11-02冯静周冰谦刘谦王晓卢恒郭兰萍刘伟史国玉
冯静,周冰谦,刘谦,王晓,卢恒,郭兰萍,刘伟*,史国玉
(1.山东中医药大学,山东 济南 250355;2.齐鲁工业大学(山东省科学院)山东省分析测试中心,山东 济南 250014;3. 中国中医科学院中药资源中心,北京100700;4.山东医学高等专科学校,山东 济南 250002)
丹参为唇形科鼠尾草属植物丹参SalviamiltiorrhizaBge.的干燥根及根茎,首载于《神农本草经》,被列为上品[1],具有活血祛瘀,通经止痛,清心除烦,凉血消痈的功效[2]。丹参为多年生草本植物,野生资源无法满足市场的需求,主要来源为人工栽培。目前丹参栽培一年即采收,而连年的复种导致丹参土壤环境发生改变,植物无法适应环境的改变而产生致害作用,从而导致产量和品质连年下降,连作障碍成为丹参栽培过程中最为突出的问题,危及丹参临床用药的安全性、有效性、稳定性和可控性[3-5]。
连作障碍的形成是植物-土壤系统中多种因素综合作用的结果,主要包括土壤环境及其理化性质的改变、土壤微生物种群的改变以及化感自毒作用[6-9]。研究表明,酚酸类化感自毒物质是引起连作障碍的重要因素之一[10-11],而植物根系分泌的酚酸类自毒物质能够显著影响土壤微生物的生物量、多样性和群落结构[12]。丹参连作不仅使土壤酸化,并且对其根际土壤细菌群落结构及多样性影响较大,造成土壤中优势菌群如水恒杆菌属及伯克霍尔德氏菌的比例下降以及变形菌门、纤维弧菌属丰度降低[13]。丹参连作一年,土壤中赤霉菌属、马鞍菌属和梨孢菌属丰度显著增加,酵母菌属丰度降低;连作两年,土壤中镰刀霉菌、赤霉菌属、毛壳菌属和马鞍菌属的丰度显著增加,并且新增了Knufia、Clydaea与立枯丝核菌[3,14]。须根处理后的丹参土壤酸性组分较空白组增加了19.30倍,且新增了邻苯二甲酸等化感物质[3]。百合、花生、含喜树碱植物、野菊的根系分泌物中含有邻苯二甲酸酯类物质,且邻苯二甲酸对花生的发芽和根系生长具有抑制作用[15-18]。然而,有关丹参植株分泌的酚酸类自毒物质与病原菌生长之间的相互作用研究尚未见报道。
本研究选取邻苯二甲酸与立枯丝核菌为实验材料,研究丹参连作障碍产生的酚酸类自毒物质与病原菌之间的相互作用,以期揭示二者与丹参连作障碍的内在联系,为研究丹参连作障碍提供新的思路和方法。
1 材料与仪器
1.1 材料与试剂
丹参采自莱芜紫光生态园有限公司,经山东中医药大学李佳教授鉴定为唇形科植物丹参SalviamiltiorrhizaBge.;立枯丝核菌购于广东省微生物菌种保藏中心;邻苯二甲酸,分析纯,购于国药集团化学试剂有限公司;马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基,均购于北京索莱宝科技有限公司。
1.2 仪器
BAS124S分析天平(德国赛多利斯科学仪器有限公司);Agilent 7890A气相色谱仪(安捷伦有限公司);Agilent-1120高效液相色谱仪(安捷伦有限公司);SW-CJ-2FD单面垂直净化工作台(苏州净化设备有限公司);LDZM立式压力蒸汽灭菌器(上海申安医疗器械厂);超声波清洗机(宁波新芝生物科技股份有限公司);TGL-16医用离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司);XW-80A涡旋混合仪(海门市其林贝尔仪器制造有限公司)。
2 方法
2.1 丹参植株内邻苯二甲酸酯类化合物提取与分离
2.1.1 样品溶液的制备
将丹参地上部与地下部分别粉碎,过筛,精密称取样品粉末0.5 g置于具塞锥形瓶中,加入甲醇10 mL,超声提取30 min,取上清液过0.22 μm滤膜,备用。
2.1.2 标准品溶液的制备
精密称取邻苯二甲酸二甲酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯、邻苯二甲酸双-2-2乙氧基乙酯、邻苯二甲酸二环己酯与邻苯二甲酸单(2-乙基己基)酯6种标准品0.01 g置于10 mL容量瓶中,加入甲醇充分溶解,并定容至10 mL,混匀,备用。
取上述6种标准品溶液各1 mL置于10 mL容量瓶中,加甲醇定容至10 mL,过0.22 μm滤膜备用。
2.1.3 GC分析条件
气相色谱柱:HP-5(30 m×250 μm,0.5 μm);流速1 mL/min,进样方式为不分流进样;进样口温度:250 ℃;柱温:程序升温,60 ℃(保持2 min),以5 ℃/min升至180 ℃,保持5 min,以10 ℃/min升至300 ℃,保持10 min;接口温度:280 ℃;进样量1.0 μL。
2.2 邻苯二甲酸浓度实验
称取PDA培养基置于锥形瓶中,加入蒸馏水,混匀,封口,115 ℃高压灭菌20 min备用。配制0.1 g/mL的邻苯二甲酸母液备用。分别在未凝固的PDA培养基中精密加入相应浓度的邻苯二甲酸乙醇溶液,不同浓度邻苯二甲酸处理分为CK(空白对照),A,B,C,D共5组(表1)。取一定量立枯丝核菌菌丝加入无菌水中重悬,备用。精密移取100 μL菌液于培养皿中涂板,涂布均匀后倒置,于25 ℃连续培养6 d,每隔24 h观察其生长状况,6 d后不同处理组中立枯丝核菌在PDA培养基上的生长状况如图1所示,对PDA培养基上的立枯丝核菌的菌落数和菌落最大直径进行计算和测量。

表1 不同浓度邻苯二甲酸处理Table 1 Groups with different concentrations of phthalic acid

图1 培养6 d后不同处理组中立枯丝核菌在PDA培养基上的生长状况Fig.1 The growth status of Rhizoctonia solani under different treatment groups of phthalic acid on PDA medium after 6 days
称取PDB培养基置于烧杯中,加入蒸馏水,混匀,分装至锥形瓶中,封口,121 ℃高压灭菌20 min备用。配制0.1 g/mL的邻苯二甲酸母液备用。取一定量立枯丝核菌菌丝加入无菌水中重悬,备用。按照表1不同处理组别处理,将其中PDA培养基替换成PDB培养基,25 ℃下在摇床中(120 r/min)恒温黑暗培养立枯丝核菌6 d,每隔24 h观察其生长状况。
2.3 立枯丝核菌代谢物提取与分析
2.3.1 立枯丝核菌代谢物提取
培养6 d后,取1 mL PDB培养基置于EP管中,加入400 μL色谱纯甲醇沉淀蛋白,加入500 μL含0.1%甲酸的80%甲醇水溶液,涡旋震荡,冰浴静置5 min,放入离心机,15 000 r/min,4 ℃离心10 min,取上清液,进样HPLC进行分析。
2.3.2 HPLC检测条件
色谱柱:Water-Symmetry C18柱(4.6 mm×250 mm,5 μm);柱温:25 ℃;进样量:40 μL;检测波长:274 nm;流速:1.0 mL/min;流动相:A相为0.3%甲酸水溶液,B相为甲醇,程序梯度洗脱,见表2。

表2 高效液相色谱仪程序梯度洗脱Table 2 Gradient elution by HPLC
2.3.3 对照品溶液的制备
精密称取邻苯二甲酸对照品5.0 mg,置于10 mL容量瓶中,加入甲醇溶液使溶解,并定容至刻度线,摇匀,配制成浓度为0.5 mg/mL的对照品溶液,4 ℃保存备用。
2.3.4 标准曲线的绘制
将邻苯二甲酸对照品溶液按照2.3.2项下的HPLC检测条件进行检测,以邻苯二甲酸峰面积(Y)为纵坐标,质量(X)为横坐标对邻苯二甲酸进行线性回归拟合,得到回归方程为Y=454 858X-107.14,r2=0.998 1,邻苯二甲酸在0.001~0.015 mg范围内具有良好的线性。
2.3.5 样品中邻苯二甲酸含量测定
将供试品溶液按照2.3.2项下的HPLC检测条件进行检测,以峰面积代入回归方程中计算邻苯二甲酸的含量(表3)。
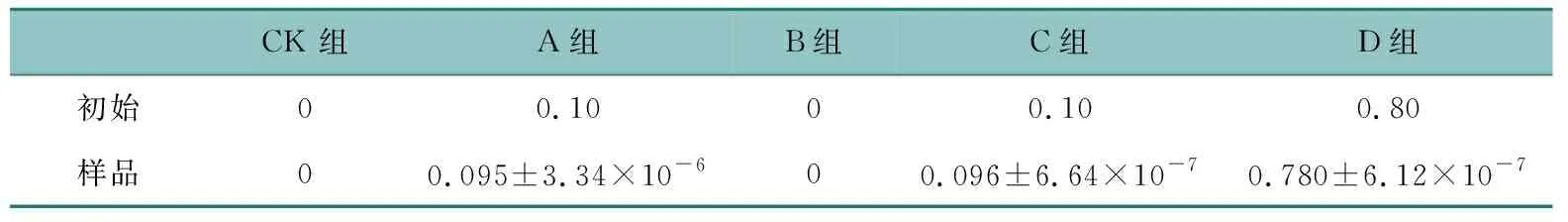
表3 供试品溶液中邻苯二甲酸含量(n=3)Table 3 Phthalic acid content in sample solution(n=3) 单位:mg/mL
3 结果
3.1 丹参样品中邻苯二甲酸酯类成分分析
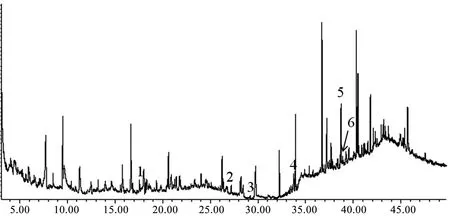
将丹参样品色谱图与标准品色谱图进行保留时间的比较,丹参地上部样品中含有邻苯二甲酸二甲酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯、邻苯二甲酸双-2-2乙氧基乙酯、邻苯二甲酸二环己酯与邻苯二甲酸单(2-乙基己基)酯6种邻苯二甲酸酯类成分(图2),总相对含量为8.264%;丹参地下部样品中含有邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯、邻苯二甲酸双-2-2乙氧基乙酯、邻苯二甲酸二环己酯与邻苯二甲酸单(2-乙基己基)酯5种邻苯二甲酸酯类成分(图3),总相对含量为1.069%。
时间/min1—邻苯二甲酸二甲酯;2—邻苯二甲酸二异丁酯;3—邻苯二甲酸二丁酯;4—邻苯二甲酸双-2-2乙氧基乙酯;5—邻苯二甲酸二环己酯;6—邻苯二甲酸单(2-乙基己基)酯。图2 丹参地上部中邻苯二甲酸酯类化学成分Fig. 2 PAEs in the aboveground portion of Salvia miltiorrhiza Bge.
时间/min1—邻苯二甲酸二异丁酯;2—邻苯二甲酸二丁酯;3—邻苯二甲酸双-2-2乙氧基乙酯;4—邻苯二甲酸二环己酯;5—邻苯二甲酸单(2-乙基己基)酯。图3 丹参地下部中邻苯二甲酸酯类化学成分Fig. 3 PAEs in the underground portion of Salvia miltiorrhiza Bge.
3.2 PDA培养基培养立枯丝核菌
培养6 d后,CK组与A组作为对照组,未加入立枯丝核菌菌液,在相同条件下培养相同时间后对照组未有菌体生成;C组较B组菌落数增加了25.33%,较D组菌落数增加了54.26%,B组较D组菌落数增加了23.08%;当PDA培养基中邻苯二甲酸浓度为适宜浓度(C组)时,立枯丝核菌菌落数最多,当PDA培养基中邻苯二甲酸浓度为高浓度(D组)时,立枯丝核菌菌落数最少(图4)。

图4 不同处理组PDA培养基上立枯丝核菌菌落数统计Fig.4 Colony count of Rhizoctonia solani in PDA medium of different treatment groups
培养6 d后,加入不同浓度邻苯二甲酸的PDA培养基中立枯丝核菌菌落最大直径存在显著性差异(P<0.05),见图5。其中CK组与A组作为对照组,未加入立枯丝核菌菌液,在相同条件下培养相同时间后对照组未有菌体生成;当PDA培养基中邻苯二甲酸浓度为适宜浓度(C组)时立枯丝核菌菌落最大直径平均值最大,为5.21 mm;当PDA培养基中邻苯二甲酸浓度为高浓度(D组)时立枯丝核菌菌落最大直径平均值最小,为1.84 mm;当PDA培养基中未加入邻苯二甲酸(B组)时菌落最大直径平均值为4.07 mm。
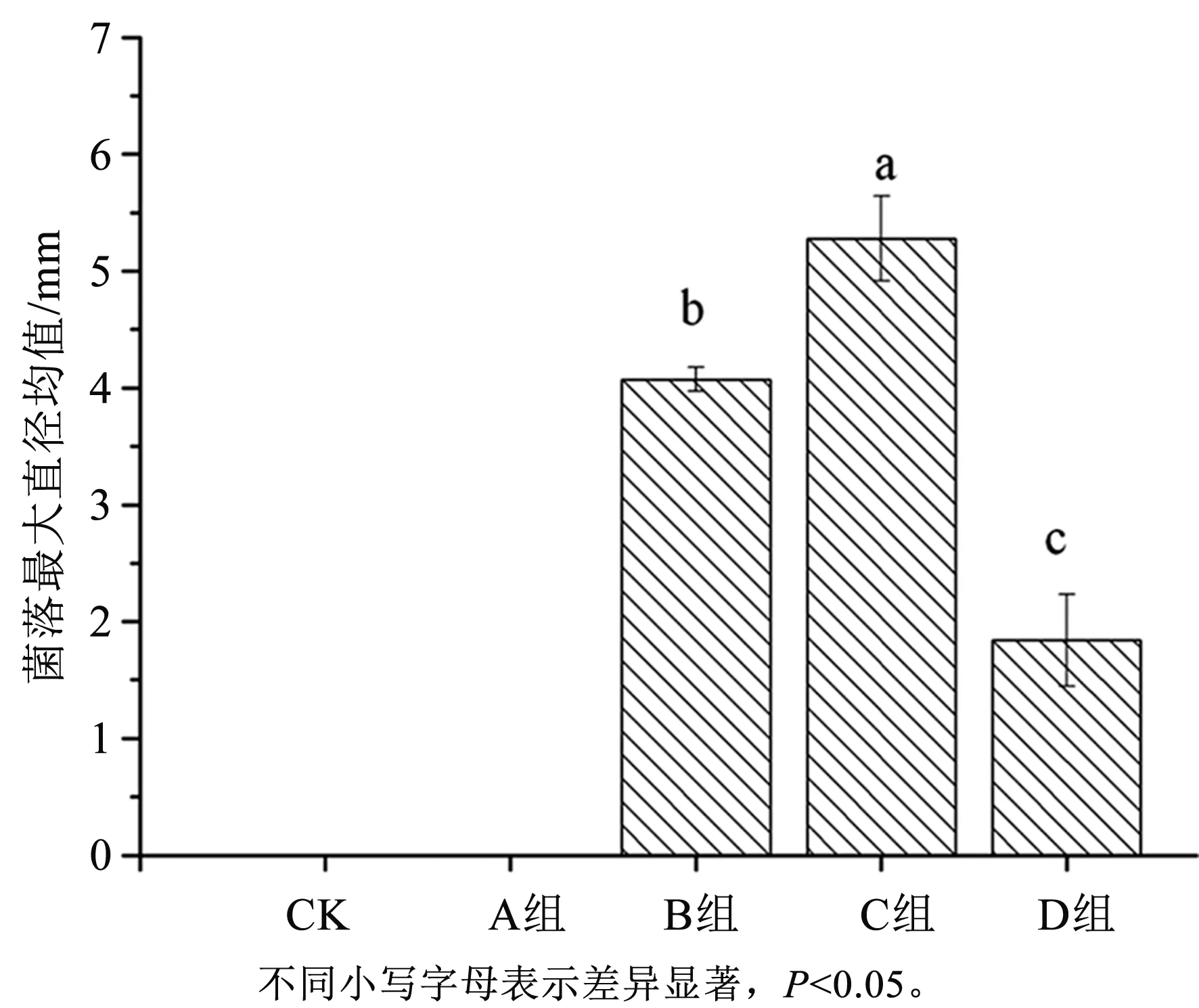
图5 不同处理组PDA培养基上立枯丝核菌菌落最大直径均值Fig.5 The average of maximum diameter of the colony count of Rhizoctonia solani in PDA medium of different treatment groups
3.3 PDB培养基培养立枯丝核菌
培养6 d后,立枯丝核菌生长状况见图6。其中CK组与A组作为对照组,未加入立枯丝核菌菌液,在相同条件下培养相同时间后对照组未有菌体生成。当PDB培养基中邻苯二甲酸浓度为适宜浓度(C组)时立枯丝核菌菌落最多,其质量为17.78 g;PDB培养基中未加入邻苯二甲酸(B组)时,菌落数次之,其质量为14.45 g;当PDB培养基中邻苯二甲酸浓度为高浓度(D组)时立枯丝核菌菌落最少,其质量为5.41 g(图7)。

图6 培养6 d后不同处理组中立枯丝核菌在PDB培养基上的生长状况Fig. 6 The growth status of Rhizoctonia solani in different treatment groups of phthalic acid in PDB medium after 6 days

图7 培养6 d后不同处理组中立枯丝核菌质量Fig.7 The weight of Rhizoctonia solani in different treatment groups of phthalic acid in PDB medium after 6 days
3.4 PDB培养基中立枯丝核菌代谢物分析
不同处理组别PDB培养基中立枯丝核菌代谢物分离色谱图见图8。将样品色谱图与邻苯二甲酸标准品色谱图进行保留时间的比较,A组、C组、D组中均检测出邻苯二甲酸,但通过含量测定发现,与初始加入量相比,3组邻苯二甲酸含量几乎无变化。

时间/min1—对照品;2—PDB培养基供试品。图8 对照品、PDB培养基供试品的HPLCFig. 8 HPLC of reference and PDB medium sample
4 讨论
丹参作为常用大宗药材之一,每年的需求量高达2万吨[3],野生资源无法满足市场的需求量,因此丹参药材的主要来源为人工栽培,而连年的复种造成丹参土壤环境发生改变,丹参产量和品质下降[19-20],连作障碍成为丹参生产过程中亟待解决的问题。
连作丹参土壤中邻苯二甲酸含量相对较高[3],立枯丝核菌丰度增加[13]。立枯丝核菌是造成水稻纹枯病、马铃薯茎基腐病的主要病原菌,也是造成植物立枯病的主要真菌[21]。立枯病作为一种土传病害,是造成连作障碍的重要原因之一[22]。
目前对于丹参连作障碍的研究仅限于土壤病原菌或酚酸类自毒物质[13-14],对于二者之间的研究并未有报道。本研究中将导致丹参连作障碍发生的酚酸类自毒物质邻苯二甲酸与病原真菌立枯丝核菌进行互作研究,通过室内菌丝生长抑制实验发现,邻苯二甲酸对立枯丝核菌的生长具有浓度效应,这与田给林[23]研究的酚酸对草莓尖孢镰刀菌菌丝生长效应结果一致。在相同培养条件下,邻苯二甲酸的加入促进了立枯丝核菌的生长繁殖,但其含量在菌丝生长前后无变化。由此推测邻苯二甲酸会起到类似于催化剂的作用,使立枯丝核菌快速生长并致害丹参,与大田中丹参连作障碍在8月份爆发的现象相符合。通过对邻苯二甲酸与立枯丝核菌菌丝生长互作研究,旨在从酚酸类化感自毒物质与病原菌方面揭示丹参连作障碍产生的原因,为解决丹参连作障碍提供理论依据。
