基于MDCK悬浮细胞灌注培养的流感病毒生产过程开发
2020-11-02吴熠潇ThomasBissingerYvonneGenzel刘旭平UdoReichl谭文松
吴熠潇 Thomas Bissinger Yvonne Genzel 刘旭平 Udo Reichl 谭文松
(1. 华东理工大学 生物反应器工程国家重点实验室,上海 200237;2. Max Planck Institute for Dynamics of Complex Technical Systems,
Germany 39106)
相较于传统的鸡胚生产法,用动物细胞来生产流感疫苗正在逐步成为主流生产方式[1]。近年来,季节性流感疫苗的市场需求正在逐步上升,且在众多接种率较低的国家也有巨大的潜在市场开发前景。自2009年后无大流行流感爆发,却依然对人类社会存在潜在威胁[2-3]。尽管面对日益增长的市场需求和能快速应对大流行流感病毒爆发的需求,细胞培养法生产流感病毒存在着产能低下的问题,制约了这一技术的革新与发展,因此迫切需要提高细胞培养生产流感疫苗的工作效率,主要涉及细胞株筛选、培养基优化、过程优化及强化等方面[4]。
灌注培养是实现过程强化提高过程效率的重要方法之一,相较于传统的批培养和补料培养因其小体积大产能的优势广泛研究于抗体生产领域[5]。灌注培养过程通过灌注速率控制策略对培养体系进行补液,同时以相同的流速将陈旧的培养液排出,却将细胞通过截留装置留在反应器内。近几年来该技术也逐渐被应用于病毒疫苗生产领域来提高病毒产量、过程效率和经济性[6]。目前已有报道通过使用基 于AGE1.CR、CAP、PER.C6、HEK293、MDCK、PBG.PK2.1等细胞介质的灌注培养过程来生产流感病毒,病毒对于细胞介质的敏感性和病毒产量均存在差异[7-10]。MDCK细胞目前仍被认为是最适用于流感病毒扩增的细胞介质之一,但至今使用MDCK悬浮细胞的高密度培养来实现流感病毒的高效和快速扩增还鲜有报道[11-12]。
本研究以悬浮MDCK细胞株为试验对象,通过病毒驯化获得适于在该MDCK细胞株中扩增的工作种毒,继而采用稀释流加的策略评估其在低密度下的生长和产毒表现。然后引进Semi-perfusion模型来模拟MDCK细胞高密度生长和产毒的可行性并研究MOI和胰酶浓度对病毒复制的影响,最后将优化的操作参数应用于反应器体系的ATF灌注培养,实现细胞高密度生长和病毒高效率扩增。
1 材料与方法
1.1 材料
1.1.2 病毒株 原始种毒为模式甲型流感A/Puerto Rico/8/34病毒株(德国Robert Koch Institute),早期在MDCK贴壁细胞(英国ECACC)传代,随后在该MDCK悬浮株中适应传代,其TCID50值为1.8×109virions/mL。
1.2 方法
1.2.1 细胞培养
1.2.1.1 摇瓶培养 种子细胞传代:MDCK悬浮细胞以0.5×106cells/mL的密度接种于工作体积为30 mL的摇瓶中(Corning),置于37℃,5%的CO2条件下进行悬浮培养,转速100 r/min,每隔3 d使用Xeno-CDM1传代一次。摇瓶批式培养:取对数生长期的MDCK种子细胞以1.0×106cells/mL的密度接种于摇瓶中,工作体积为30/50 mL,培养至48 h用于病毒驯化或72 h用于稀释流加病毒感染或48 h用于semi-perfusion培养。使用培养基为Xeno-CDM1。摇瓶高密度(Semi-perfusion)培养 取对数生长期的MDCK种子细胞以1.0×106cells/mL的密度接种于摇瓶中,工作体积为50 mL,培养至48 h用于后续Semi-perfusion培养。使用培养基为Xeno-CDM1。
1.2.1.2 生物反应器中培养 将摇瓶中扩增完毕的MDCK细胞以1.0×106cells/mL的密度接种到1 L DASGIP 反应器中,工作体积为500 mL,细胞生长至62 h时开始灌注培养。当细胞生长至40×106cells/mL的密度时以150 mL/h的灌流速度部分更换反应器内培养基,共2 h。细胞培养所用培养基为 Xeno-CDM2。细胞生长阶段反应器参数设置为:pH为7.15±0.02,DO为40%空气饱和度,温度为37℃,搅拌转速为80 r/min。
1.2.2 病毒感染
1.2.2.1 摇瓶中的病毒感染 病毒驯化:转移培养至48 h的MDCK细胞培养液至离心管,全离心换液后转移回125 mL摇瓶进行病毒感染实验,胰蛋白酶添加量为30 U/mL,以MOI为10-5添加贴壁细胞种毒P0,置于37℃和5% CO2中继续培养至细胞密度最高时收获病毒液作为下一次驯化的悬浮细胞种毒P1。重复上述操作分别获得种毒P2、P3、P4、P5和P6。P6为后续病毒感染实验所用的工作种毒。稀释流加感染:培养至72 h的MDCK细胞培养液,在125 mL摇瓶中采用1∶1稀释流加的方法(15 mL细胞培养液+15 mL新鲜Xeno-CDM1培养基)进行病毒感染实验。胰蛋白酶添加量为30 U/mL,并以MOI为10-3添加悬浮细胞工作种毒P6,置于37℃和5% CO2环境中继续培养。高密度Semi-perfusion病毒感染:将培养至高密度的细胞培养液全离心去上清后加入含有30 U/mL或20 U/mL胰酶的培养基,转移回125 mL的摇瓶后加入MOI为10-1或10-3的工作种毒。5 h后再次全离心换液,之后按照灌注策略进行周期性换液。参数优化实验组设置如表1。

表1 感染阶段不同操作参数实验组设置
1.2.2.2 生物反应器中的病毒感染 灌注培养中培养基更换结束后,在反应器内加入MOI为10-3的种毒和浓度为20 U/mL的胰酶,灌注培养基更换为加入20 U/mL胰酶的Xeno-CDM2。10-20 min等病毒进入细胞后再重新开始培养基的灌流。病毒复制阶段反应器参数设置为:pH为7.20±0.02,DO为40%空气饱和度,温度为33℃,搅拌转速为80 r/min。反应器pH由CO2和空气的混合气体和7.5%的NaHCO3溶液同时控制。
根据上文所说,我们可以知道银行作为经营风险的金融机构,想要在激烈的竞争中脱颖而出就要对风险进行有效地管理控制。而信贷业务是商业银行中最为基础的一个业务,只有保证了信贷风险管理的有效性才能够更好地保证我国商业银行的正常发展。银行只有具备了更强更完善的信贷风险管理体系以及处理风险的能力,才能够树立更加可靠、稳健的市场形象,提升企业在社会中的影响地位,而且也可以更好地吸引市场中潜在的客户群体,有利于企业更好更持久的发展,开拓了银行的业务。
1.2.3 Semi-perfusion培养 以基于细胞特异性灌注速率(Cell-specific perfusion rate,CSPR)的灌注速率控制策略通过在取样点间周期性的部分离心换液进行Semi-perfusion培养,以此满足细胞的营养需求。根据反应器中的连续灌注过程,换液体积计算公式:
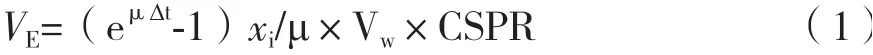
式中,∆t为两取样点的时间间隔(h);μ为细胞比生长速率(h-1);xi为活细胞密度(cells/mL);Vw为工作体积(mL)。
离心换液自接种后48 h开始。细胞计数后根据式(1)计算换液体积,从摇瓶中取出对应体积的细胞培养液于离心管中,离心换液后重悬细胞转移回摇瓶,维持工作体积50 mL。随着细胞密度的上升换液体积增大,直至工作体积的60%。从此时起,固定每次的换液体积,根据公式(1)不断缩小换液时间间隔。计算时CSPR选择为60 pL/cell/d[7](图1)。
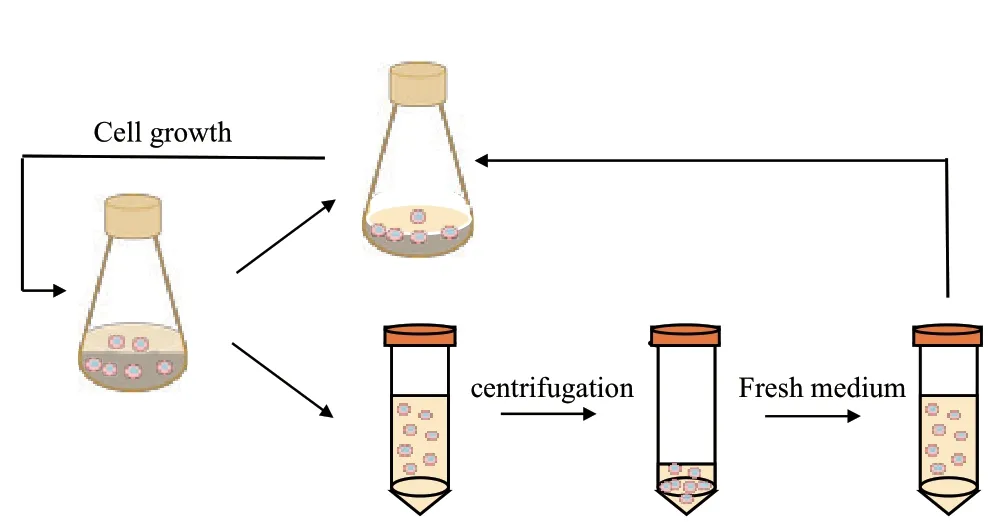
图1 摇瓶中semi-perfusion的操作流程示意图
1.2.4 ATF灌注培养 生物反应器与一个交替切向流(Alternating tangential flow,ATF)过滤中空纤维柱灌注系统(ATF2,德国Repligen)相连接。细胞接种62 h后开启灌注系统和培养基灌流。部分细胞培养液通过灌注系统底部隔膜交替的膨胀和收缩在ATF柱子和连接管中往复运动,无细胞的培养液通过蠕动泵的转动透过ATF膜流向集液瓶。ATF中空纤维膜中的液体流速控制在0.8 L/min。灌注策略中的CSPR为60 pL/cell/d(图2)。
1.2.5 细胞计数 通过台盼蓝染色原理用Vi-CELL(美国Beckman Coulter)自动计数仪测量细胞培养过程中的细胞密度和活性。
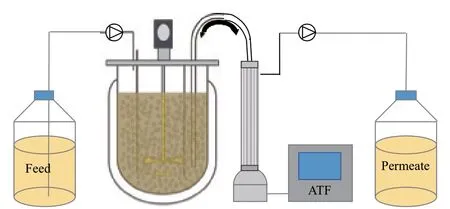
图2 基于ATF系统的灌注培养过程反应器装置设置
1.2.6 病毒滴度检测 总流感病毒颗粒通过Kalbfuss所报道的血凝素(Hemagglutinin,HA)滴度检测方法测定[13]。HA滴度以log10表示。单细胞病毒产量(CSVY)计算如公式(2),单位为virions/cell。
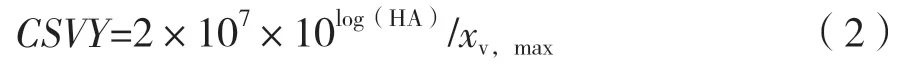
式中,xv,max为病毒复制阶段的最大活细胞密度(cells/mL);HA为 血 凝 素 滴 度[log10(HAU/100 μL)]。
由于病毒复制阶段的多次换液造成的部分病毒液收获,需要计算累积HA滴度,才能对应反应器中的连续灌注过程。计算公式如式(3)。

式 中,HAacc为 累 积HA滴 度(log10(HAU/100 μL);HAh为每次病毒收获液测得的HA滴度(log10(HAU/100 μL);Vh为每次病毒收获液的体积(mL)。
感染性病毒颗粒根据Genzel和Reichl报道的半数组织培养感染剂量(TCID50)检测方法测定,单位为virions/mL[14]。
1.2.7 胞外代谢物检测 葡萄糖、乳酸、谷氨酰胺和氨的浓度由Bioprofile 100 plus(美国Nova medical)通过外部标样校准检测得到。
2 结果
2.1 流感病毒在MDCK悬浮细胞中的驯化
将实验室早期已适应于MDCK贴壁细胞的流感病毒以低MOI 10-5的盲传方式在该MDCK悬浮细胞中进行驯化。经过5代驯化之后的结果如图3所示。HA检测法表征培养液中的总病毒颗粒数。由图3-A可知,每一代的HA滴度都呈现先上升后平稳的趋势(除第3代),达到最大HA值的时间第5代相较第1代缩短了24 h(第1代为60 h,第5代为36 h),表明驯化之后,病毒对细胞的感染与自我复制速率明显加快。5次病毒传代的最大HA滴度分别为3.52、3.49、3.33、3.60、3.59 log10(HAU/100 μL),在 整个驯化过程中最大HA保持稳定。TCID50检测法用来定量培养液中的感染性病毒颗粒数。由图3-B可知,每一代的TCID50滴度在达到最大值后出现了下降的现象,病毒复制过程中的最大TCID50滴度分别为1.78、1.33、1.78、3.16×109virions/mL,表明了驯化过程并没有导致感染性病毒颗粒数的显著减少,而是维持了稳定的水平。
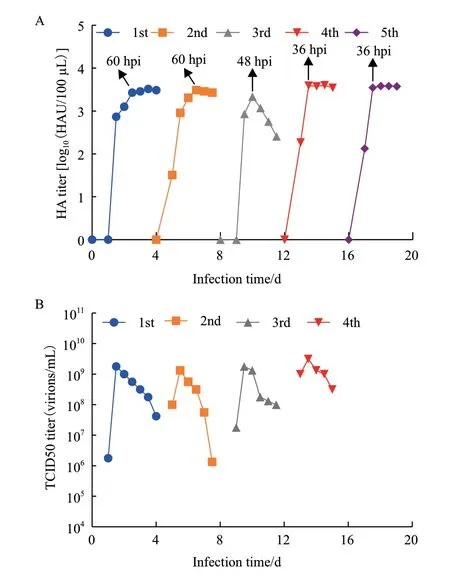
图3 流感病毒在MDCK悬浮细胞驯化过程中的HA滴度(A)和TCID50滴度(B)变化
2.2 稀释流加培养条件下的流感病毒生产
经过病毒驯化获得了能在该MDCK细胞中快速增殖的种子病毒后,在摇瓶中进行了该细胞在稀释流加策略下的生长和产毒表现,结果如图4所示。由图4-A可知,在细胞生长阶段,当以1×106cells/mL的密度接种时,72 h后细胞密度达到(10.35±1.07)×106cells/mL,在此期间呈对数生长,平均比生长速率和倍增时间分别为0.033 h-1和21 h;细胞活性维持在(97.7±0.57)%以上。病毒感染前,由于培养基的1∶1补充细胞密度减半;在病毒复制阶段细胞继续生长一段时间后由于病毒的释放和细胞的裂解细胞密度和活性都迅速下降。由图4-B可知,病毒在细胞内的复制速度快且效率高,在24 hpi时便几乎完成了增殖和释放过程,最大HA滴度为(3.57±0.17)log10(HAU/100 μL)。通过公式(2)计算可得到摇瓶批培养中的病毒感染过程的CSVY为(11 225±1 832)virions/cell。
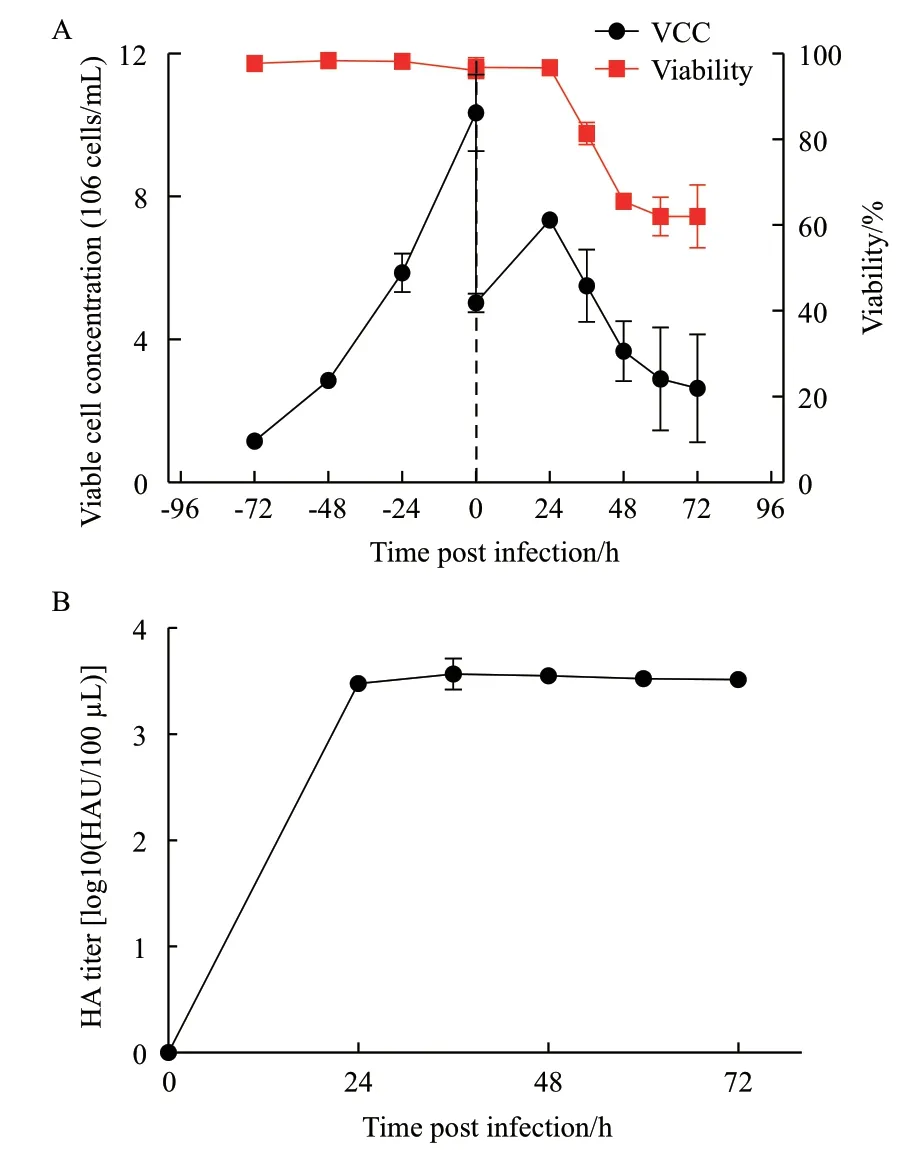
图4 摇瓶中稀释流加培养条件下的细胞密度和活性(A)以及HA滴度(B)
2.3 Semi-perfusion中MDCK细胞的高密度生长与流感病毒生产可行性
分析了该MDCK悬浮细胞低密度生长和产毒过程的特征后,展开了以摇瓶为缩小模型去模拟灌注过程中细胞高密度培养条件下(>15×106cells/mL)生产流感病毒的可行性分析,考察病毒感染复制阶段不同操作参数胰酶浓度和MOI在灌注模式下对于流感病毒扩增的影响,并同时关注流感病毒在高细胞密度条件下扩增时是否出现CSVY下降的现象,即“高细胞密度效应”,结果如图5所示。在预实验中,通过优化灌注策略中的CSPR,确定CSPR为60 pL/cell/d以延长具有高比生长速率的指数生长期,满足细胞高密度生长的营养需求。如图5-A所示,在细胞生长阶段,以1×106cells/mL的密度接种,约130 h后HCD1、HCD2、HCD3三个实验组的细胞可分别生长至43.2、44.0、46.8×106cells/mL,且随着细胞密度的上升,比生长速率下降,最低时仅为0.015/h。在病毒复制阶段,仅HCD3实验组的细胞在病毒感染后继续生长,且密度维持了一段时间至34 hpi后由于病毒的累积才开始下降,说明在高密度情况下高MOI的病毒感染与复制要快于低MOI。通过比较HCD1和HCD2组,可发现高胰酶浓度组在病毒感染后细胞密度出现明显下降,而低胰酶浓度组密度基本维持稳定,说明30 U/mL的胰酶浓度对细胞的伤害会比20 U/mL的胰酶浓度明显。由图5-B可知,有更高MOI的实验组HCD1和HCD2病毒释放较早,在13 hpi时已检测到高滴度3.83、3.81 log10(HAU/100 μL),而较低MOI组HCD3在24 hpi才开始检测到滴度3.72 log10(HAU/100 μL)。3个实验组之后由于细胞的死亡和换液滴度都出现HA滴度下降的趋势。比较HCD1和HCD2组发现了相似的HA滴度生产动力学,因此所选择的两个胰酶浓度对于HA生产的影响作用并不大。通过公式(3)计算得到的不同实验组累积HA滴度没有明显差异,分别为4.05、4.19、4.12 log10(HAU/100 μL),而HCD2实验组的CSVY最高,为7 016 virions/cell,但是仍低于批培养中的CSVY,即出现了“高密度效应。”综合考量,选用MOI 0.001和胰酶浓度 20 U/mL作为后续反应器验证的感染阶段参数。
2.4 基于ATF的生物反应器中的灌注培养过程验证

图5 Semi-perfusion中不同胰酶浓度和MOI对MDCK细胞生长(A)、流感病毒HA滴度(B)和累积HA滴度以及单细胞病毒产量(C)的影响
完成了摇瓶中的细胞高密度生长与流感病毒生产的可行性分析后,进行了ATF生物反应器灌注培养的可行性验证。在Semi-perfusion的结果基础上,调整了培养基的缓冲溶液体系提升了反应器的pH控制,同时也降低了病毒复制阶段的温度。由图6-A和6-B可知,在细胞生长阶段,与Semi-perfusion相似,细胞在反应器中经过136.5 h达到41.2×106cells/mL的密度,也同样出现了比生长速率下降的现象。另外也发现随着培养液渗透压的下降,细胞的直径也相应变小。接毒后,由于降温病毒累积自24 hpi开始,至36 hpi时达到4.23 log10(HAU/100 μL)。此外,在ATF柱子的透过液中也检测到了HA滴度,表明有部分流感病毒通过了ATF膜,未截留在反应器内。通过计算得到累积HA滴度为4.37 log10(HAU/100 μL),相 应 的CSVY为10 083 virions/cell,说 明 反应器灌注培养过程通过降温策略可以缓解甚至克服“高密度效应”。从图6-C可知,灌注速率随着细胞密度的变化而变化,在细胞密度最高时达到了3.12 RV/d,由于每个时间段内灌注速率的值根据该时间段结束时的预期细胞密度计算得到,所以整个培养过程灌注速率呈现一个阶梯式的变化。根据每个时间段所消耗的培养基的体积计算过程中实际的CSPR发现实际CSPR在62-84 pL/cell/d之间(除病毒感染前的2 h换液阶段),说明基于CSPR的灌注速率控制策略效果尚佳。从图6-D可知,葡萄糖和谷氨酰胺在灌注启动前被消耗,在灌注启动后由于新鲜培养基的补给两者浓度处于稳定的状态,分别约为18 mmol/L和3.5 mmoL/L;相应地,代谢副产物乳酸和氨在灌注启动前被生成,之后由于灌注过程中培养基的补入也处于稳定的状态,约为25 mmol/L和3.5 mmol/L。病毒感染初期阶段(<24 hpi),尽管由于培养基的补入,葡萄糖仍被大量地消耗,造成了乳酸的大量生成,高达35.1 mmol/L。
3 讨论
目前用动物细胞来生产流感疫苗存在的产能低下问题制约了该工艺的发展,因此提高过程的生产效率成为了解决这个问题的关键[15-16]。通过灌注培养模式来实现过程强化是提高病毒生产效率的有效途径之一[17]。本研究以一株MDCK悬浮细胞株为研究对象,通过病毒驯化,批培养验证以及灌注培养过程开发,成功地建立了一个高效的流感病毒生产平台,成果讨论归纳于表2。
3.1 病毒驯化是疫苗生产过程的必要步骤
流感病毒在细胞内的驯化通常采用低MOI,因为高MOI的情况下会产生更多的无感染性且不完整的缺陷型病毒颗粒(DP),其中的缺陷型干扰颗粒(DIP)会进一步干扰完整病毒颗粒的复制,导致感染性病毒颗粒的减少[18]。而低MOI情况下生产的种毒感染性颗粒比例更高,因此在作为工作种毒时使用体积更小,且在细胞内复制时受到DIP的干扰也更小。通过病毒驯化加快病毒复制过程的现象也见于Vero和HEK293细胞中[19-20]。根据病毒种类的不同,病毒复制在驯化之后的改善程度也不同,本文中的H1N1株在驯化之后维持了驯化前的病毒滴度,而之前报道的部分黄病毒如MVA和Zika病毒在驯化之后感染性滴度得到了1个log的提升[21]。

图6 ATF灌注培养过程中的细胞密度和病毒HA滴度(A)、细胞直径和培养液渗透压(B)、灌注速率和CSPR(C)以及胞外谷氨酰胺、葡萄糖、乳酸和氨的浓度(D)

表2 MDCK细胞生产流感病毒技术成果表
3.2 MDCK细胞作为流感病毒生产基质的成功运用
提高流感病毒产量的关键在于提高细胞密度和单细胞产量。细胞株筛选、培养基开发和反应器过程控制均可影响细胞密度和单细胞产量。本研究中的MDCK悬浮细胞批培养中生长密度可至千万级别,高于目前已报道的大部分MDCK细胞[20,22-23],且它在该培养基中的CSVY高于11 000 virions/cell,这两者的结合保证了最终的流感病毒高产量。本研究中获得的病毒HA高于目前已有文献报道使用不同的细胞介质如PER.C6、HEK293、PBG.PK2.1生产流感的其他批培养或稀释流加培养过程,再一次验证了MDCK细胞为最佳的候选株之一用于流感病毒的生产[11]。
3.3 过程强化实现了病毒产量的进一步提升
灌注培养在病毒疫苗生产领域近几年发展迅速,基于该株MDCK细胞在低密度培养条件下的优良产毒表现,通过灌注培养实现过程强化,提高病毒产量和产毒效率。以摇瓶或摇管作为Scale-down模型来模拟实际反应器中的灌注过程并进行高密度培养的过程的开发与优化既可实验高通量筛选也降低了操作复杂程度和成本[24]。经过前期的灌注速率优化,CSPR为60 pL/cell/d可支持细胞达到40×106cells/mL的密度。通过此模型可获得更高的细胞密度,但是也会由于频繁的离心与换液造成过程的不稳定,影响细胞的生长。由于选择的灌注策略的影响,细胞密度达到一定水平时换液时间间隔会较小(< 4 h),由此会引起过程中pH、温度、渗透压的不稳定,从而影响细胞生理状态。
MOI对于病毒复制过程有重要影响,在此体系中选用高MOI可缓解由于不断的换液操作带走体系中的病毒颗粒而延缓复制过程的问题,选用低MOI则可以减少大规模生产时的种毒接种量,也可以减少DIP的产生。本研究通过比较MOI 0.1和0.001发现在高密度条件下MOI对于细胞生长和病毒复制的影响与批培养条件有相似性[25]。30 U/mL的胰酶浓度对细胞的伤害明显高于20 U/mL的胰酶浓度,但是并没有发现对病毒产量有明显的抑制作用。通过Semi-perfusion得到的>4 log10(HAU/100 μL)的滴度与已有报道中的另一株MDCK悬浮细胞株病毒产量相似,但是报道缺乏反应器的灌注过程验证[7]。
本研究最后进行了灌注培养的反应器验证及过程表征,反应器中相似的细胞生长曲线验证了Semiperfusion模型模拟反应器培养的可行性,且病毒复制阶段的降温措施提高了CSVY,克服了“细胞密度效应”。根据已有报道,尽管流感病毒的直径(80 nm)小于ATF膜的孔径(0.2 μm),却由于膜对培养液中的细胞碎片、某些蛋白、DNA和化合物的非特异性吸附几乎没有病毒颗粒可以穿过ATF膜进入到透过液中[9]。本研究中却发现了在透过液中约有25%的病毒颗粒,原因可能是由于降温措施减少了培养液中的宿主细胞蛋白和DNA水平,仍需进一步检测培养液蛋白和DNA浓度进行验证。最终获得的累积HA滴度为现有应用反应器灌注培养过程生产流感病毒的报道中最高,而采用MDCK细胞更是首次[8]。目前过程中的灌注速率控制是为半连续,需要人工阶段性地根据细胞密度调整灌注速率,后期的研究可以根据PAT的理论引入在线活细胞密度检测体系去实现灌注速率自动化控制。此外,代谢物检测发现病毒感染阶段乳酸产量较高(约35 mmol/L),其对病毒产量的潜在影响尚不能确定。培养基的“深度”(Depth in medium)优化可改善病毒复制阶段的副产物积累问题,同时也有希望降低整个过程中的CSPR,从而降低培养基消耗量和提高过程经济性[5]。
4 结论
低MOI的病毒驯化可明显加快病毒在细胞内的感染与复制进程,且不影响总病毒滴度和感染性病毒滴度。摇瓶中的稀释流加培养可使细胞密度达千万级别,病毒滴度达(3.57±0.17)log10(HAU/100 μL)。通过Semi-perfusion模型验证了MDCK细胞高密度生长和产毒的可行性,且发现不同MOI和胰酶浓度对病毒感染复制有影响作用。最后通过反应器中的灌注培养使细胞密度高达40×106cells/mL,病 毒产 量 高 达4.37 log10(HAU/100 μL),CSVY为10 083 virions/cell,与批培养过程相当。本工作尝试的结果提升了流感病毒的生产效率,为基于细胞培养的流感疫苗产业化生产提供了新选择。
