蛋氨酸调控畜禽氧化应激的研究进展
2020-11-02刘融崔凯白福恒刁其玉
刘融 崔凯 白福恒 刁其玉
(1. 兰州大学草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,兰州 730020;2. 中国农业科学院饲料研究所 农业农村部
饲料生物技术重点实验室,北京 100081;3. 德州市陵城区白富恒养殖场,德州 250523)
氧化应激(Oxidative stress)是指机体受到外界刺激产生并积累过多自由基所导致的体内氧化还原失衡状态。在生产中,氧化应激引发腹泻等动物性疾病、导致幼畜成活率下降,并对畜禽生产水平和畜产品品质造成严重影响[1]。畜禽产生氧化应激的主要原因包括机体的生理状况、日粮营养水平和环境因素等。
营养物质是动物体内自由基产生的物质基础,也是动物体内清除自由基的物质来源。近年来,关于营养水平与机体健康的研究成为生命科学领域的焦点。2019年,Cell杂志同时发表了3篇文章详细报道了禁食和严重卡路里限制对不同免疫细胞水平和定位及其机制的影响[2-4]。Nature报道密西根大学Ursula Jakob教授团队关于生命早期的氧化应激会让线虫活得更久的最新发现[5]。模式动物日粮中能量和蛋白质摄入限制引起的细胞老化速率降低等现象可能是由蛋氨酸限制引起的ROS产生及氧化损伤的减少导致的[6]。
限制饮食中蛋氨酸可以迅速而有效地改变机体的代谢状态,尤其是以蛋氨酸为中心的代谢路径。多项研究证实,蛋氨酸代谢调控炎症性巨噬细胞活化的免疫代谢,蛋氨酸限制饮食可影响肿瘤的发生和治疗。蛋氨酸对于缓解机体氧化应激,提高机体抗氧化能力具有重要影响[7-8]。MetR可以通过减少线粒体活性氧产生、调控Nrf2、ATF4、AP-1等转录因子介导的关键信号通路以及改变miRNAs表达等方式参与氧化应激的调控,改善氧化状态并在一定程度上促进机体健康。本文综述了氧化应激的产生、蛋氨酸调控氧化应激的机制及信号通路,以期为畜牧生产提供理论指导。
1 氧化应激的产生及影响
1.1 氧化应激的产生机理
体内自由基产生过多,超出机体抗氧化系统的清除能力,机体氧化系统和抗氧化系统失衡,造成细胞与机体氧化损伤,即产生了氧化应激。机体自由基主要包括活性氧族(Reactiveoxygenspecies,ROS)和活性氮族(Reactivenitrogenspecies,RNS)。机体内抗氧化系统包括酶类和非酶类,酶类抗氧化系统主要是超氧化物歧化酶(Superoxidedismutase,SOD)、辅 酶Q、谷 胱 甘 肽 过 氧 化 物 酶(Glutathioneperoxidase,GSH-Px)、谷胱甘肽还原酶(GSSG-R)、谷胱甘肽转移酶(Glutathionetransferase,GST)、过氧化氢酶(Catalase,CAT)等;非酶类抗氧化系统主要有谷胱甘肽、维生素A、维生素C、维生素E、β-胡萝卜素、茶多酚等;另外,体内高浓度的游离氨基酸也可作为活性氧的清除剂[9]。以上物质能够直接清除自由基或通过抵抗自由基发挥作用,进而保护机体免受自由基的伤害。氧化还原状态的判定是必要的,目前通过检测机体本身的氧化还原状态以及组织或血液中的氧化应激代谢产物、抗氧化物质(抗氧化酶和非酶抗氧化剂)可以对机体氧化应激状态进行综合判定[10]。
1.2 氧化应激对机体以及畜禽生产的影响
氧化应激会引发细胞内蛋白质、脂类和DNA等细胞大分子的氧化损伤,造成遗传信息的丢失或改变,也可使细胞膜上不饱和脂肪酸过氧化,改变细胞膜的通透性,破坏细胞稳态[9]。在人类病理学研究中,氧化还原失衡被认为与胰岛素抵抗、动脉粥样硬化、癌症和神经退行性疾病的病因和进展有关[11]。在畜禽生产中,氧化应激导致幼龄畜禽腹泻率上升、抗病力下降,成活率降低;降低成年畜禽的生产性能并对畜禽产品品质造成不利影响[1]。断奶应激过程存在严重的氧化应激并伴随肠屏障功能受损、疾病易感性增加和内分泌失调等问题,Zhu等[12]的研究表明仔猪断奶应激刺激自由基的产生并抑制抗氧化能力。畜禽饲养中的营养及理化环境等因素均是氧化应激的诱因,温雅俐[13]的研究表明,热应激可降低奶牛采食量和营养物质的消化率,降低产奶量。马燕芬等[14]的研究表明,热应激破坏奶山羊瘤胃上皮组织结构,导致瘤胃黏膜屏障通透性增加,降低其生理机能和生产性能。
2 蛋氨酸对氧化应激的影响
蛋氨酸是一种含硫必需氨基酸,是琥珀酰辅酶A、同型半胱氨酸、半胱氨酸、肌酸和肉碱的前体。蛋氨酸具有重要的生理功能,研究表明蛋氨酸除了作为蛋白质合成过程中的起始氨基酸参与机体蛋白质的合成外,还可以影响哺乳动物的先天免疫系统和消化功能,并干预脂质代谢、内源性抗氧化酶(如甲硫氨酸亚砜还原酶A)的激活以及谷胱甘肽的生物合成以对抗氧化应激[15]。
适量添加蛋氨酸可改善畜禽氧化应激状态,仔猪饲喂高水平含硫氨基酸(SAA)(0.85%),总抗氧化能力,超氧化物歧化酶、过氧化氢酶活性增加[16]。李亮[7]的研究表明,蛋氨酸能够显著提高雉鸡血清及肝脏抗氧化能力。蛋氨酸过量添加导致蛋氨酸中毒,危害动物健康导致生产性能的降低[17]。模式动物研究结果多反映出MetR对氧化应激的正面效应,MetR后的高脂日粮小鼠肝脏与血浆中T-AOC和GSH-Px活力显著增加,丙二醛和ROS含量极显著降低,血脂和肝脏脂肪积累也显著降低[8]。虽然MetR可产生如减少内脏脂肪、增加胰岛素敏感性和改善脂质代谢等多种有益的生理效应[18],但MetR日粮会降低体重增长速率,所以很明显,MetR对大型家畜的生产意义不大。王杰[19]的研究表明,相对于蛋氨酸正常添加组,蛋氨酸限制组末重显著降低,料重比显著增加。MetR 显著降低羔羊血清SOD活性,下调羔羊肝脏组织α型谷胱甘肽转移酶(GSTA)、μ谷胱甘肽转移酶(GSTM)、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化相关基因的表达水平。Castellano等[20]的研究表明,日粮蛋氨酸缺乏时生长猪肝脏GSH含量的降低和脂肪组织抗氧化酶活性的增加共同改变了细胞氧化还原状态,该实验中,不同组织的抗氧化酶活性变化趋势并不一致。目前,蛋氨酸对机体氧化应激的影响的研究并未取得一致结果,处理效果与添加剂量以及动物种类密切相关,仍需进一步研究。
3 MetR调控氧化应激的分子机制
MetR对细胞氧化应激的调控是多种机制共同作用的结果,其中主要机制有两种:MetR可减少线粒体中ROS(mtROS)的产生从而降低细胞氧化应激状态;MetR作用于信号通路调控肝脏组织抗氧化基因的表达,从而调控细胞氧化还原状态。
3.1 MetR对线粒体ROS产生的影响
线粒体电子传递链由复合体 I、II、III、IV四个主要的氧化还原复合体酶系组成,其功能是进行生物氧化,并与磷酸化相偶联,共同产生ATP。电子在传递给末端氧化酶之前漏出呼吸链与氧反应生成超氧自由基的过程是线粒体生成活性氧的源头。Chance[21]的报道指出,正常生理状态线粒体活性氧的产生量相当于其耗氧的1%-2%,活性氧会导致脂质、蛋白质及线粒体DNA(mtDNA)等细胞大分子损伤。研究表明,活性氧在线粒体复合物 Ⅰ 和复合物 Ⅲ 中产生[22],位于亲水性复合物 Ⅰ 结构域中的硫铁簇等结构,或位于复合物I的内膜臂中的泛醌是导致复合物I ROS生成的主要电子输运组分;复合物 Ⅲ 的Q0位点的半醌自由基(UQH·)可能是O2生成O2
-·的单电子供体[23]。
大量研究表明,MetR性日粮可以降低线粒体活性氧的产生率,从而降低线粒体氧化损伤[6,24-27]。饲喂80% MetR日粮的大鼠肝脏、心脏线粒体的活性氧生成减少,特别是复合物I产生的活性氧,mtDNA氧化损伤标记物(8-oxodg)浓度降低,线粒体糖氧化损伤标记物(CEL和CML)、脂质氧化损伤标记物(MDAL和CML)、蛋白质氧化损伤标记物(GSA和AASA)含量降低[6,24]。饲喂40% MetR日粮7周后大鼠的心脏、肝脏、脑和肾脏组织以及30%MetR下仔猪的肝脏线粒体也获得了类似的结果[24-26](表1)。在上述研究中,活性氧生成的减少并不是氧通量降低引起的,因为活性氧生成的减少时氧气消耗量往往是不变或者增加的[6,24-26]。线粒体复合物浓度和活力的下降以及线粒体自由基泄露百分比的减少是MetR降低线粒体ROS的产生从而降低氧化损伤的主要原因。另外,部分研究显示线粒体凋亡诱导因子(Apoptosis-inducing factor,AIF)的蛋白质丰度降低[26],但它的变化存在组织特异性[25]。
另外,MetR下模式动物寿命的延长支持线粒体自由基老化理论,许多研究结果认为,长寿物种中存在较低的mtROS产生,对内源性抗氧化剂或蛋白质和DNA修复系统的需求也较小,这样有效降低了能量消耗[22]。研究表明MetR日粮下,线粒体中MnSOD含量不变[22-23]。对此研究者认为,线粒体氧化应激的减少是mtROS产生减少而不是抗氧化酶的增加。MetR作用于线粒体的机制有待于进一步的研究。
3.2 MetR调控氧化应激相关的信号通路
MetR导致蛋氨酸代谢途径发生改变,其中转硫途径的改变导致肝脏GSH含量下降[28],GSH浓度的降低可能作为信号分子调控基因表达。在氧化应激通路中Nrf2、ATF4和AP-1/c-Jun是重要的氧化还原反应转录因子[29]。
3.2.1 核因子NF-E2相关因子(Nrf2) Nrf2-ARE通路是最广泛的抗氧化应激通路之一,是体内最大的抗氧化应激体系。Nrf2是细胞抗氧化反应重要的调控因子,细胞在氧化应激和亲电子物的过量攻击时能够引起Nrf2/Keap1复合物解聚,游离的Nrf2迅速进入细胞核,与小Maf等碱性亮氨酸拉链(bZIP)蛋白形成异二聚体与靶基因中抗氧化应答原件(Antioxidant response element,ARE)序列结合,ARE位于半胱氨酸连接酶催化亚基(Glutamate cysteineligasecatalyticsubunit,GCLC)、血红素氧合酶1(HO-1)和NAD(P)H醌氧化还原酶1(NQO1)以及α和π型谷胱甘肽转移酶(α-GST;GST-π)等许多解毒和抗氧化酶基因的启动子区域[11]。Nrf2与ARE结合可增强抗氧化酶系统相关基因的表达,发挥抗氧化作用,重建细胞氧化还原稳态。研究表明,MAPKs、PI3K/Akt和蛋白激酶C均可在氧化应激下被激活[30]。通过检测MAPK家族中胞外信号调节激酶(ERK)、丝裂原激活蛋白激酶(p38)和c-Jun氨基端激酶(JNK)等转录调节因子的磷酸化水平以及RNA干扰等手段,证实在小鼠肝脏原代细胞中,MetR通过激活ERK参与GST的表达调控[31]。

表1 MetR对动物线粒体氧化应激相关参数变化
二相解毒酶GST(包括A3/5、M1和P1)在肝脏组织中的诱导作用在喂食蛋白质缺乏日粮或蛋氨酸缺乏日粮的大鼠中得到报道[11]。Tsai等[32]的研究表明,GSTP基因在大鼠原代肝细胞中的表达由含硫氨基酸限制特异性诱导上调,而不是通过亮氨酸、异亮氨酸、苯丙氨酸或赖氨酸的限制。Lin等[11]的研究发现,MetR通过ERK-Nrf2-GPEI信号通路上调GSTP基因转录。小鼠对MetR日粮肝转录组学反应的分析表明,蛋氨酸限制性日粮对肝脏转录组的影响主要集中在对肝脏促炎信号转录的下调,以及抗氧化反应上调。肝脏中促炎通路基因表达的减少可能是NFE2l2基因的激活驱动抗氧化反应的结果[33]。
3.2.2 活 化 转 录 因 子4(ATF-4) ATF-4是 一 种bZIP转录因子,由缺氧、内质网应激、氨基酸剥夺和氧化应激等应激信号诱导的,ATF4 与 CCAAT增强子结合蛋白(CCAAT /enhancer-binding protein,C/EBP)形成二聚体,与 C/EBP 激活转录因子应答元件(C/EBPactivating transcription factor response elements,CARE)结合,参与调控氧化应激、氨基酸合代谢、脂质代谢、自噬和血管生成等相关基因的表达[34]。
Kilberg等[35]综述了调控ATF4表达的几种途径,其中MetR可通过PERK/eIF2α/ATF4和GCN2/eIF2α/ATF4通路诱导 ATF4的表达。一般性调控阻遏蛋白 激 酶2(General control nonderepressible 2kinase,GCN2)是氨基酸缺乏的感受器,在维持机体氨基酸平衡相关的信号通路的调节过程中发挥着重要作用,在限制必需氨基酸的细胞外供应或阻断其它非必需氨基酸的合成所诱导的氨基酸反应(AAR)中被激活。几乎每种氨基酸(包括蛋氨酸)氨基酸限制时,细胞内空载tRNA增多,激活GCN2,从而引起 eIF2α 的磷酸化,上调ATF-4的表达[36]。除GCN2外PERK也参与eIF2α 的磷酸化和翻译控制过程[37]。由理化刺激引发的内质网应激(Endoplasmic reticulum stress,ERS)会触发未折叠蛋白反应(Unfolded protein response,UPR)的多条通路,其中包括激活eIF2α的激酶PERK,eIF2α的磷酸化可上调ATF4的合成和下游转录程序。GCN2或PERK的营养传感参与蛋氨酸限制期间对蛋白质平衡长期控制机制,但也有研究表明它们对MetR期间的代谢适应是不必要的[18]。
eIF2α的激酶PERK通常在内质网应激条件被激活,但也有研究指出,在没有内质网应激的情况下,MetR也 可 激 活PERK并 通 过PERK向eIF2α/ATF4和Nrf2传递信号。MetR的结果是通过eIF2α/ATF4激活综合应激反应(ISR)并激活Nrf2敏感抗氧化反应程序[37]。上述机制对MetR诱导的整体应激反应(ISR)具有重要意义,它有助于调节细胞内稳态和生理反应实现MetR期间的代谢适应(图1)。
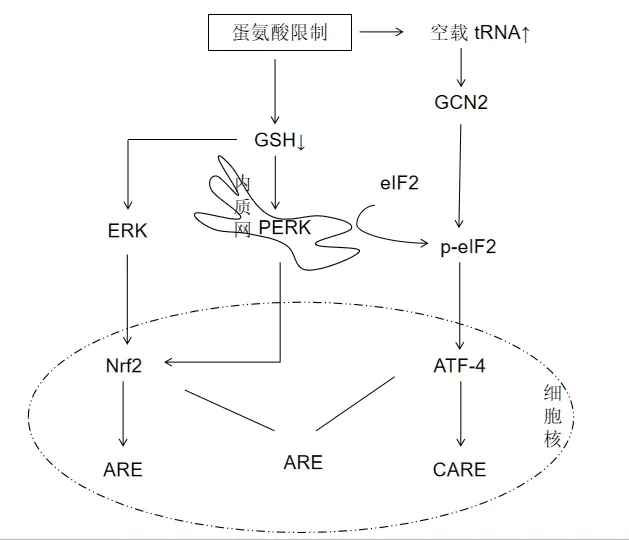
图1 MetR调控Nrf2、ATF-4信号通路
3.2.3 激活蛋白1(AP-1)及其他转录因子 AP-1/c-Jun作为许多细胞内信号级联的靶点,这些级联被细胞外信号分子(如细胞因子、生长因子和激素)或各种物理化学应激源激活。AP-1与细胞增殖、程序性死亡的调节和应激反应有关[38]。研究发现,L-半胱氨酸和/或L-蛋氨酸供应不足降低细胞GSH含量,并激活氧化还原敏感转录因子,包括Nrf2、AP-1和NF-kb[39]。
Tsai等[32]研究表明,限制L-蛋氨酸可能通过GSH耗竭从而激活ERK-AP-1信号通路,AP-1与GSTP增强子I(GPE I)的5'上游区域的TPA反应元件(TPAResponse Element,TRE)结合,上调GSTP基因的表达。
AP-1/c-Jun和ATF4除了单独参与细胞应激下的反应,还可与Nrf2共同作用于氧化还原反应。Nrf2与其他bZIP成员形成二聚体,参与ARE的激活,除了与小Maf蛋白结合外,bZIP蛋白c-Jun(AP-1转录因子的主要成分)和ATF4也可能与Nrf2二聚[29]。Venugopal 和Jaiswal[40-41]的研究表明,c-Jun是Nrf2激活ARE依赖性转录的结合伙伴,而Fos家族的成员是抑制因子。He等[42]的研究表明,ATF4可协同 Nrf2 调控ARE依赖性的Ⅱ相解毒酶和抗氧化酶基因的表达。
3.3 MetR改变小RNA(miRNAs)表达
蛋氨酸水平除了影响DNA 甲基化这种非常普遍的基因表达调控方式,还可能通过调节miRNAs实现营养表观遗传学调控。miRNAs属于短链非编码RNA,在动物体内通常参与转录后基因沉默的调节作用。氧化应激可以改变许多miRNAs的表达水平,但是这些变化如何与氧化应激反应相关却知之甚少。
Engedal等[43]研究发现13种miRNA在人类细胞中受到氧化应激的调节:let-7f、miR-9、miR-16、miR-21、miR-22、miR-29b、miR-99a、miR-125b、miR-128、miR-143、miR-144、miR-155和miR-200c。利用数据库及软件预测了以上miRNA的共同基因靶点和25条共同的细胞通路,并利用功能分析得出miRNA的靶基因主要作用于(蛋白)泛素化途径。
研究表明,miRNAs受蛋氨酸可用性的调节,并可能在代谢中发挥作用[44-45]。摄入MetR日粮(0.12%)的小鼠骨髓中的miR-133a,miR-335-5p和miR-204表达增加,血浆和肝脏中的miR-31表达增加[46]。虹鳟鱼摄入MetR日粮(0.775%)4周,骨骼肌中的miR-133a水平较低[47]。研究者认为,miRNAs在细胞应激反应中起着不可或缺的作用,通过调节miRNAs的数量、miRNAs靶点的数量或miRNAs蛋白复合物的活性等方式介导应激反应,恢复或合成新的体内平衡[48]。
4 结语
蛋氨酸作为必需氨基酸,是动物生长发育不可以缺少的营养素。大量研究证实,蛋氨酸的供给水平与机体氧化应激状态和健康水平息息相关。线粒体结构和功能的变化、Nrf2、ATF4、AP-1等转录因子介导的信号通路的激活以及miRNAs的改变在MetR下氧化还原状态的调控中起关键作用。MetR下线粒体以及信号通路的变化机制的探索对氨基酸营养调控具有重要的理论价值,同时对畜禽健康养殖有重要实际意义。
