σ Factor SigW/Anti-σ Factor RsiW参与东湖假单胞菌HYS对秀丽隐杆线虫毒性作用
2020-11-02伍婷婷桂哲秦迎秋谢志雄
伍婷婷 桂哲 秦迎秋 谢志雄
(武汉大学生命科学学院,武汉 430072)
本实验室前期分离得到一株革兰氏阴性菌,通过生理生化检测和全基因组测序分析,将该菌株命名为Pseudomonas donghuensisHYST[1]。研究发现东湖假单胞菌HYS菌株与常用于宿主感染研究的条件致病菌铜绿假单胞菌(Pseudomonas aeruginosa)PAO1、PA14菌株相比,其能更显著地缩短秀丽隐杆线虫(Caenorhabditis elegans)的寿命,具更强的毒性,这表明东湖假单胞菌HYS中可能存在较为特殊的致病或毒性机制[1-3]。从构建的东湖假单胞菌HYS转座子插入突变库中通过初筛复筛和基因定位后获得一株可能是反σ因子基因位点插入突变株[4]。
假单胞菌中可选择性的σ因子是最重要和常见的调控机制之一[5]。假单胞菌为响应胞外的信号,含有可选择性的σ因子σECF(胞外功能σ因子)的RNA聚合酶则可以起始转录特定基因。例如,毒性基因或毒性相关基因的表达,铜绿假单胞菌中大多数σECF介导的信号通路一般都会与跨膜蛋白反σ因子形成σECF/反σ因子系统,两者共同调节σECF依赖型基因的表达[6-9]。
本研究从已获得的转座子突变株来探讨东湖假单胞菌HYS中的SigW/RsiW(σ因子/反σ因子)参与其对秀丽隐杆线虫的毒性及其可能的调控机制,旨为深入解析假单胞菌致病性调控机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 线虫、菌株、质粒 秀丽隐杆线虫购买于
CaenorhabditisGenetics Center(CGC);Pseudomonas donghuensisHYS实验室保存;Escherichia coliS17-1实验室保存;Escherichia coliOP50(简称OP50)实验室保存。Saccharomyces cerevisiaePJ69-4A、S.cerevisiaePJ69-4α来源于高向东教授赠予。质粒pBBR1-MCS2(简称pBBR2)、pEX18Gm实验室保存。质粒pGAD、pGBDU来源于高向东教授赠予。
1.1.2 引物 本研究中所用引物均由武汉天一辉远生物科技有限公司合成,如表1所示。
1.1.3 培养基 LB培养基,NGM培养基[1]。YPD培养基,SC-Ura固体培养基,SC-Leu固体培养基,SC-Ura-Leu-His固体培养基,SC-Ura-Leu-His-Ade固体培养基,SC-Ura-Leu-His+3-AT固体培养基[10]。
1.2 方法
1.2.1 生物信息分析工具 东湖假单胞菌HYS的核酸以及蛋白序列下载自NCBI网站(CP019396.1,WP_010226811.1,WP_010226809.1)。脱氧核苷酸及蛋白质序列比对:NCBI网站。蛋白跨膜预测:http://www.cbs.dtu.dk/services/TMHMM/。
1.2.2 HYS基因组提取 采用BioMIGA细菌基因组提取试剂盒提取细菌基因组,具体的操作方法参照试剂盒中革兰氏阴性菌的说明书。
1.2.3 菌株对秀丽隐杆线虫的致死作用 配制NGM固体平板,向5个NGM固体平板分别滴加200 r/min振荡过夜培养12 h的200 μL菌液,每个NGM固体菌苔放入20条秀丽隐杆线虫成虫,每种菌株共100条,每隔24 h计数平板中虫子的死活数量,直至全部死亡,其中以Escherichia coliOP50为阳性对照,P. donghuensisHYS为阴性对照,利用SPSS 18.0软件的Kaplan-Meier绘制线虫生存函数曲线,对于非正常死亡的秀丽隐杆线虫记为“censored“,根据SPSS 18.0软件得到的LT50具体数值由origin 9.0软件绘制LT50点状图。
1.2.4 东湖假单胞菌HYS基因敲除方法 设计引物扩增待敲除基因在基因组前后的各约500 bp左右的序列为上下游同源臂片段,分别与敲除载体pEX18Gm连 接,转 化 至Escherichia coliS17-1。E.coliS17-1中的质粒通过细菌接合导入东湖假单胞菌HYS,与HYS基因组发生同源重组,通过PCR检测与基因测序最终确定目标基因是否敲除。
1.2.5 酵母双杂交 将要检测相互作用的蛋白对应的DNA片段扩增,与含AD蛋白的质粒pGAD或含BD蛋白的质粒pGBDU分别连接,分别转化至酵母菌pJ69-4A和pJ69-4α。将带有不同质粒的酵母菌pJ69-4A和pJ69-4α两种菌株分别两两混合,选择携带有两种质粒的二倍体细胞并分别影印到筛选平板上,恒温培养并观察是否有菌苔长出,其中在平板SC-Ura-Leu-His生长代表两蛋白互作弱,在平板SCUra-Leu-His + 5 mmol/L 3-AT生长代表两蛋白互作中等强度,在平板SC-Ura-Leu-His-Ade生长代表两蛋白互作强。
1.2.6 RNA提取及反转录PCR Trizol法提取RNA,用日本TaKaRa公司的试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)将已经提取的总RNA中残留的基因组去除并进行反转录PCR。
1.2.7 荧光定量 采用日本TaKaRa公司的试剂盒(SYBR Premix Ex TaqTMII),在仪器Bio-Rad荧光定
量PCR仪三步法PCR扩增,最后用分析软件Bio-Rad分析基因表达量,本实验中将野生型HYS菌株中目的基因的表达量始终设置为1,用参照基因rpoB作为标准进行相对定量。

表1 本研究中所用引物
2 结果
2.1 基因rsiW参与东湖假单胞菌HYS对秀丽隐杆线虫的毒性
编号为0201 7A的HYS插入突变株喂食秀丽隐杆线虫的LT50为4.739±0.190 d,比野生型HYS能够延长LT50约2 d(图1)。转座子在基因组上插入的位置及生信预测结果如表2和图2所示,0201 7A中插入失活的基因为rsiW,编码反σ因子。

表2 东湖假单胞菌HYS转座子插入突变株
为确定rsiW是否参与HYS菌株毒性,构建ΔrsiW敲除菌株及回补菌株并测定喂食秀丽隐杆线虫后的生存函数。结果发现,喂食ΔrsiW的秀丽隐杆线虫LT50为5.053±0.143 d,与0201 7A突变株一致(图3)。喂食菌株ΔrsiW(pBBR2-rsiW)的秀丽隐杆线虫LT50为3.748±0.078 d,与喂食菌株HYS(pBBR2)的秀丽隐杆线虫LT50基本一致,说明ΔrsiW的缺失突变得到恢复,证实东湖假单胞菌HYS菌株中基因rsiW参与了其对秀丽隐杆线虫的毒性(图3)。
2.2 与反σ因子RsiW作用的σ因子确定
在HYS基因组中基因rsiW前面有一个注释为RNA polymerase subunit sigma-24(σ24)的蛋白基因,RsiW为跨膜蛋白,氨基酸序列83-102是跨膜区域,1-82是膜内N端,103-249是膜外C端(图4),由经典的σ因子/反σ因子系统特征初步推测σ24和RsiW是一对σ因子/反σ因子。
为确定σ24和RsiW是否是一对σ因子/反σ因子,分别将σ24以及RsiW的膜内外片段构建酵母双杂交相关菌株,将构建成功的任意两种不同菌株混合影印到不同的固体培养基上。在SC-Ura-Leu-His、SCUra-Leu-His + 5 mmol/L 3-AT和SC-Ura-Leu-His-Ade培养基上的有菌苔生长情况(图5),显示反σ因子RsiW与σ24存在蛋白互作,且RsiW通过RsiW-N与σ24互作,这说明σ24是其对应的SigW。
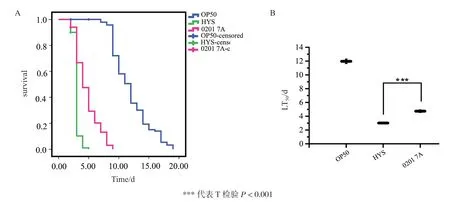
图1 东湖假单胞菌HYS转座子插入突变株喂食秀丽隐杆线虫的生存函数(A)和半致死时间LT50(B)
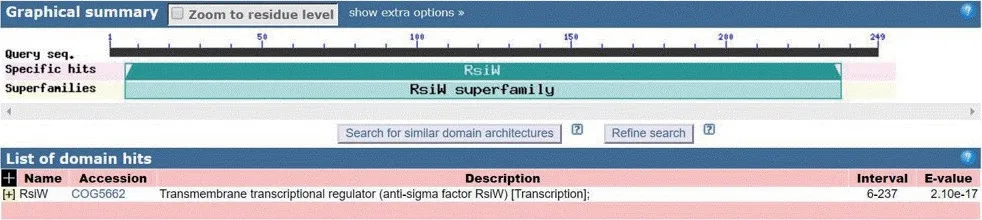
图2 0201 7A菌株基因插入位点蛋白比对
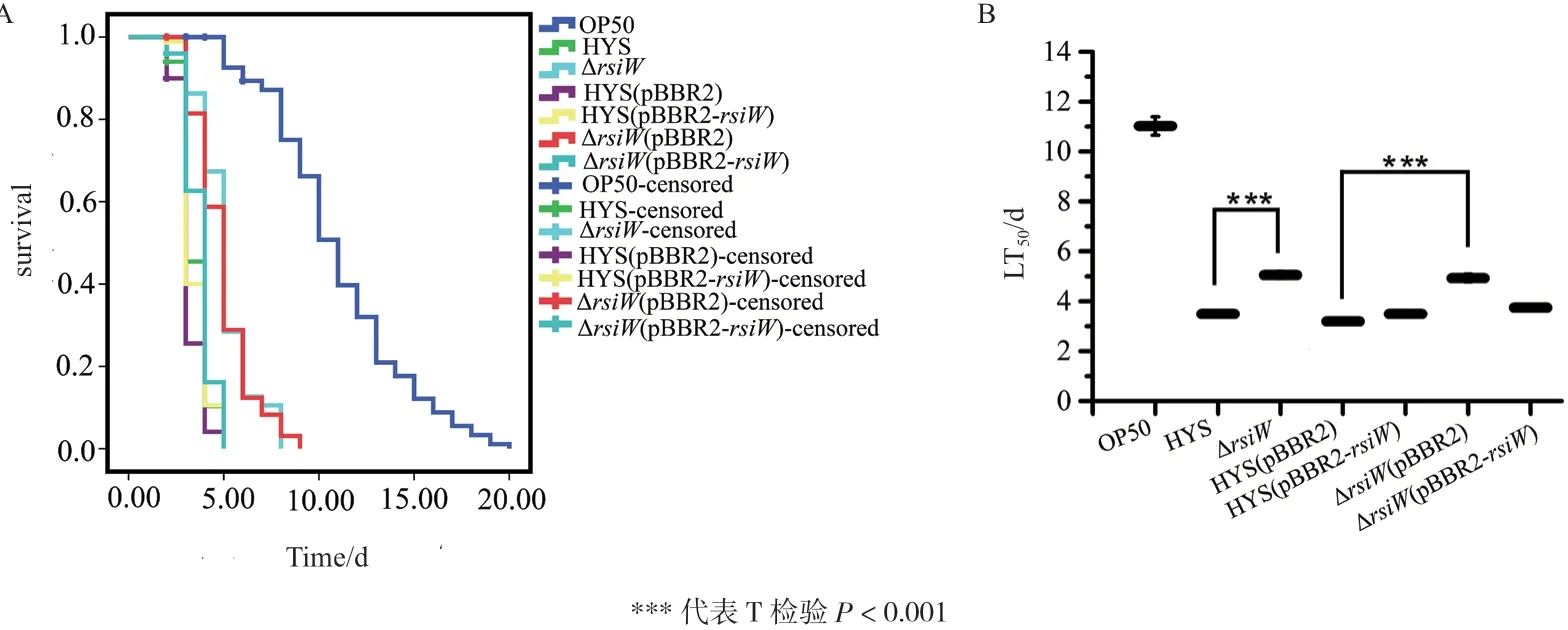
图3 东湖假单胞菌ΔrsiW敲除菌株及回补菌株喂食秀丽隐杆线虫的生存函数(A)和半致死时间LT50(B)

图4 RsiW与RNA polymerase subunit sigma-24(σ24)跨膜预测
2.3 sigW参与东湖假单胞菌HYS对秀丽隐杆线虫毒性
为确定SigW是否参与HYS菌株对秀丽隐杆线虫毒性,构建其敲除菌株及回补菌株并测定喂食秀丽隐杆线虫后的生存函数。喂食ΔsigW的秀丽隐杆线虫LT50为3.728±0.103 d,但喂食ΔsigW(pBBR2-sigW)和HYS(pBBR2-sigW)的LT50分别为5.011±0.228 d和4.656±0.191 d,相对野生型HYS菌株延长约2 d,具有减毒现象(图6-A-B)。荧光定量PCR检测减毒菌株ΔsigW(pBBR2-sigW)和HYS(pBBR2-sigW)中sigW的表达量显著增加,增幅高于rsiW(图6-C)。
与野生型HYS相比,喂食ΔsigW-rsiW的秀丽隐 杆 线 虫LT50为3.335±0.082 d,但 喂 食ΔsigWrsiW(pBBR2-sigW)的LT50为5.820±0.182 d,相对野生型HYS能够延长LT50约2 d,具有减毒现象(图7-A-B)。荧光定量PCR减毒菌株ΔsigW-rsiW(pBBR2-sigW)中仅sigW高表达量(图7-C)。以上结果说明基因sigW参与东湖假单胞菌HYS对秀丽隐杆线虫的毒性,且存在一定的剂量效应。
3 讨论
本研究从转座子插入突变库中筛选出反σ因子RsiW参与东湖假单胞菌HYS对秀丽隐杆线虫的毒性,通过生物信息学分析,酵母双杂交等实验鉴定出与RsiW发生蛋白互作的σ因子SigW,初步确定东湖假单胞菌HYS中存在SigW/RsiW(σ因子/反σ因子),且参与东湖假单胞菌HYS对秀丽隐杆线虫的毒性。假单胞菌毒性方面有关σ因子/反σ因子系统的研究显示,在铜绿假单胞菌中主要发现AlgU/MucA(σ因子/反σ因子)与其致病性紧密相关[11],而在枯草芽胞杆菌168中报道较详细的是SigW/RsiW(σ因子/反σ因子)相互作用,并没有发现其与毒性有相关性[11-15],因此在假单胞菌中SigW/RsiW(σ因子/反σ因子)与毒性有关是一个新的发现。
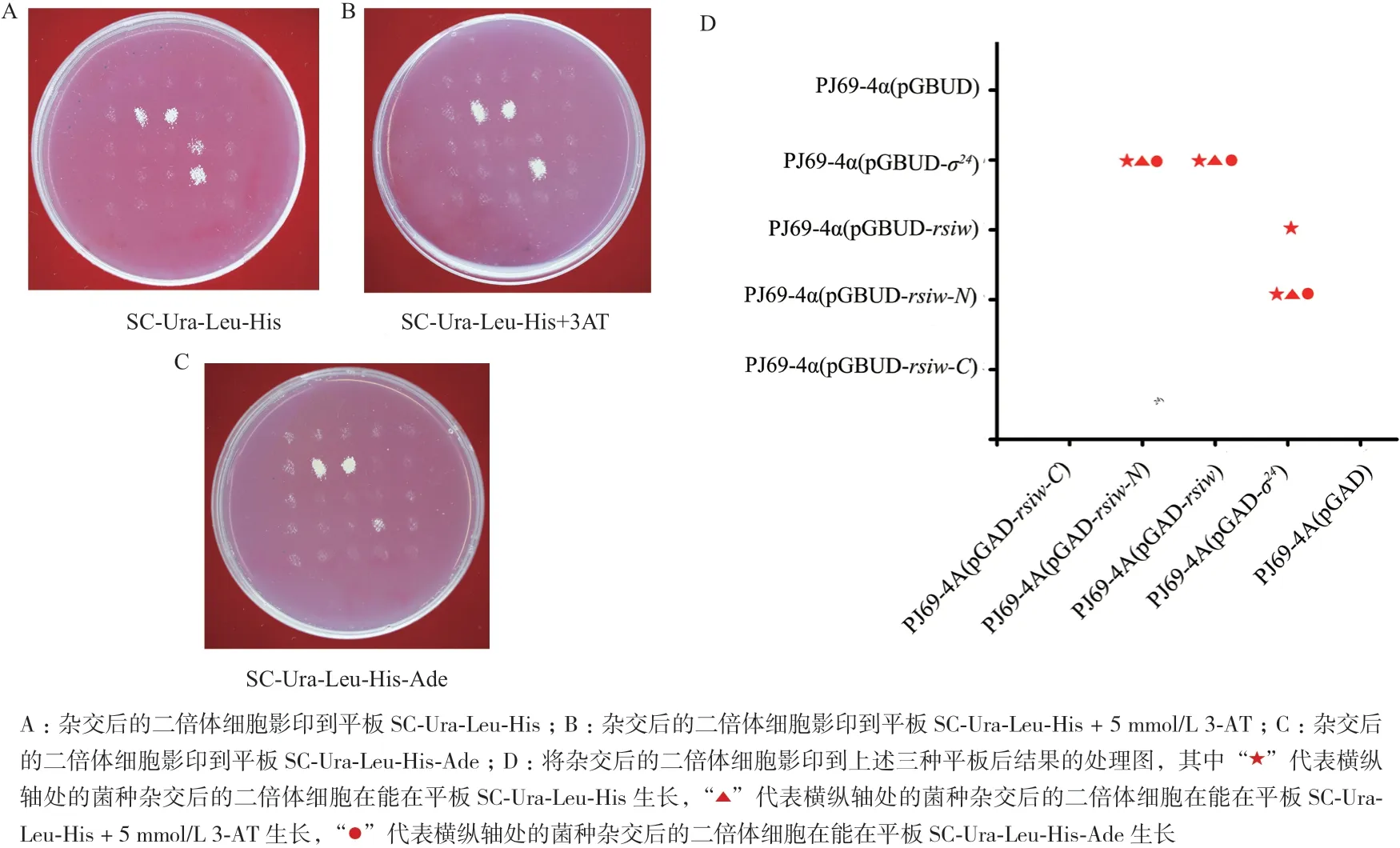
图5 RsiW与SigW酵母双杂交
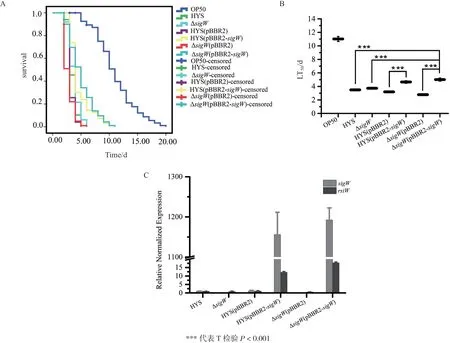
图6 东湖假单胞菌ΔsigW敲除菌株及回补菌株喂食秀丽隐杆线虫的生存函数(A)、半致死时间LT50(B)及荧光定量结果(C)
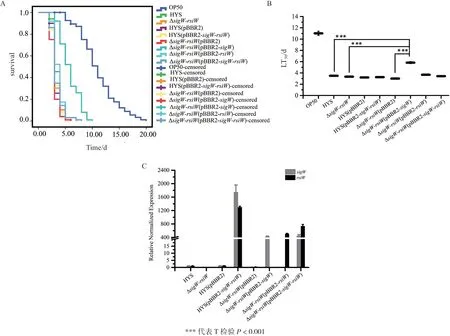
图7 东湖假单胞菌HYSΔsigW-rsiW敲除菌株及回补菌株喂食秀丽隐杆线虫的生存函数(A)、半致死时间LT50(B)及荧光定量结果(C)
研究发现大多数假单胞菌反σ因子是单程跨膜蛋白,作为信号传导的传感器。C端胞外周质域为传感器域,响应周质或外膜中产生的信号;N端胞质域为反σ结构域(ASD),传递信号至对应的σ因子处,约为80-90个氨基酸[7]。在枯草芽胞杆菌中,RsiW通过膜内N端与对应的SigW发生互作[16-17]。HYS菌株的酵母双杂交结果显示RsiW-C不能够与SigW发生互作,而RsiW-N和RsiW能够与SigW发生互作,推测HYS菌株RsiW的胞内N端可能是将C端感应的信号跨膜传到SigW,参与胞外信号响应从而参与毒性。
铜绿假单胞菌中σ因子/反σ因子系统若缺少诱导刺激,反σ因子对σ因子有抑制作用,核心RNA聚合酶不能与σ因子结合,导致下游相关基因不能表达,若过表达σ因子或者给相应的诱导刺激,σ因子亦可调控σ因子依赖型基因的表达[17-20]。一般情况下若假单胞菌中毒性相关σ因子失活,σ因子不能调控相关基因的表达,从而减少假单胞菌的毒性,但是也存在σ因子失活时,假单胞菌的毒性增强的情况[9,21]。本研究结果显示,ΔsigW和ΔsigW-rsiW喂 食 秀 丽 隐 杆 线 虫 的LT50时间与野生型HYS菌株的基本一致,而sigW表达相对rsiW较强时可存在减毒效应,这说明SigW通过RsiW互作参与东湖假单胞菌HYS对秀丽隐杆线虫毒性作用且存在一定的剂量效应,即在东湖假单胞菌HYS菌株中SigW没有被RsiW抑制时,SigW依赖型基因表现出对线虫的减毒效应,但具体是哪些途径基因表达受SigW影响及调控机制,尚需进一步深入探讨。
东湖假单胞菌HYS对模式生物秀丽隐杆线虫具有强烈的毒性,作为潜在的生物致病菌株,其毒性机理目前尚不明确,本研究的可选择的σ因子SigW为探讨东湖假单胞菌HYS菌株中毒力因子调控机制奠定基础,也为未来东湖假单胞菌HYS可能引起的动物感染治疗提供思路。
4 结论
本研究发现东湖假单胞菌HYS存在SigW/RsiW(σ因子/反σ因子),该系统参与秀丽隐杆线虫的毒性,且存在一定的剂量效应,该发现为深入理解假单胞菌致病机制提供了新线索。
