灵芝酸C2调控S6K/SREBPs信号通路对肝细胞脂代谢的影响及机制研究
2020-10-30蒋亚丽袁永董帅高改赵建平王辉
蒋亚丽 袁永 董帅 高改 赵建平 王辉

摘 要 目的:研究灵芝酸C2(GAC2)的体外降脂作用,并基于核糖体S6蛋白激酶(S6K)/固醇调节元件结合蛋白(SREBPs)信号通路探讨其可能机制。方法:以人肝细胞HL-7702为对象,采用MTT法考察低、中、高剂量(5、10、20 μmol/L,下同)GAC2作用后細胞的相对活力;以洛伐他汀为阳性对照,采用酶联免疫吸附测定法检测低、中、高剂量GAC2作用后细胞中胆固醇(TC)、三酰甘油(TG)的含量,并采用尼罗红染色法观察细胞内的脂质堆积情况;转染SREBPs报告基因质粒后,以25-羟基胆固醇(25-HC)为阳性对照,采用荧光素酶报告基因法检测低、中、高剂量GAC2作用后细胞中SREBPs荧光素酶的相对活性;以25-HC为阳性对照,采用实时荧光定量聚合酶链式反应法检测中、高剂量GAC2作用后细胞中SREBPs及其下游基因mRNA的表达情况;以SREBPs抑制剂(25-HC)、S6K抑制剂(雷帕霉素)为参照,采用Western blotting法检测细胞中SREBP-1、SREBP-2的表达情况[以成熟SREBPs(n-SREBPs)表示]以及磷酸化S6K与S6K的相对表达量比值(p-S6K/S6K比值);利用AutoDock 4.0等软件对S6K与GAC2进行分子对接。结果:低、中、高剂量GAC2对细胞相对活力无显著影响(P>0.05)。与空白对照组比较,洛伐他汀组和GAC2高剂量组细胞中TC含量以及洛伐他汀组和GAC2中、高剂量组细胞中TG含量均显著降低(P<0.05或P<0.01),各给药组细胞中的脂滴均有所减少。与空白对照组比较,25-HC组和GAC2低、中、高剂量组细胞中的SREBPs荧光素酶相对活性均显著降低;25-HC组和GAC2中、高剂量组细胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC组细胞中DHCR7基因mRNA,GAC2高剂量组细胞中SREBP-2基因mRNA,25-HC组和GAC2高剂量组细胞中DHCR24、MSMO2基因mRNA的相对表达量均显著降低;25-HC组和GAC2低、中、高剂量组细胞中SREBP-1蛋白的相对表达量,25-HC组和GAC2高剂量组n-SREBP-2蛋白的相对表达量以及霉帕霉素组和GAC2各剂量组p-S6K/S6K比值均显著降低(P<0.05或P<0.01)。分子对接结果显示,GAC2可通过氢键与S6K的氨基酸残基Arg335、Arg330、Ala332结合。结论:GAC2可降低HL-7702细胞的脂质水平,其调控作用可能与抑制S6K/SREBPs信号通路的表达有关。
关键词 灵芝酸C2;核糖体S6蛋白激酶/固醇调节元件结合蛋白信号通路;脂代谢;HL-7702细胞
ABSTRACT OBJECTIVE: To study in vitro lipid-lowering effect of ganoderic acid C2 (GAC2), and to investigate its potential mechanism on the basis of S6K/SREBPs signaling pathway. METHODS: Using human liver cells HL-7702 as objects, MTT assay was used to test relative cell viability after treated with low, medium and high doses (5, 10, 20 μmol/L, hereinafter) of GAC2. Using lovastatin as positive control, ELISA method was used to detect the contents of TC and TG in cells after treated with low, medium and high doses of GAC2. Nile red staining was used to observe the accumulation of lipids in cells. After transfected SREBPs report gene plasmid, using 25-HC as positive control, relative viability of SREBPs luciferase in cells were determined by luciferase assay after treated with low, medium and high doses of GAC2. Using 25-HC as positive control, real-time fluorescent quantitative PCR was used to measure the mRNA expression of SREBPs and their downstream genes in cells after treated with medium and high doses of GAC2. Using SREBPs inhibitor (25-HC) and S6K inhibitor (rapamycin) as control, Western blotting assay was adopted to determine the expression of SREBP-1 and SREBP-2 (in the case of n-SREBPs), relative expression ratio of phosphorylated S6K to S6K (p-S6K/S6K ratio). AutoDock 4.0 and other softwares were used for molecular docking of S6K and GAC2. RESULTS: There was no significant effect of low, medium and high doses of GAC2 on relative cell viability (P>0.05). Compared with blank control group, the content of TC in lovastatin group and GAC2 high-dose group as well as the content of TG in lovastatin group, GAC2 medium- and high-dose groups were decreased significantly (P<0.05 or P<0.01); the number of lipid droplets in the cells of all medication groups decreased. Compared with blank control group, relative viability of SREBPs luciferase in 25-HC group, GAC2 low-, medium- and high-dose groups were decreased significantly; mRNA expression of HMGCS1, MVK, SCD, HMGCR gene in 25-HC group and GAC2 medium-, high-dose groups, mRNA expression of DHCR7 gene in 25-HC group, mRNA expression of SREBP-2 gene in GAC-2 high-dose group as well as mRNA expression of DHCR24 and MSMO2 gene in 25-HC group and GAC2 high-dose group were all decreased significantly; relative protein expression of n-SREBP-1 in 25-HC group, GAC2 low-, medium- and high-dose groups, relative protein expression of n-SREBP-2 in 25-HC group and GAC2 high-dose group as well as p-S6K/S6K ratio in rapamycin group and GAC2 groups were decreased significantly (P<0.05 or P<0.01). The molecular docking results showed that GAC2 could bound to amino acid residues Arg335, Arg330 and Ala332 of S6K via hydrogen bond. CONCLUSIONS: GAC2 can reduce the lipid level of HL-7702 cells, which may be associated with inhibiting the expression of S6K/SREBPs signaling pathway.
KEYWORDS Ganoderic acid C2; S6K/SREBPs signaling pathway; Lipid metabolism; HL-7702 cells
據成人血脂相关数据统计结果显示,2016年我国人群血脂异常的患病率约为40.4%,预计到2030年,血清胆固醇水平的异常升高将导致我国心血管病事件增加约920万例[1]。高血脂症与动脉血管粥样硬化、脑梗死、心肌梗死、2型糖尿病等多种疾病的发生密切相关,已严重威胁到人们的生活健康[2-3]。目前,临床首选的降脂药物以他汀类为主,主要包括洛伐他汀、普伐他汀、阿托他汀、辛伐他汀等,可通过竞争性抑制3-羟基3-甲基戊二酰辅酶A还原酶(HMGCR)来阻断细胞内的羟基甲戊酸代谢通道,从而有效抑制胆固醇的合成[4]。然而,随着临床研究的不断深入,学者发现他汀类药物在发挥降脂作用的同时,还具有诱发肝损伤、肌肉毒性(肌病、肌炎及横纹肌溶解)、糖尿病、胃肠道反应等毒副作用[5-7],使得其应用受到一定限制。因此,寻找安全、有效的降脂药物成为医学研究的热点之一。固醇调节元件结合蛋白(SREBPs)是脂质从头合成的关键转录因子,其下游基因FAS、HMGCR是游离脂肪酸和胆固醇内源性合成的关键限速酶的编码基因,也是降脂药物研发的关键靶点[8]。核糖体S6蛋白激酶(S6K)是SREBPs上游丝氨酸/苏氨酸蛋白激酶,可调控SREBPs的剪切及其进入细胞核的过程,从而促进游离脂肪酸、胆固醇合成限速酶[脂肪酸合成酶(FAS)]和HMGCR的表达[9]。
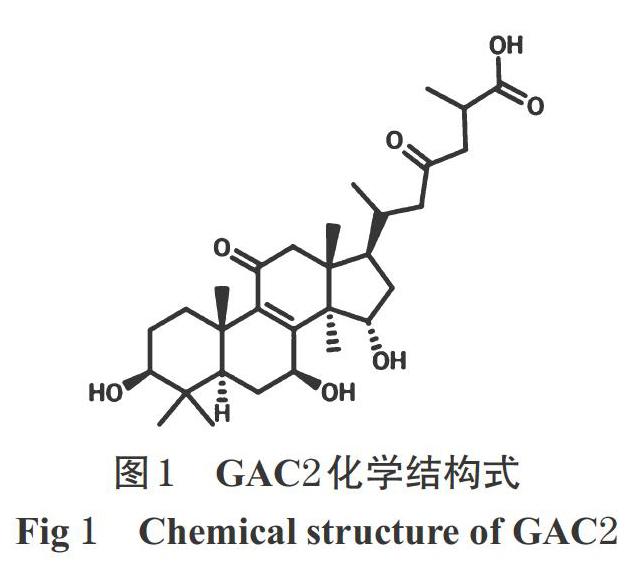
临床实践表明,灵芝具有较好的降脂作用[10]。灵芝酸C2(GAC2,分子式为C30H46O7,化学结构式见图1)是灵芝的主要成分之一,具有增强免疫力、抗肿瘤、抗病毒等药理活性[11-12]。基于此,本研究拟以人肝细胞HL-7702为对象,初步探讨GAC2的体外降脂作用,并基于S6K/SREBPs通路探讨其降脂的可能机制,以期为灵芝活性成分研究及其临床应用提供参考。
1 材料
1.1 仪器
FLUOstar OPTIMA型多功能酶标仪(德国BMG Labtech公司);Gel Doc XR型全能型凝胶成像仪(美国Bio-Rad公司);7500 Fast型实时荧光定量聚合酶链式反应(PCR)仪(美国ABI公司);Series Ⅱ Water Jackxet型CO2细胞培养箱、Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司);SW-CJ-ZF型超净工作台(苏州苏洁净化设备有限公司);Eclipset S100型倒置显微镜(日本Nikon公司);Microfuge 20R型冷冻离心机(美国Beckman Coulter公司)。
1.2 药品与试剂
GAC2对照品(成都普菲德生物技术有限公司,批号:150320,纯度:≥98%);25-羟基胆固醇(25-HC)对照品(批号:H1015,纯度:≥98%)、美伐他汀对照品(批号:M2537,纯度:≥98%)、洛伐他汀对照品(批号:M2147,纯度:≥98%)、雷帕霉素对照品(批号:R0395,纯度:≥98%)均购自美国Sigma公司;青-链霉素双抗、MTT试剂、胰酶、二喹啉甲酸(BCA)蛋白浓度试剂盒(北京索莱宝科技有限公司,批号分别为20191126、725C056、20191128、PC0020);胎牛血清、F-12K Nutrient Mixture培养基(美国Gibco公司,批号分别为42G3279K、1930074);尼罗红染液(上海麦克林生化科技有限公司,批号:C10558414);低脂蛋白血清(LPDS,美国Kalen Biomedical公司,批号:BS042101);RIPA裂解液(上海碧云天生物技术有限公司,批号:P0013B);Poly Jet体外转染试剂(深圳恩科生物科技有限公司,批号:20191126);细胞总胆固醇(TC)、三酰甘油(TG)含量测定试剂盒(北京普利莱基因技术有限公司,批号分别为E1015、E1013);鼠源SREBP-1单克隆抗体(美国Santa Cruz公司,批号:sc-13551);兔源SREBP-2多克隆抗体(英国Abcam公司,批号:ab30682);兔源S6K单克隆抗体、兔源磷酸化核糖体S6蛋白激酶(p-S6K)单克隆抗体(美国Cell Signaling公司,批号分别为2708、9205S);辣根过氧化物酶(HRP)标记的小鼠抗人β-肌动蛋白(β-actin)单克隆抗体、HRP标记的山羊抗小鼠免疫球蛋白G(IgG)二抗、HRP标记的山羊抗兔IgG二抗(武汉三鹰生物技术有限公司,批号分别为66009、SA00001-1、SA00001-2);Hiscript Ⅱ qRT Super MixⅡ逆转录试剂盒(南京诺唯赞生物科技有限公司,批号:R323-01);Power UpTM SYBRTM Green PCR Master Mix试剂盒(美国Thermo Fisher Scientific公司,批号:775498);DMEM高糖培养基(美国Corning公司,批号:10013023);荧光素酶报告基因试剂盒(含报告基因裂解液和报告基因裂解底物,美国Promega公司,批号:0000312919);ECL显色试剂盒(美国Bio-Rad公司,批号:1705061);二甲基亚砜(DMSO)等其余试剂均为分析纯,水为蒸馏水。
1.3 细胞与质粒
人肝细胞HL-7702购自美国模式培养物研究所(ATCC)细胞库;SREBPs报告基因质粒由河南中医药大学中医药科学院谢治深博士惠赠。
2 方法
2.1 细胞培养
将HL-7702细胞置于含10%胎牛血清、1%青-链霉素双抗的DMEM高糖培养基(以下简称“完全培养基”)中,于37 ℃、5%CO2、饱和湿度的培养箱中培养(培养条件下同),隔天换液1次;待细胞生长融合至约80%时,进行传代培养。
2.2 细胞相对活力检测
采用MTT法检测。取对数生长期的HL-7702细胞,用完全培养基调整细胞密度后,以1.2×104个/孔接种于96孔板中,培养24 h后,将其随机分为空白对照组和GAC2低、中、高剂量组(5、10、20 μmol/L,剂量设置参考本课题组前期预试验结果,下同),每组设置5个复孔。空白对照组加入含1‰DMSO的完全培养基100 μL,各给药组加入含相应药物的完全培养基100 μL。培养18 h后,加入5 mg/mL MTT试剂20 μL,继续培养4 h,弃去培养基,每孔加入DMSO 150 μL,振摇10 min,使用全波长酶标仪于490 nm波长处测定各孔的光密度(OD)值,并计算细胞的相对活力:相对活力=(试验组OD值-对照组OD值)/对照组OD值。上述试验重复3次。
2.3 细胞中TC、TG含量检测
采用生化法检测。取对数生长期的HL-7702细胞,按“2.2”项下方法接种于96孔板中,培养24 h后,将其随机分为空白对照组、洛伐他汀组(阳性对照,1 μmol/L,剂量设置参考已有文献[13])和GAC2低、中、高剂量组(5、10、20 μmol/L),每组设置6个复孔。空白对照组加入含1‰DMSO的完全培养基100 μL,各给药组加入含相应药物的完全培养基100 μL。培养18 h后,用胰酶消化,以1 000 r/min离心5 min,收集沉淀,严格按照相应试剂盒说明书方法操作,使用全波长酶标仪于500 nm波长处检测OD值,并以试验组与空白对照组OD值的比值表示TC、TG的含量。上述试验重复3次。
2.4 细胞内脂质堆积情况观察
采用尼罗红染色法[14]观察。取对数生长期的HL-7702细胞,用完全培养基调整细胞密度后,以2.4×105个/孔接种于6孔板中,培养12 h后,按“2.3”项下方法分组,每组设置3个复孔。空白对照组加入含1‰DMSO的完全培养基2 mL,各给药组加入含相应药物的完全培养基2 mL。培养18 h后,用磷酸盐缓冲液(PBS,pH为7.2~7.4)清洗3 min×3次,随后每孔加入100 μg/mL尼罗红染液500 μL,于37 ℃下避光染色10 min后,弃去染液;用PBS清洗后,使用荧光显微镜观察并拍照(染色后,细胞中若有脂质堆积则可见桔红色脂滴[15])。
2.5 细胞中SREBPs荧光素酶活性检测
采用荧光素酶报告基因法[16]检测。取对数生长期的HL-7702细胞,按“2.2”项下方法接种于96孔板中,待细胞铺板融合度超过70%时,将其随机分为空白对照组、25-HC组(阳性对照,1 μmol/L,剂量设置参考已有文献[17],下同)和GAC2低、中、高剂量组(5、10、20 μmol/L),每组设6个复孔。所有组细胞均瞬时转染SREBPs报告基因质粒,并于转染6 h后更换完全培养基,继续培养。次日,弃去各孔上清液,空白对照组加入含1‰DMSO的新鲜培养基(以等体积混合的F-12K Nutrient Mixture培养基和DMEM高糖培养基为基质,并含有5%LPDS、1%青-链霉素双抗、10 μmol/L美伐他汀,下同)100 μL,各给药组加入含相应药物的新鲜培养基100 μL。培养18 h后,弃去培养基,加入报告基因裂解液振摇裂解30 min,随后加入报告基因裂解底物,使用多功能酶标仪于560 nm波长处检测各孔的化学发光值,同时按照BCA蛋白浓度试剂盒说明书方法检测各孔的蛋白含量,并计算SREBPs的荧光素酶相对活性:荧光素酶相对活性=(试验组化学发光值/试验组蛋白含量)/(空白对照组化学发光值/空白对照组蛋白含量)。上述试验重复3次。
2.6 细胞中SREBPs及其下游基因mRNA表达检测
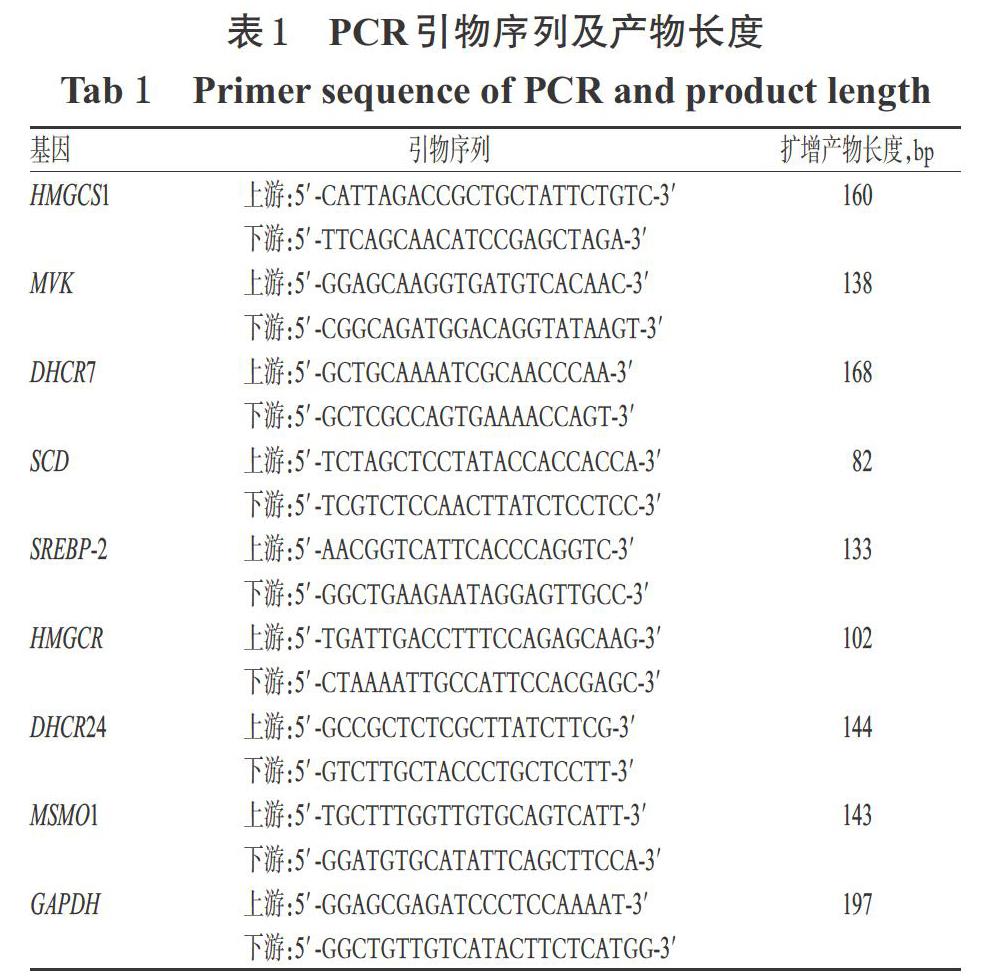
采用实时荧光定量PCR法[18]检测。取对数生长期的HL-7702细胞,按“2.4”项下方法接种于6孔板中,培养12 h后,将其随机分为空白对照组、25-HC组(阳性对照,1 μmol/L)和GAC2中、高剂量组(10、20 μmol/L,为验证“2.5”项下结果暂只设定了中、高剂量),每组设3个复孔。空白对照组加入含1‰DMSO的完全培养基2 mL,各给药组加入含相应药物的完全培养基2 mL。培养18 h后,采用Trizol法提取细胞RNA,按照Hiscript Ⅱ qRT Super MixⅡ逆转录试剂盒说明书转录得cDNA,使用Power UpTM SYBRTM Green PCR Master Mix試剂盒以实时荧光定量PCR仪进行扩增。反应体系(共10 μL):cDNA 4 μL,SYBR Green Mix试剂5 μL,上、下游引物(序列见表1)各0.5 μL。反应条件:50 ℃加热2 min,95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸30 s,共40个循环。以GAPDH为内参基因,采用2-ΔΔCt法分析目标基因mRNA的相对表达量。上述试验重复3次。
2.7 细胞中S6K/SREBPs通路相关蛋白表达检测
采用Western blotting法检测。取对数生长期的HL-7702细胞,按“2.4”项下方法接种于6孔板中,培养24 h后,将其随机分为空白对照组、25-HC组(SREBPs抑制剂,1 μmol/L)、雷帕霉素组(S6K抑制剂,1 μmol/L,剂量设置参考已有文献[19])和GAC2低、中、高剂量组(5、10、20 μmol/L),每组设5个复孔。空白对照组加入含1‰DMSO的完全培养基2 mL,各给药组加入含相应药物的完全培养基2 mL。培养18 h后,弃去培养基,加入RIPA裂解液裂解以提取总蛋白;蛋白于95 ℃变性10 min后,采用BCA法测定蛋白含量。取变性蛋白适量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并湿法转移至聚偏二氟乙烯(PVDF)膜上,以脱脂牛奶室温封闭1 h,加入SREBP-1、SREBP-2、S6K、p-S6K一抗(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;以TBST溶液清洗10 min×4次,随后加入相应二抗(SREBP-1对应HRP标记的山羊抗小鼠IgG二抗,SREBP-2、S6K、p-S6K对应HRP标记的山羊抗兔IgG二抗,稀释度均为1 ∶ 2 000)室温孵育1.5 h,以TBST溶液清洗10 min×4~5次。经ECL试剂显色后,于凝胶成像仪上成像,使用Image J V1.8.0软件分析,以成熟SREBPs(n-SREBPs)与内参(β-actin)条带的灰度值比值表示SREBPs的相对表达量,并记录p-S6K与S6K的相对表达量比值(简称为“p-S6K/S6K比值”)。上述试验重复3次。
2.8 S6K与GAC2的分子对接
采用Chem Draw Ultra 8.0软件绘制GAC2分子结构,利用Chem3D Ultra 8.0软件将其能量优化后作为分子对接配体,随后从蛋白质结构数据库(http://www.rcsb.org/pdb/home/home.do)中查找具高分辨率的S6K蛋白的“PDB”文件作为分子对接受体(PDB编号:4rlp)。使用AutoDock 4.0软件将S6K蛋白受体与GAC2配体进行对接,最后利用Ligplot V.1.4软件进行可视化处理,模拟S6K蛋白受体与GAC2配体之间的相互作用并计算其结合能。结合能数值越小,表明两者相互作用越强[20-21]。
2.9 统计学方法
采用SPSS 17.0软件对数据进行统计分析。所有数据均以x±s表示,组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
3 结果
3.1 GAC2对HL-7702细胞活力的影响
GAC2各剂量组细胞的相对活力与空白对照组比较,差异均无统计学意义(P>0.05),详见表2。
3.2 GAC2对HL-7702细胞中TC、TG含量的影响
与空白对照组比较,洛伐他汀组和GAC2高剂量组细胞中TC含量以及洛伐他汀组和GAC2中、高剂量组细胞中TG含量均显著降低(P<0.05或P<0.01),详见表3。
3.3 GAC2对HL-7702细胞中脂质堆积的影响
空白对照组细胞中可见大量桔红色脂滴;各给药组细胞中的脂滴有所减少,且随着GAC2剂量的增加,脂滴有逐渐减少的趋势,详见图2。
3.4 GAC2对HL-7702细胞中SREBPs荧光素酶相对活性的影响
与空白对照组比较,25-HC组和GAC2低、中、高剂量组细胞中的SREBPs荧光素酶相对活性均显著降低(P<0.05或P<0.01),其相对活性分别下降约61%、19%、30%、34%,有随GAC2剂量增加而降低的趋势,详见表4。
3.5 GAC2对HL-7702细胞中SREBPs及其下游基因mRNA表达的影响
与空白对照组比较,25-HC组和GAC2中、高剂量组细胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC组细胞中DHCR7基因mRNA,GAC2高剂量组细胞中SREBP-2基因mRNA以及25-HC组和GAC2高剂量组细胞中DHCR24、MSMO1基因mRNA的相对表达量均显著降低(P<0.05或P<0.01),详见表5。
3.6 GAC2对HL-7702细胞中S6K/SREB通路相关蛋白表达的影响
与空白对照组比较,25-HC组和GAC2低、中、高剂量组细胞中n-SREBP-1蛋白的相对表达量,25-HC组和GAC2高剂量组细胞中n-SREBP-2蛋白的相对表达量以及雷帕霉素组和GAC2各剂量组细胞中p-S6K/S6K比值均显著降低(P<0.05或P<0.01),详见图3(图中,pre-SREBP-1、pre-SREBP-2表示无活性前体蛋白SREBP-1、SREBP-2)、表6(表中,“-”表示没有加入相应的药物进行干预,故无结果)。
3.7 GAC2与S6K蛋白分子对接情况
分子对接结果显示,GAC2可完全嵌入S6K的结合口袋中,并以氢键与3个氨基酸残基结合,分别为Arg335、Arg330、Ala332;结合能为-6.81 kcal/mol(1 kcal=4.19 kJ),详见图4。
4 讨论
高血脂是指血液中TC或TG含量过高或低密度脂蛋白胆固醇含量异常升高,又或上述多种指标同时增高所引发的全身代谢性疾病,现代医学表明,血脂异常会加速动脉粥样硬化、冠心病等心脑血管疾病的进程[2-3]。因此,如何维持血脂平衡成为亟待解决的重要问题。SREBPs是调节细胞脂质代谢平衡的核转录因子,包括SREBP-1(含SREBP-1c、SREBP-1a)、SREBP-2等亚型。其中,SREBP-1c主要参与调控内源性游离脂肪酸的从头合成,SREBP-2主要调节胆固醇的生产,而目前有关SREBP-1a转录活性的研究较少[22]。SREBPs首先在内质网上形成无活性前体(pre-SREBP),当细胞内TC水平较低时,pre-SREBP与剪切激活蛋白(SCAP)形成复合物[23];該复合物由细胞质被膜复合体Ⅱ(CopⅡ)转运至高尔基体,再经蛋白水解成核内成熟SREBP(n-SREBPs)后,与细胞核中转录结合区域结合,并启动下游HMGCS1、MVK、SCD、HMGCR、SREBP-2、DHCR7、DHCR24、 MSMO1等脂质合成关键基因的转录[24]。有研究指出,SREBPs的转录活性主要受上游S6K蛋白磷酸化的影响[19],当机体营养过剩时,作为调控蛋白生成及葡萄糖平衡维持的重要蛋白激酶S6K被磷酸化,从而促使下游SREBPs剪切入核,最终导致脂质合成增多而诱发肥胖、胰岛素抵抗以及高脂血症[25]。
基于S6K/SREBPs通路在调节脂质平衡中的重要作用,本课题组对GAC2体外降脂作用及可能机制进行了初步探讨。首先,本研究采用MTT法检测了GAC2对HL-7702细胞活力的影响,明确了低、中、高剂量GAC2对细胞均无明显毒性。同时,以HMGCR竞争性抑制剂洛伐他汀为阳性对照,评价了GAC2对HL-7702细胞药效学指标(TC、TG)的影响。结果显示,洛伐他汀组和GAC2高剂量组细胞中TC含量以及洛伐他汀组和GAC中、高剂量组细胞中TG含量均较空白对照组显著降低,且GAC2可不同程度地减少细胞中的脂质堆积。
同时,本研究以SREBPs经典抑制剂25-HC为阳性对照,从转录水平评价了GAC2对SREBPs荧光素酶活性的影响,并采用实时荧光定量PCR法检测了GAC2对SREBPs及下游脂质合成关键基因mRNA表达的影响。结果显示,25-HC组和GAC2各剂量组细胞中的SREBPs荧光素酶相对活力以及各给药组细胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC组细胞中DHCR7基因mRNA,GAC2高剂量组细胞中SREBP-2基因mRNA,25-HC组和GAC2高剂量组细胞中DHCR24、MSMO1基因mRNA的相对表达量均较空白对照组显著降低。值得注意的是,HMGCR是SREBPs下游调控胆固醇内源性合成的限速酶靶基因[26]。故笔者推测,GAC2与SREBPs抑制剂25-HC的降脂作用机制可能是相似的,即通过抑制胆固醇的生物合成从而减少脂质的生成。
为进一步明确GAC2的降脂作用机制,本研究分别以SREBPs经典抑制剂25-HC、S6K经典抑制剂雷帕霉素为阳性对照,评价了GAC2对SREBP、S6K蛋白表达的影响。结果显示,25-HC组和GAC2各剂量组细胞中n-SREBP-1蛋白的相对表达量,25-HC组和GAC2高剂量组细胞中n-SREBP-2蛋白的相对表达量以及雷帕霉素组和GAC2各剂量组细胞中p-S6K/S6K比值均较空白对照组显著降低。这提示GAC2可能通过抑制肝细胞内S6K蛋白的磷酸化,使得下游核内n-SREBPs合成减少,进而抑制SREBPs下游调控脂质合成相关靶基因的转录来发挥降脂作用。此外,分子对接结果显示,GAC2可通过氢键与S6K的氨基酸残基(Arg335、Arg330、Ala332)结合,进一步证实了S6K可能是GAC2的作用靶点。
已有研究表明,灵芝能够有效改善高脂饮食诱导的肥胖及脂质聚集情况[27],但降脂作用机制尚未阐明。本研究结果显示,GAC2可通过抑制S6K/SREBPs信号通路来调控HL-7702细胞的脂质水平,从而发挥降脂作用。本研究为灵芝及GAC2的降脂活性及作用机制的进一步研究提供了有益参考,但尚未通过动物实验予以验证,故有待后续研究进一步完善。
参考文献
[ 1 ] MORAN A,GU D,ZHAO D,et al. Future cardiovascular disease in China:Markov model and risk factor scenario projections from the coronary heart disease policy mo- del:China[J]. Circ Cardiovasc Qual Outcomes,2010,3(3):243-252.
[ 2 ] REN J,GRUNDY SM,LIU J,et al. Long-term coronary heart disease risk associated with very-low-density lipoprotein cholesterol in Chinese :the results of a 15-year Chinese multi-provincial cohort study (CMCS)[J]. Atherosclerosis,2010(211) :327-333.
[ 3 ] The Global Burden of Metabolic Risk Factors for Chronic Diseases Collaboration. Cardiovascular disease,chronic kidney disease,and diabetes mortality burden of cardiometabolic risk factors from 1980 to 2010:a comparative risk assessment[J]. Lancet Diabetes Endocrinol,2014 (2) :634-647.
[ 4 ] 侯晅,戴學文,房志仲.抗高血脂药物的研究进展[J].天津药学,2016,28(4):59-64.
[ 5 ] GUO M,ZHAO J,ZHAI Y,et al. A prospective study of hepatic safety of statins used in very elderly patients[J]. BMC Geriatr,2019. DOI:10.1186/s12877-019-1361-2.
[ 6 ] RAWAT A,KAUSHIK R. Statin induced myopathy:the tip of the iceberg[J]. J Assoc Physicians India,2020,68(1):67.
[ 7 ] HOFFMEISTER T,KAISER J,L?DTKE S,et al. Interactions between atorvastatin and the farnesoid X receptor impair insulinotropic effects of bile acids and modulate diabetogenic risk[J]. Mol Pharmacol,2020,97(3):202- 211.
[ 8 ] DONG XY,TANG SQ,CHEN JD. Dual functions of insig proteins in cholesterol homeostasis[J]. Lipids Health Dis,2012. DOI:10.1186-1476-511X-11-173.
[ 9 ] BIEVER A,VALJENT E,PUIGHERMANAL E. Ribosomal protein S6 phosphorylation in the nervous system:from regulation to function[J]. Front Mol Neurosci,2015. DOI:10.3389/fnmol.2015.00075.
[10] CHU TTW,BENZIE IFF,LAM CWK,et al. Study of potential cardioprotective effects of Ganoderma lucidum (Lingzhi):results of a controlled human intervention trial[J]. Br J Nutr,2012,107(7):1017-1027.
[11] KIMURA Y,TANIGUCHI M,BABA K. Antitumor and antimetastatic effects on liver of triterpenoid fractions of Ganoderma lucidum:mechanism of action and isolation of an active substance[J]. Anticancer Res,2002,22(6A):3309-3318.
[12] 邢康康,刘艳,贺宗毅,等.灵芝酸研究进展[J].重庆中草药研究,2018(2):56.
[13] ZHONG C,FAN L,LI Z,et al. SREBP2 is upregulated in esophageal squamous cell carcinoma and co-operates with c-Myc to regulate HMGCR expression[J]. Mol Med Rep,2019,20(4):3003-3010.
[14] QIN P,WANG Z,LU D,et al. Neutral lipid content in li- pid droplets :potential biomarker of cordycepin accumulation in cordycepin-producing fungi[J]. Molecules,2019. DOI:10.3390/molecules24183363.
[15] ALFOTAWI R,ELSAFADI M,MUTHURANGAN M,et al. A new procedure in bone engineering using induced adipose tissue[J]. J Invest Surg,2019. DOI:10.1080/08941939.2019.1604915.
[16] MIYATA S,INOUE J,SHIMIZU M,et al. Xanthohumol improves diet-induced obesity and fatty liver by suppre- ssing sterol regulatory element-binding protein (SREBP) activation[J]. J Biol Chem,2015,290(33):20565-20579.
[17] IWASE M,WATANABE K,SHIMIZU M,et al. Chrysin reduces the activity and protein level of mature forms of sterol regulatory element-binding proteins[J]. Biosci Biotechnol Biochem,2019,83(9):1740-1746.
[18] 郝轩轩,王新陆,崔琳,等.加参方浸膏对H2O2诱导的H9c2心肌细胞凋亡的干预作用研究[J].中国药房,2018,29(14):1898-1903.
[19] QUAN HY,KIM DY,KIM SJ,et al. Betulinic acid alle- viates non-alcoholic fatty liver by inhibiting SREBP1 activity via the AMPK-mTOR-SREBP signaling pathway[J].Biochem Pharmacol,2013,85(9):1330-1340.
[20] 蓋伟,张燕玲,艾路,等.利用Autodock筛选复方丹参方中HMG-CoA还原酶抑制活性成分:英文[J].中国天然药物,2010,8(1):51-56.
[21] 张海晴,薛鑫,王小龙.桂枝中酚类提取物潜在作用靶点的探索[J].南京中医药大学学报,2019,35(3):319-325.
[22] SHIMANO H,SATO R. SREBP-regulated lipid metabolism:convergent physiology-divergent pathophysiology [J]. Nat Rev Endocrinol,2017,13(12):710-730.
[23] GUO C,CHI Z,JIANG D,et al. Cholesterol homeostatic regulator SCAP-SREBP2 integrates NLRP3 inflammasome activation and cholesterol biosynthetic signaling in macrophages[J]. Immunity,2018,49(5):842-856.
[24] INOUE J,MIYATA S,SHIMIZU M,et al. Isoxanthohumol stimulates ubiquitin-proteasome-dependent degradation of precursor forms of sterol regulatory element-bin- ding proteins[J]. Biosci Biotechnol Biochem,2018,82(9):1591-1598.
[25] OWEN JL,ZHANG Y,BAE SH,et al. Insulin stimulation of SREBP-1c processing in transgenic rat hepatocytes requires p70S6-kinase[J]. Proc Natl Acad Sci,2012,109(40):16184-16189.
[26] SHI J,LI R,LIU Y,et al. Shuangyu tiaozhi granule atte- nuates hypercholesterolemia through the reduction of cholesterol synthesis in rat fed a high cholesterol diet[J]. Biomed Res Int,2019. DOI:10.1155/2019/4805926.
[27] ZHU J,JIN J,DING J,et al. Ganoderic acid A improves high fat diet-induced obesity,lipid accumulation and insulin sensitivity through regulating SREBP pathway[J]. Chem Biol Interact,2018. DOI:10.10168/j.cbi.2018.05. 014.
(收稿日期:2019-12-26 修回日期:2020-05-17)
(编辑:张元媛)
