“汗渍法”炮制对了哥王中芫花素含量及其抗氧化能力的影响
2020-10-30周志容冯果李玮郑传奇许琴任晨晨彭礼珍黄侨宗肖晓燕
周志容 冯果 李玮 郑传奇 许琴 任晨晨 彭礼珍 黄侨宗 肖晓燕

摘 要 目的:比較“汗渍法”炮制前后了哥王乙醇提取物中活性/毒性成分芫花素的含量变化,以及炮制对其抗氧化能力的影响。方法:采用高效液相色谱法测定“汗渍法”炮制前后了哥王药材中芫花素的含量。色谱柱为Diamonsil C18,流动相为0.2%磷酸水溶液-甲醇(梯度洗脱),流速为1 mL/min,柱温为30 ℃,检测波长为346 nm,进样量为20 ?L。将SD大鼠随机分为空白组、了哥王生品乙醇提取物组(317.52 mg/kg,简称“生品组”)和了哥王炮制品乙醇提取物组(317.52 mg/kg,简称“炮制品组”),每组6只。空白组大鼠灌胃等体积1.0%羧甲基纤维素钠溶液,各给药组灌胃相应药物混悬液,灌胃体积均为20 mL/kg,每日1次,连续14 d。采用酶联免疫吸附测定法检测各组大鼠血清氧化应激指标[丙二醛(MDA)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)]的含量。结果:芫花素进样检测量的线性范围为0.147~27.360 μg(r=0.999 9);精密度、重复性、稳定性试验的RSD均小于3%;平均加样回收率为98.64%~98.92%(RSD<1%,n=3)。“汗渍法”炮制前后,了哥王药材中芫花素的平均含量分别为0.377 6、0.234 0 mg/g。与空白组比较,生品组大鼠血清中SOD含量显著升高,CAT含量显著降低(P<0.05或P<0.01);炮制品组大鼠血清中MDA含量显著降低,SOD含量显著升高(P<0.05或P<0.01);且炮制品组MDA含量显著低于生品组,SOD含量显著高于生品组(P<0.05)。结论:经“汗渍法”炮制后,了哥王药材中芫花素的含量有所降低,且抗氧化活性增强;“汗渍法”具有一定的“减毒增效”效果。
关键词 了哥王;汗渍法;芫花素;含量;抗氧化能力;减毒增效
ABSTRACT OBJECTIVE: To compare the content changes of active/toxic ingredient genkwanin in ethanol extract from Wikstroemia indica before and after processing with “sweat soaking method” and the effects of processing method on its anti-oxidation ability. METHODS: HPLC method was adopted to determine the content of genkwanin in W. indica before and after processing with “sweat soaking method”. The separation was performed on Diamonsil C18 column with 0.2% phosphoric acid solution-methanol as mobile phase (gradient elution) at the flow rate of 1 mL/min. The column temperature was 30 ℃ and detection wavelength was set at 346 nm. The sample size was 20 ?L. SD rats were randomly divided into blank group, W. indica raw product ethanol extract group (317.52 mg/kg, called “raw-product group” as short) and W. indica processed product ethanol extract group (317.52 mg/kg, called “processed-product group” as short), with 6 rats in each group. Blank group was given constant volume of 1.0%CMC-Na solution intragastrically, and administration groups were given relevant medicine suspension intragastrically; all of them were given 20 mL/kg, once a day, for consecutive 14 days. The contents of serum oxidant stress indexes (MDA, CAT, SOD) in rats were determined by ELISA. RESULTS: The linear range of genkwanin were 0.147-27.360 μg (r=0.999 9); RSDs of precision, reproducibility and stability tests were all lower than 3%; average recoveries were 98.64%-98.92%(RSD<1%, n=3). Before and after processing with “sweat soaking method”, average contents of genkwanin in W. indica were 0.377 6 and 0.234 0 mg/g. Compared with blank group, the serum content of SOD in raw-product group was increased significantly, while CAT content was decreased significantly (P<0.05 or P<0.01); the serum content of MDA was decreased significantly in processed-product group, while SOD content was increased significantly (P<0.05 or P<0.01). MDA content of processed-product group was significantly lower than that of raw-product group, while SOD content was significantly higher than raw-product group (P<0.05). CONCLUSIONS: After processing with “sweat soaking method”, the content of genkwanin in W. indica is decreased, and antioxidant activity is increased. “Sweat soaking method” processes certain function of “reducing toxicity and increasing efficiency”.
KEYWORDS Wikstroemia indica; Sweat soaking method; Genkwanin; Content; Anti-oxidation ability; Reducing toxicity and increasing efficiency
了哥王Wikstroemia indica (L.) C. A. Mey为瑞香科荛花属植物南岭荛花的干燥根或根皮,始载于《岭南采药录》,性寒,味苦、辛,有大毒,归肺、肝经,具有清热解毒、消肿散结、止痛等功效[1-2],临床上主要用于治疗肝炎、支气管炎、扁桃体炎、肢体疼痛等,同时还可用于治疗肝癌、乳腺癌、肺癌及其他体表癌等[3-6]。目前,从了哥王中分离得到的化合物主要包括香豆素类[7-8]、木脂素类[9]、黄酮类[5,10-11]、蒽醌类[12]、萜类等;其中,芫花素属于黄酮类化合物,具有一定的抗氧化作用[13]。细胞试验初步证实,了哥王也具有抗氧化活性[14],芫花素可能是其抗氧化活性成分之一。然而,芫花素也是该药的毒性成分之一,存在于了哥王毒性部位乙酸乙酯部位[15],有研究表明该化合物具有可遗传毒性[16-18]。苗族群众通常采用“汗渍法”炮制了哥王以降低其毒性。本课题组前期对“汗渍法”进行了深入研究,优选出最佳炮制工艺[19];同时,对了哥王炮制前后的毒理学[20-21]和抗炎作用[3]进行了比较,发现“汗渍法”具有“减毒增效”作用。考虑到芫花素既是了哥王的毒性成分又是活性成分,含有芫花素的毒性中药大多采用醋制法炮制以降低该成分含量[22],而关于“汗渍法”炮制对了哥王药材中芫花素含量的影响尚未见报道。基于此,本研究采用高效液相色谱法(HPLC)测定“汗渍法”炮制前后了哥王乙醇提取物中芫花素的含量,并进行抗氧化作用比较,拟基于“量-效-毒”关系进一步考察“汗渍法”炮制的“减毒增效”作用,为了哥王的炮制方法、质量控制研究和临床应用提供参考。
1 材料
1.1 仪器
1260 Infinity Ⅱ型液相色谱系统(美国Agilent公司);AUW220D型电子天平(日本Shimadzu公司);800Y型粉碎机(浙江大鹏机械有限公司);自动渗漏管(180 mm×1 000 mm,北京仪器厂);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);DZF-6020型减压真干燥箱(上海博迅实业有限公司医疗设备厂);C21-SDHCB47型电磁炉(浙江苏泊尔股份有限公司);HH-S4型水浴锅(北京科伟永兴仪器有限公司);Thermo Multiskan FC型酶标仪(美国Thermo Fisher Scientific公司);MIKRO 220R型高速冷冻离心机(德国Hettich公司);VX-Ⅲ型多管涡旋振荡器(北京踏锦科技有限公司)。
1.2 药品与试剂
了哥王药材(产地:广西玉林,批号:20160115)购自广西壮族自治区玉林市玉林银丰国际中药港,经贵州中医药大学药学院李玮教授鉴定为瑞香科荛花属植物南岭荛花W. indica(L.)C. A. Mey.的根或根皮。
芫花素对照品(北京坛墨质检科技有限公司,批号:111899-201202,纯度:≥98.0%);丙二醛(MDA)试剂盒(批号:20160515)、过氧化氢酶(CAT)试剂盒(批号:20160515)、超氧化物歧化酶(SOD)试剂盒(批号:20160515)均购自南京建成生物工程研究所;戊巴比妥钠(美国Sigma公司,批号:922L0310);甲醇为色谱纯,其余试剂均为分析纯,水为蒸馏水。
1.3 动物
SPF级SD大鼠,雌雄各半,体质量(200±20) g,购自湖南长沙市天勤生物技术有限公司,动物生产许可证号:SCXK(湘)2014-0011。所有大鼠均饲养于12 h光照、12 h避光交替,室内温度(25±1) ℃、相对湿度(50±10)%的环境中,并给予标准饲料和饮用水。
2 方法与结果
2.1 了哥王生品及“汗渍法”炮制品乙醇提取物的制备
参照本课题组前期研究方法[23]制备了哥王生品和“汗渍法”炮制品(以下简称“炮制品”)的乙醇提取物(批号分别为YC20180420、PZ20180430),每100 g醇提物均相当于生药992 g。
2.2 “汗渍法”炮制前后了哥王中芫花素的含量变化
2.2.1 对照品溶液的制备 精密称取芫花素对照品18.4 mg,置于50 mL量瓶中,加甲醇溶解并稀释至刻度,制成质量浓度为0.368 mg/mL的对照品溶液,于4 ℃下保存,备用。
2.2.2 供试品溶液的制备 分别称取了哥王生品乙醇提取物和炮制品乙醇提取物适量,粉碎,取粉末各0.5 g,置于具塞三角烧瓶中,加80%甲醇30 mL,称定质量;密塞,超声(功率:150 W,频率:40 kHz)提取30 min,冷却至室温,再次称定质量,用80%乙醇补足减失的质量,滤过;滤液蒸干,残渣用甲醇溶解并转移至10 mL量瓶中,继续加甲醇稀释至刻度,摇匀,即得供试品溶液。分析前,将供试品溶液用0.45 μm微孔滤膜滤过,取续滤液进样分析。
2.2.3 色谱条件与系统适用性试验 色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:0.2%磷酸水溶液(A)-甲醇(B)(梯度洗脱:0~5 min,65%B→70%B;5~8 min,70%B→75%B;8~15 min,75%B→78%B;15~20 min,78%B→80%B);柱溫:30 ℃;流速:1 mL/min;检测波长:346 nm;进样量:20 ?L。
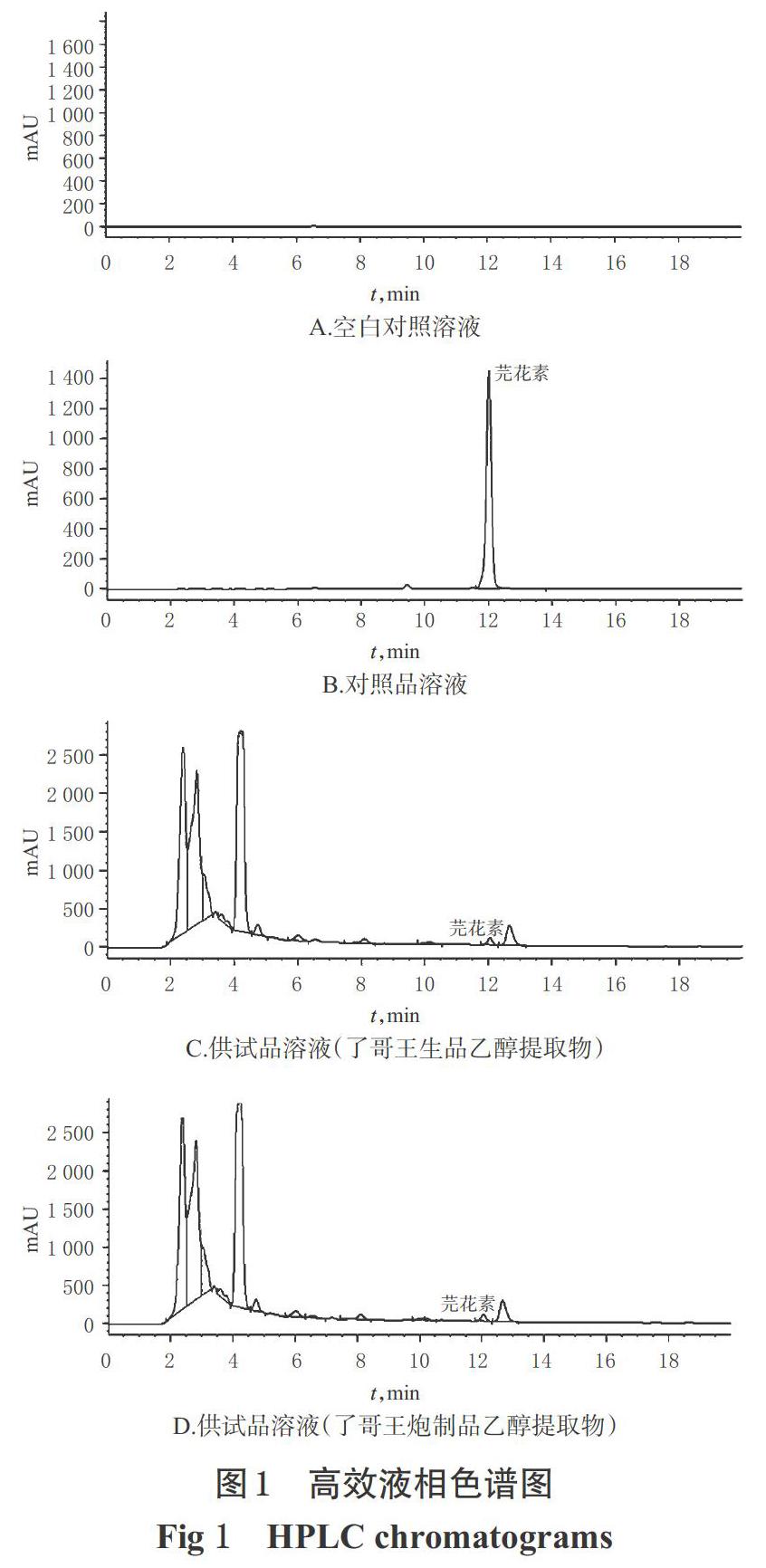
分别取空白对照溶液(以流动相A、B体积比3 ∶ 7配制)、芫花素对照品溶液、供试品溶液各适量,按上述色谱进样分析,记录色谱图,详见图1。由图1可见,在该色谱条件下,芫花素能与其他成分达到较好的分离,分离度大于1.5;理论板数按芫花素峰计不低于3 000。
2.2.4 线性关系考察 分别精密量取“2.2.1”项下对照品溶液0.2、0.5、1、3、5、7、10 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制得系列标准溶液。分别精密吸取上述系列标准溶液各20 μL,按“2.2.3”项下的色谱条件进样分析,记录峰面积。以待测成分的进样量(x, μg)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程为y=2 280.3x-5.984 6(r=999 9)。结果表明,芫花素檢测进样量的线性范围为0.147 2~7.360 μg。
2.2.5 精密度试验 按“2.2.4”项下方法制备质量浓度为2.208 μg/mL的芫花素标准溶液,按“2.2.3”项下色谱条件重复进样6次,记录峰面积。结果,芫花素峰面积的RSD为2.34%(n=6),表明仪器精密度良好。
2.2.6 重复性试验 精密称取了哥王生品乙醇提取物0.5 g,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.2.3”项下色谱条件进样分析,记录峰面积并按标准曲线法计算样品含量。结果,芫花素平均含量为0.375 9 mg/g(RSD=1.12%,n=6),表明本方法重复性良好。
2.2.7 稳定性试验 取“2.2.2”项下了哥王生品乙醇提取物供试品溶液,分别于室温下放置0、2、4、8、12、24、48 h时按“2.2.3”项下色谱条件进样分析,记录峰面积。结果,芫花素峰面积的RSD为1.61%(n=7),表明供试品溶液室温放置48 h内稳定性良好。
2.2.8 加样回收率试验 取已知含量的了哥王生品乙醇提取物0.25 g,共9份,精密称定;分别按已有含量的80%、100%、120%加入芫花素对照品溶液各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.2.3”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果,平均加样回收率为98.64%~98.92%,RSD均小于1%,表明方法准确度良好,详见表1。
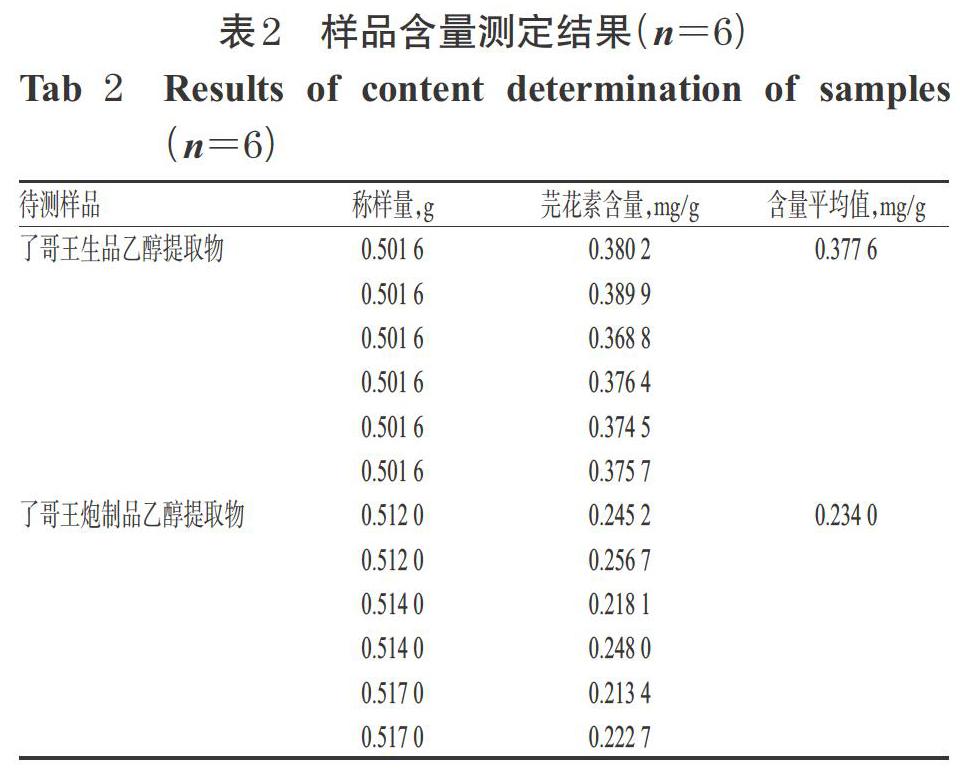
2.2.9 样品含量测定 取了哥王生品和炮制品的乙醇提取物各适量,平行6份,按“2.2.2”项下方法制备供试品溶液,再按“2.2.3”项下色谱条件进样分析,记录峰面积并按标准曲线法计算样品含量,结果见表2。
2.3 “汗渍法”炮制前后了哥王抗氧化能力比较
2.3.1 药液的配制 分别精密称取了哥王生品和炮制品的乙醇提取物0.794 g,加1.0%羧甲基纤维素钠(CMC- Na)溶液稀释,配制成50 mL的提取物混悬液,备用。
2.3.2 剂量设置 了哥王日服剂量为生药量10~15 g[24],以其提取物半数致死量(LD50)[20]折算成生药量为46.678 g(按日用剂量15.0 g计算,相当于日用剂量的3倍)。综合考虑,本研究拟采用2倍日用剂量进行干预,并根据了哥王的提取率(10.08%)[23]以及临床剂量折算方法[25],计算得大鼠灌胃剂量约为317.5 mg/kg(以提取物质量计,下同)。本课题组前期研究结果表明,在此剂量下了哥王无毒副作用且药效稳定[23]。
2.3.3 分组与给药 所有大鼠均适应性饲养1周后,随机分为3组:了哥王生品乙醇提取物组(生品组)、了哥王炮制品乙醇提取物组(炮制品组)和空白组,每组6只。空白组大鼠灌胃等体积1.0%CMC-Na溶液,各给药组大鼠灌胃相应提取物混悬液(317.52 mg/kg),灌胃体积均为20 mL/kg,每日1次,连续14 d。在此期间,所有大鼠均正常饮食、饮水。
2.3.4 抗氧化应激指标检测 末次给药后,禁食不禁水12 h,次日(第15天),大鼠腹腔注射3.0%戊巴比妥钠溶液(0.2 mL/100 g)麻醉后,于腹主动脉取血。血样在室温下静置40 min后,以12 000 r/min离心15 min,分离血清,于-20 ℃保存。采用酶联免疫吸附测定法(ELISA)检测大鼠血清中MDA、CAT、SOD的含量,严格按照试剂盒说明书操作。采用SPSS 25.0软件对数据进行统计分析,计量资料均以x±s表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
结果显示,与空白组比较,生品组大鼠血清中SOD含量显著上升、CAT含量显著降低(P<0.05或P<0.01),而MDA含量虽有所降低,但组间比较差异无统计学意义(P>0.05);炮制品组大鼠血清MDA含量显著降低、SOD含量显著升高(P<0.05或P<0.01),而CAT含量虽有所升高,但组间比较差异无统计学意义(P>0.05)。与生品组比较,炮制品组大鼠血清中MDA含量显著降低、SOD含量显著升高(P<0.05),而CAT含量虽有所升高,但组间比较差异无统计学意义(P>0.05),详见表3。
3 讨论
毒性中药炮制是炮制研究领域的重点,也是难点之一,其目的在于减轻或消除药材的毒副作用、提高其疗效[26]。“汗渍法”又称“身背汗湿法”,为苗族地区的一种特殊炮制法,其具体操作是将药材捆扎于人体腰部,通过人体产生的汗液和体温,以汗液浸渍的方式对药材进行炮制,从而降低其毒性。本课题组在保持民族特色的基础上,模仿人体条件,以人工汗液为辅料炮制了哥王,并优选出具有“减毒增效”的人工“汗渍法”[20]。与民间传统方法相比,该法更加简便、科学且适用于了哥王药材大批量、规范化、规模化炮制。
了哥王中含有丰富的黄酮类化合物。鉴于芫花素既是该药材中的抗氧化有效成分,同时又是毒性成分之一,故本研究以此成分为对象,对炮制前后芫花素的含量和药材的抗氧化活性进行了比较,拟进一步探讨炮制前后了哥王药材毒性与药效之间的关系。
首先,本研究采用HPLC法测定了了哥王药材中芫花素的含量。在前期研究中,本课题组分别选择甲醇、乙腈作为流动相,发现以甲醇洗脱时,芫花素峰形较好、分离度高,因此后续实验选择甲醇作为流动相的有机相。定量分析结果显示,了哥王生品中芫花素的平均含量为0.377 6 mg/g;经“汗渍法”炮制后,炮制品中芫花素的平均含量降至0.234 0 mg/g,提示炮制可降低毒性成分的含量。但其是否与“汗渍法”的“减毒增效”作用有关,还有待后续研究进一步探讨。
作为几乎所有真核生命体中不可或缺的抗氧化酶,SOD能清除生物新陈代谢过程中所产生的超氧阴离子自由基并减少和阻止脂质的过氧化反应,因此其是反映机体抗氧化能力和清除自由基能力的重要实验室指标[27]。CAT能清除体内的过氧化氢,还可以氧化甲醛、苯酚等毒性物质以保护组织和细胞免受氧化损伤,是机体氧化防御系统的关键酶之一[28]。自由基与不饱和脂肪酸发生过氧化反应生成MDA,后者能与膜蛋白的游离氨基发生交联,同时可以破壞膜结构和膜蛋白功能,故MDA的含量可以反映机体过氧化的严重程度以及机体清除自由基的能力[29-30]。有鉴于此,本研究通过检测大鼠血清中SOD、CAT、MDA含量的变化来初步评价了哥王生品和炮制品的抗氧化活性。结果显示,了哥王生品和炮制品的乙醇提取物均可降低大鼠血清MDA含量,但生品提取物对该指标的影响无统计学意义;两者对大鼠血清SOD含量均有显著的提升作用,且炮制品提取物对MDA、SOD的调节作用强于生品提取物。了哥王生品乙醇提取物对大鼠血清CAT含量具有显著的下调作用,而炮制品乙醇提取物对该指标的上调作用轻微。以上结果表明,了哥王生品和炮制品的乙醇提取物均具有增加抗氧化物质SOD含量的作用;炮制品提取物可抑制MDA的表达,而生品提取物对MDA的影响不明显;生品提取物可显著降低CAT的含量,而炮制品提取物对CAT的影响不明显。这可能与“汗渍法”炮制有关:结合前文含量测定结果,炮制品中芫花素的含量有所降低,而抗氧化活性增强且对SOD、MDA、CAT的影响有所不同,笔者认为这可能与“汗渍法”炮制使得了哥王药材活性成分发生了改变,从而影响了其在机体内的代谢过程有关。但芫花素含量变化与了哥王抗氧化活性改变的具体关联及机制还有待进一步确证。
综上所述,本研究进一步完善了“汗渍法”炮制了哥王的“减毒增效”研究,为民间炮制方法“汗渍法”炮制药材提供了实验依据。但由于了哥王炮制前后化学成分变化复杂,其“减毒增效”的具体机制尚不明确,且对炮制前后药材中化学成分的变化,特别是主要毒性成分的研究还不够深入,对内源性代谢物及相关代谢通路的干扰也有待进一步研究。
参考文献
[ 1 ] 张庆荣,夏光成.有毒中草药彩色图鉴[M].天津:天津科技翻译出版公司,2006:131.
[ 2 ] 《全国中草药汇编》编写组.全国中草药汇编:上册[M]. 2版.北京:人民卫生出版社,1996:10-12.
[ 3 ] 张金娟,熊英,李玮,等.了哥王炮制前后的药效比较研究[J].时珍国医国药,2015,26(5):1118-1120.
[ 4 ] 徐骏军,王国伟,熊友香,等.了哥王抗炎有效部位研究[J].江西中医药大学学报,2014,26(6):40-41.
[ 5 ] SHAO M,HUANG XJ,LIU JS,et al. A new cytotoxic biflavonoid from the rhizome of Wikstroemia indica[J]. Nat Prod Res,2016,30(12):1417-1422.
[ 6 ] 姜洪芳,白雪,牛慧彦,等.西瑞香素对肺癌A549细胞侵袭及迁移能力的影响[J].实用药物与临床,2016,19(2):131-134.
[ 7 ] KATO M,HE YM,DIBWE DF,et al. New guaian-type sesquiterpene from Wikstroemia indica[J]. Nat Prod Commun,2014,9(1):1-2.
[ 8 ] 佟立今,孙立新,孙丽霞,等.了哥王化学成分的分离与鉴定[J].中国药物化学杂志,2015,25(1):50-53.
[ 9 ] CHANG H,WANG YW,GAO X,et al. Lignans from the root of Wikstroemia indica and their cytotoxic activity against PANC-1 human pancreatic cancer cells[J]. Fitoterapia,2017. DOI:10.1016/j.fitote.2017.06.012.
[10] HUANG WH,ZHOU GX,WANG GC,et al. A new biflavonoid with antiviral activity from the roots of Wiks- troemia indica[J]. J Asian Nat Prod Res,2012,14(4):401-406.
[11] LI J,LU LY,ZENG LH,et al. A new C-3/C-3″-biflavanone from the roots of Wikstroemia indica[J]. Molecules,2012,17(7):7792-7797.
[12] 邵萌,黄晓君,孙学刚,等.了哥王根茎中的酚性成分及其抗肿瘤活性研究[J].天然产物研究与开发,2014,26(6):851-855、875.
[13] 路晶晶,戚进,朱丹妮,等.白木香叶中黄酮类成分结构与抗氧化功能的相关性研究[J].中国天然药物,2008,6(6):456-460.
[14] 刘倩.有毒中药芫花和了哥王的氧化应激作用机制研究[C]//重庆:2016年第6届全国药物毒理学年会论文集,2016:98-99.
[15] 易文燕,刘明,陈敏,等.了哥王化学成分研究[J].时珍国医国药,2012,23(12):3001-3003.
[16] 文海若,宋捷,刘倩,等. Ames波动试验和GADD45a- GFP GreenScreen两种快速筛选方法评价大黄素和芫花素的遗传毒性[J].药物评价研究,2018,41(5):734-741.
[17] 郭嫦娥,苗培培,陈红影,等. 芫花醇提物对不同种属体系UGTs及UGT1A1活性的影响[J].中国中医药信息杂志,2017,24(4):83-87.
[18] 陈宁,苗培培,郭嫦娥,等.芫花氯仿萃取物对大鼠及人肝微粒体UGTs及UGT1A1活性影响[J].中国中药杂志,2016,41(17):3296-3302.
[19] FENG G,CHEN YL,LI W,et al. Exploring the Q-marker of “sweat soaking method” processed radix Wikstroemia indica:based on the “effect-toxicity-chemicals” study[J]. Phytomedicine,2018. DOI:10.1016/j.phymed.2018.03. 063.
[20] 冯果,李玮,何新,等.苗药了哥王不同炮制品乙醇提取物对小鼠的急性毒性作用比较[J].中国药房,2017,28(25):3536-3540.
[21] 张金娟,李玮,王建科,等.了哥王生品及2种炮制品的急性毒性比较研究[J].中国中药杂志,2011,36(9):1172- 1174.
[22] 吴春娥.芫花不同炮制品中芫花素含量的研究[J].世界中西医结合杂志,2014,9(10):1054-1055、1077.
[23] 郑传奇,冯果,李玮,等.苗药了哥王“汗渍法”炮制前后抗小鼠免疫性炎症的“量-效-毒”关系研究[J]. 中国药房,2020,31(6):661-665.
[24] 卫生部药典委员会.中华人民共和国药典:一部[S]. 1977年版.北京:人民卫生出版社,1977:16.
[25] 徐叔云,卞如濂.药理实验方法学[M]. 3版.北京:人民卫生出版社,2002:227-229.
[26] 罗洪瑜. 中药毒性在炮制后的影响和临床应用[J].临床合理用药杂志,2019,12(11):24、118.
[27] KE SR,LIU Q,YAO YH,et al. An in vitro cytotoxicities comparison of 16 priority polycyclic aromatic hydrocarbons in human pulmonary alveolar epithelial cells HPAEpiC[J]. Toxicol Lett,2018. DOI:10.1016/j.toxlet. 2018.03.005.
[28] TENG Y,ZHANG H,LIU RT. Molecular interaction between 4-aminoantipyrine and catalase reveals a potentially toxic mechanism of the drug[J]. Mol Biosyst,2011,7(11):3157-3163.
[29] KM N,ZARINA A,MIR YA,et al. A study on correlation between oxidative stress parameters and inflammatory markers in type 2 diabetic patients with kidney dysfunction in north Indian population[J]. J Cell Biochem,2019,120(4):4892-4902.
[30] IMEN R,KHAOULA T,SAFA B,et al. Effects of mercury graded doses on redox status,metallothionein levels and genotoxicity in the intestine of sea cucumber Holothuria forskali[J]. Chem Ecol,2019,35(3):204-218.
(收稿日期:2020-04-06 修回日期:2020-07-01)
(編辑:张元媛)
