二苯乙烯苷对APP/PS1/Tau三转基因痴呆小鼠JNK和PP2B的调控作用研究
2020-10-30吴文雪苏彦兆刘超宇谭俊杰李振中黄健朱晓莹廖艳花黄忠仕
吴文雪 苏彦兆 刘超宇 谭俊杰 李振中 黄健 朱晓莹 廖艳花 黄忠仕


摘 要 目的:研究二苯乙烯苷(TSG)對APP/PS1/Tau三转基因痴呆(3×Tg-AD)小鼠c-Jun氨基末端激酶(JNK)、钙调神经磷酸酶(PP2B)的调控作用,探索该药抗阿尔茨海默病(AD)的可能机制。方法:将45只雄性3×Tg-AD小鼠随机分为模型组、阳性对照组(石杉碱甲,0.15 mg/kg)和TSG低、中、高剂量组(0.033、0.1、0.3 g/kg),每组9只;另取9只正常雄性C57BL/6J小鼠作为正常对照组。各给药组小鼠灌胃相应药物,每天给药1次,连续给药 60 d;正常对照组和模型组小鼠灌胃等量生理盐水。给药结束后,通过Morris水迷宫实验测定各组小鼠的空间学习记忆能力,采用尼氏染色法观察小鼠大脑皮层和海马部位尼氏小体变化情况,并分别采用实时荧光定量-聚合酶链式反应法和Western blotting法检测小鼠脑组织中JNK、PP2B的mRNA及蛋白表达情况。结果:与正常对照组比较,模型组小鼠逃避潜伏期显著延长(P<0.01),原平台象限停留时间显著缩短(P<0.01),穿越平台次数显著减少(P<0.01);脑皮层和海马部位尼氏小体数量显著减少、着色浅;脑组织中JNK mRNA及其蛋白的相对表达量显著升高(P<0.01),PP2B mRNA及其蛋白的相对表达量显著降低(P<0.01)。与模型组比较,阳性对照组和TSG各剂量组小鼠逃避潜伏期显著缩短(P<0.01),原平台象限停留时间显著延长(P<0.01);穿越平台次数显著增加(P<0.01);脑皮质和海马部位尼氏小体数量显著增加、着色深;脑组织中JNK蛋白的相对表达量显著降低(P<0.05或P<0.01),PP2B mRNA及其蛋白的相对表达量显著升高(P<0.01),且TSG高剂量组小鼠脑组织中JNK mRNA的相对表达量显著降低(P<0.05)。结论:TSG对3×Tg-AD小鼠的学习记忆能力及神经元损伤有一定改善作用,其机制可能与下调蛋白激酶JNK的转录和表达、上调蛋白磷酸酶PP2B的转录和表达有关。
关键词 阿尔茨海默病;二苯乙烯苷;APP/PS1/Tau三转基因痴呆小鼠; c-Jun氨基末端激酶;钙调神经磷酸酶
ABSTRACT OBJECTIVE: To study the regulatory effects of stilbene glucoside (TSG) on c-Jun N-terminal kinase (JNK) and protein phosphortase 2B (PP2B) in APP/PS1/Tau transgenic dementia (3×Tg-AD) mice, and to explore its potential mechanism of anti-Alzheimers disease (AD). METHODS: Totally 45 male 3×Tg-AD mice were randomly divided into model group, positive control group (huperzine A, 0.15 mg/kg), TSG low-dose, medium-dose and high-dose groups (0.033, 0.1, 0.3 g/kg), with 9 mice in each group. Another 9 normal male C57BL/6J mice were included into normal control group. Administration groups were given relevant medicine intragastrically, once a day, for consecutive 60 d. Normal control group and model group were given constant volume of normal saline intragastrically. After medication, Morris water maze experiment was used to test the spatial learning and memory ability of mice in each group; Nissl staining was used to observe the changes of Nissl bodies in cerebral cortex and hippocampus; mRNA and protein expressions of JNK and PP2B were detected by qRT-PCR and Western blotting assay. RESULTS: Compared with normal control group, the escape latency was significantly prolonged (P<0.01), the retention time of the original platform quadrant was significantly shortened (P<0.01), and the times of crossing the platform was significantly reduced in model group (P<0.01); the number of Nissl bodies in cerebral cortex and hippocampus was significantly reduced, the staining was slight; the relative expressions of JNK mRNA and protein were significantly increased (P<0.01), and the relative expressions of PP2B mRNA and protein were significantly decreased (P<0.01). Compared with model group, the escape latency was significantly shortened in positive control group and TSG groups (P<0.01); the retention time of the original platform quadrant was significantly prolonged (P<0.01); the times of crossing the platform was significantly increased (P<0.01); the number of Nissl bodies in cerebral cortex and hippocampus was increased significantly, the staining was heavy; the relative expression of JNK protein was significantly decreased (P<0.05 or P<0.01), the relative expressions of PP2B mRNA and protein were significantly increased (P<0.01), while the relative expression of JNK mRNA was significantly decreased in TSG high-dose group (P<0.05). CONCLUSIONS:TSG can improve the learning and memory ability and neuronal damage of 3×Tg-AD mice. The mechanism may be related to down-regulating the transcription and expression of protein kinase JNK, up-regulating the transcription and expression of protein phosphatase PP2B.
KEYWORDS Alzheimers disease; Stilbene glucoside; APP/PS1/Tau transgenic dementia mice; c-Jun N-terminal kinase; Protein phosphortase 2B
阿尔茨海默病(AD)亦称老年性痴呆,是老年人群常见的一种退行性神经疾病。随着中国老年人口数量的日益增多,AD带给老年群体的各种精神问题不容忽视。刘肇瑞等[1]开展的中国≥55岁人群归因于痴呆的精神残疾描述性流行病学研究发现,残疾人群归因于AD的精神残疾率较高,尤其是合并多重残疾者归因于AD的精神残疾率更高[1]。在中国,仅60岁以上老年人的AD患病率已达5%,而80岁以上老年人的AD患病率高达20%[2]。然而,目前可用于AD治疗的药物仅能缓解症状,且副作用明显,无法达到根治的目的[3]。因此,研发具有高效低毒的治疗AD的药物已成为医药科研工作者关注的焦点。
二苯乙烯苷(化学名为2,3,5,4′-四羟基-二苯乙烯-2-O-β-D-葡萄糖苷,简称TSG)是何首乌提取物中的主要药理活性成分。本课题组前期研究表明,TSG能通过减少β-淀粉样蛋白(Aβ)的沉积和老年斑形成,改善APP/PS1双转基因AD小鼠的学习记忆能力[4],同黄蕊等[5]的研究结果一致,这提示TSG在AD的防治方面有重要的研究价值,但尚需更多个模型从多角度加以证实。现有研究表明,AD与过度磷酸化的Tau蛋白的关系紧密[6-8]。Tau蛋白的异常磷酸化可导致AD患者的认知障碍。可见,抑制和调控Tau蛋白的磷酸化可能是预防和治疗AD的关键。另有研究表明,c-Jun氨基末端激酶(JNK)、钙调节神经磷酸酶(PP2B)参与了Tau蛋白的异常磷酸化[9-10],因此JNK、PP2B的表达变化可能与AD的发病机制有关。鉴于此,本课题组选择高表达Tau基因突变的APP/PS1/Tau三转基因痴呆(3×Tg-AD)小鼠为研究对象,研究TSG对其JNK、PP2B表达的影响,探索该药抗AD的可能机制,进而为其临床应用提供一定的理论支持。
1 材料
1.1 仪器
DigBehv-MG型Morris水迷宫(上海吉量软件科技有限公司);14050237999型半自动轮转式切片机、Arcadia(H+C)型包埋机[徕卡显微系统(上海)贸易有限公司];LightCycler96型荧光定量-聚合酶链式反应(PCR)系统[罗氏诊断产品(上海)有限公司];ME204E型电子天平[梅特勒-托利多仪器(上海)有限公司];Tanon- 5200 multi型全自动化学发光图像分析仪(广州誉维生物科技仪器有限公司);SpactraMax i3x型多功能酶标仪(美国Molecular Devices公司);Neofuge15R型高速冷冻离心机(上海力康生物医疗科技控股有限公司);BX53型正置荧光显微镜(日本Olmypus公司)。
1.2 药品与试剂
TSG提取物(成都克洛玛生物科技有限公司,批号:CHB180810,纯度:≥70%);石杉碱甲片(辰欣药业股份有限公司,批号:191211202,规格:50 μg/片);高效RIPA组织/细胞快速裂解液(批号:20190922)、尼氏染色液(批号:20200320JH)均购自北京索莱宝科技有限公司;100×蛋白酶抑制剂(美国Med Chem Express公司,批号:HY-K0010);兔抗小鼠PP2B多克隆抗体(批号:00050052)、鼠抗小鼠JNK多克隆抗体(批号:10010983)、兔抗小鼠甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号:00083125)、辣根过氧化物酶(HRP)标记山羊抗小鼠免疫球蛋白G(IgG)二抗、HRP标记山羊抗兔IgG二抗均购自美国Proteintech Group公司;鼠抗小鼠β-肌动蛋白(β-actin)单克隆抗体(美国Invitrogen公司,批号:UD277186);总RNA提取试剂盒(美国Axygen公司,批号:00920KD1);10%聚丙烯酰胺(PAGE)凝胶快速制备试剂盒(批号:02431400)、Omini-ECLTM超灵敏感化学发光检测试剂盒(批号:02391063)、二喹啉甲酸(BCA)蛋白定量试剂盒(批号:013B1050)、5×蛋白快速封闭液(批号:0141189)均购自上海雅酶生物科技有限公司;其余试剂均为分析纯,水为蒸馏水。
1.3 动物
本研究所使用的实验动物有APP/PS1/Tau 3×Tg-AD和与其有相近遗传背景的C57BL/6J两种小鼠品系,均为SPF級、雄性。3×Tg-AD小鼠购自美国Jackson Laboratory公司(健康证书编号:1911A18008),体质量为(25.02±0.20) g,共45只,6周龄;C57BL/6J小鼠购自长沙市天勤生物技术有限公司[动物生产许可证号:SCXK(湘)2019-0011],体质量为(25.20±0.16) g,共9只,6周龄。购入后,所有小鼠均饲养于右江民族医学院SPF级动物实验中心,直到长至8月龄后开始用于实验。SPF级实验室的环境室温为20~25 ℃、相对湿度为55%~75%。本研究通过右江民族医学院伦理委员会的审批,实验过程中对动物的处置符合科学技术部颁发的《关于善待实验动物的指导性意见》要求。
2 方法
2.1 分组与给药
取8月龄3×Tg-AD雄性小鼠45只,按随机数字表分为模型组、阳性对照组(石杉碱甲,0.15 mg/kg)和TSG 低、中、高剂量组(0.033、0.1、0.3 g/kg),每组9只。另外,取 8月龄 C57BL/6J雄性小鼠9只,作为正常对照组。正常对照组和模型组小鼠灌胃等量生理盐水,各给药组小鼠灌胃相应药物,灌胃容积为10 mL/kg,每天给药1次,连续给药60 d。给药组小鼠的给药剂量参考本课题组前期已发表的文献[4]设置。
2.2 小鼠空间记忆能力检测
给药结束后第2天,各组小鼠进行Morris水迷宫定位航行实验,总计5天,每天训练4次,每次间隔30 s。首先将平台放于水池第三象限的中间位置,每天4次训练的入水顺序依次为面向第一、第三、第二、第四象限池壁的中点。实验开始前先将小鼠置于站台上适应30 s,然后面朝池壁按照第一、第三、第二、第四象限的顺序依次放入水池中。实验设置为小鼠登上平台5 s后终止记录,记录小鼠在60 s内找到平台的时间(即逃避潜伏期)。如果小鼠在60 s后未登上平台,则时间记为60 s,并人为引导小鼠至平台上停留30 s。
定位航行实验结束后的第2天进行空间探索实验,共计1天。先撤掉水池中平台,将小鼠从原平台象限的反向象限面向池壁中点放入水中,通过DigBehv 2.3动物行为分析系统记录小鼠在60 s内的游泳轨迹,并计算其在原平台象限的停留时间和穿越原平台次数。
2.3 小鼠脑皮层、海马部位神经元尼氏小体检测
水迷宫实验结束后,每组随机选3只小鼠,颈椎脱臼处死,冰上操作取出完整大脑,经脱水等常规处理后包埋成蜡块,切片(厚度为4 μm)。选取合适脑组织切片进行尼氏染色、中性树胶封片,然后在显微镜下观察脑皮层、海马部位的尼氏小体染色情况。
2.4 小鼠脑组织中JNK、PP2B mRNA表达情况检测
采用实时荧光定量-PCR(qRT-PCR)法进行检测。水迷宫实验结束后,每组随机选3只小鼠,颈椎脱臼处死,冰上操作取出完整大脑,保存于液氮中。取脑组织适量,用液氮研磨后,参照AxyPrep总RNA小量制备试剂盒中说明书方法提取总RNA,然后立即用微量核酸蛋白分析仪检测总RNA纯度及浓度(测得A260 nm/A280 nm在1.8~2.1之间,表明 RNA 的纯度较高)。将提取的总RNA按相应试剂盒说明书步骤进行去DNA和逆转录合成cDNA后,采用两步法进行PCR扩增。反应体系(共20 μL):上、下游引物各1 ?L、cDNA模板2 ?L、FastStart Universal SYBR Green Master(ROX) 10 ?L、无酶水6 ?L。反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃延伸30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算各目的基因mRNA的相对表达量(式中Ct是指每个反应管内荧光信号强度达到设定阈值时经历的循环次数)。引物序列及产物长度见表1。
2.5 小鼠脑组织中JNK、PP2B蛋白表达情况检测
采用 Western blotting 法进行检测。水迷宫实验结束后,每组取剩余3只小鼠,按“2.4”项下方法取材并保存。取脑组织适量,用液氮研磨,按照每200 mg脑组织加蛋白裂解液(RIPA高效快速裂解液、蛋白酶抑制剂按体积比100 ∶ 1混合)2 mL的比例进行匀浆,于冰上充分裂解30 min后,在4 ℃下以12 000 r/min离心5 min,收集上清液,采用BCA 法测定蛋白浓度后,用5×蛋白上样缓冲液稀释,最后于95~100 ℃变性6 min。每孔取80 μg蛋白行十二烷基硫酸钠(SDS)-PAGE凝胶电泳,然后在180 mA、室温条件下转移60 min至NC膜上;将膜置于QuickBlockTMWestern封闭液中,摇床上振摇10 min封闭;用TBST清洗10 min×3次,分别加入JNK一抗(稀释比例为 1 ∶ 6 000)、PP2B、β-actin和GAPDH一抗(稀释比例均为1 ∶ 5 000),于4 ℃孵育过夜;用TBST 清洗10 min×3次,加入相应的二抗(稀释比例均为1 ∶ 5 000),于4 ℃下避光振摇1 h;用TBST清洗10 min×3次,以超灵敏感化学发光液进行发光显色,采用Imagej v1.8.0软件测定条带灰度值。其中JNK以GAPDH为内参,PP2B以β-actin为内参,以目的蛋白条带与相应内参蛋白条带灰度值的比值表示目的蛋白的相对表达量。
2.6 统计学方法
采用SPSS 22.0软件对实验数据进行统计分析。计量资料以x±s表示。多组间比较使用单因素方差分析;方差齐性时组间两两比较采用LSD检验,方差不齐性时组间两两比较采用Tamhanes T2检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 TSG对3×Tg-AD小鼠空间学习记忆能力的影响
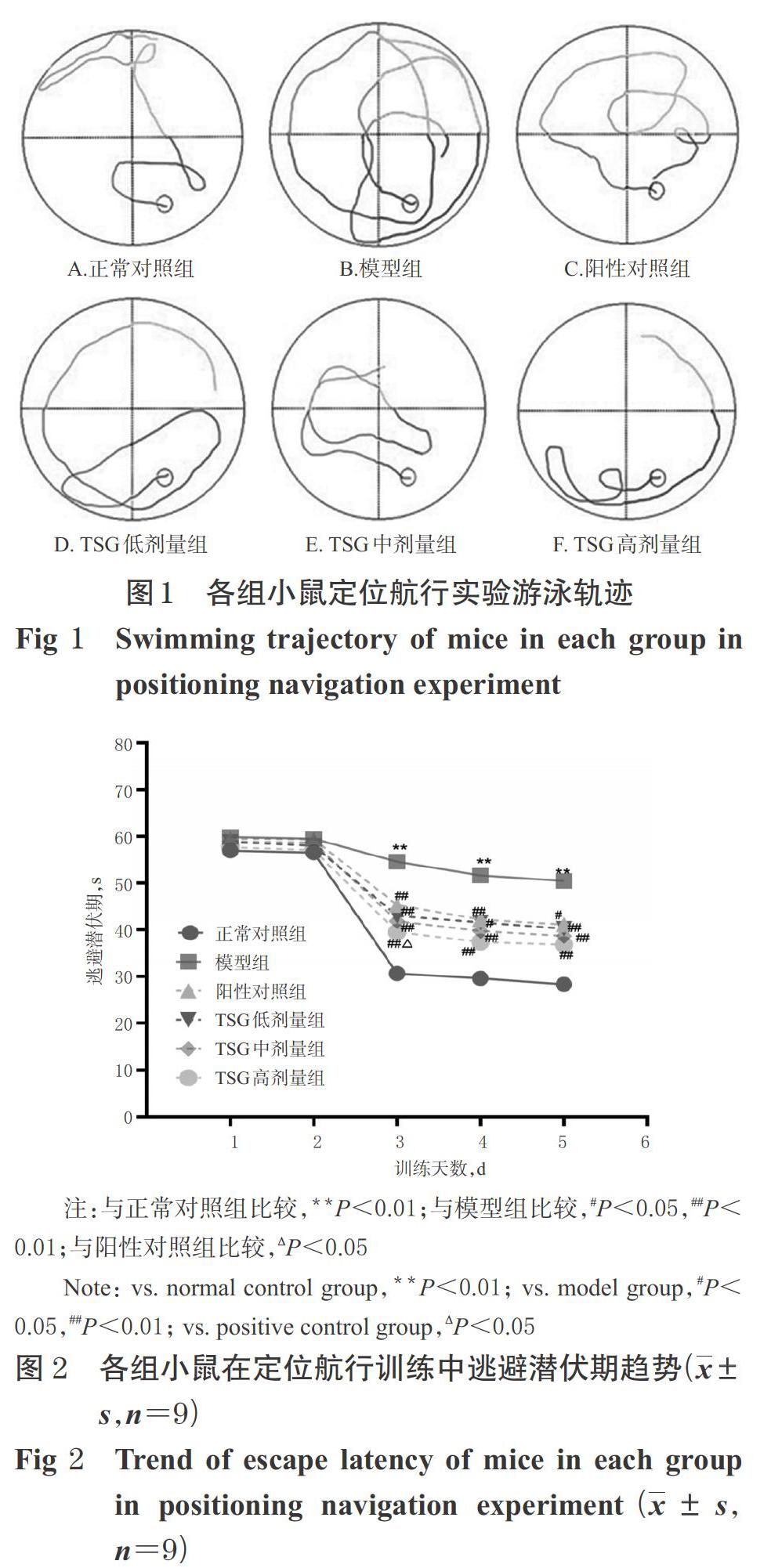
3.1.1 水迷宫定位航行训练实验结果 随着训练天数的增加,各组小鼠的空间学习记忆能力都在逐渐提高。在训练的第3~5天,与正常对照组比较,模型組小鼠的逃避潜伏期显著延长(P<0.01);与模型组比较,阳性对照组和TSG各剂量组小鼠的逃避潜伏期均显著缩短(P<0.05或P<0.01),并且TSG高剂量组小鼠在训练第3天的逃避潜伏期显著短于阳性对照组(P<0.05)。各组小鼠定位航行实验游泳轨迹见图1,逃避潜伏期趋势见图2。
3.1.2 水迷宫空间探索实验结果 与正常对照组比较,模型组小鼠原平台象限停留时间显著缩短(P<0.01),穿越平台次数显著减少(P<0.01);与模型组比较,阳性对照组和TSG各剂量组小鼠原平台象限停留时间均显著延长(P<0.01),穿越平台次数均显著增多(P<0.01);与阳性对照组比较,TSG中、高剂量组小鼠的原平台象限停留时间显著延长(P<0.01),穿越平台次数显著增多(P<0.05或P<0.01)。各组小鼠空间探索实验结果见表2。
3.2 TSG对3×Tg-AD小鼠脑皮层和海马部位尼氏小体的影响
与正常对照组比较,模型组小鼠脑皮层和海马CA1区尼氏小体着色变浅,数量显著减少,神经元细胞排列凌乱。与模型组比较,阳性对照组和TSG各剂量组小鼠脑皮层和海马CA1区神经元尼氏小体着色加深且数量明显增多,神经元细胞更为规则有序。各组小鼠脑组织皮层和海马部位尼氏染色显微图分别见图3、图4。
3.3 TSG对3×Tg-AD小鼠脑组织中JNK、PP2B mRNA表达的影响
与正常对照组比较,模型组小鼠脑组织中JNK mRNA的相对表达量显著升高(P<0.01),PP2B mRNA的相对表达量显著降低(P<0.01);与模型组比较,TSG高剂量组小鼠脑组织中JNK mRNA的相对表达量显著降低(P<0.05),阳性对照组和TSG各剂量组小鼠脑组织中PP2B mRNA的相对表达量均显著升高(P<0.05或P<0.01);与阳性对照组比较,TSG高剂量组小鼠脑组织中JNK mRNA的相对表达量显著降低(P<0.05),PP2B mRNA的相对表达量显著升高(P<0.01)。各组小鼠脑组织中JNK、PP2B mRNA的相对表达量测定结果见表3。
3.4 TSG对3×Tg-AD小鼠脑组织中JNK、PP2B蛋白表达的影响
与正常对照组比较,模型组小鼠脑组织中JNK蛋白的相对表达量显著升高(P<0.01),PP2B蛋白的相对表达量显著降低(P<0.01);与模型组比较,阳性对照组和TSG各剂量组小鼠脑组织中JNK蛋白的相对表达量均显著降低(P<0.05或P<0.01),PP2B蛋白的相对表达量均显著升高(P<0.01);与阳性对照组比较,TSG中、高剂量组小鼠脑组织中JNK蛋白的相对表达量均显著降低(P<0.01),PP2B蛋白的相对表达量均显著升高(P<0.01)。各组小鼠脑组织中JNK、PP2B蛋白表达的电泳图见图5,蛋白相对表达量测定结果见表4。
4 讨论
AD是一种好发于老年人群且不可逆转的中枢神经系统退行性疾病,其治疗手段非常有限。本课题组前期研究发现,TSG通过抑制Aβ前体蛋白和早老素1基因的表达对APP/PS1双转基因AD模型小鼠具有良好的改善作用[4],提示TSG在AD的防治方面有重要的研究价值。
3×Tg-AD小鼠同其他单转(双转)基因AD模型类别相比能更好地模拟AD神经元纤维缠结(过度磷酸化的Tau蛋白聚集)病理结构的特点[11],因此本课题组选择3×Tg-AD小鼠为研究对象开展实验。另外,同为中药来源的石杉碱甲早在1994年就被中国批准用于临床治疗AD,其能显著改善AD患者的认知能力,对脑神经元有明确的保护作用[12],因此本研究选择石杉碱甲作为阳性对照药。
在生理状态下,Tau蛋白的重要功能是协助微管蛋白组装形成微管和维持微管的稳定;而在AD状态下,Tau蛋白可以通过异常构象增加自我聚集的倾向,从而导致健康细胞模板错误折叠,最终形成惰性不溶神經原纤维,阻碍神经元的传输系统[9,13]。本研究结果发现,3×Tg-AD小鼠表现出明显的空间认知障碍,而给予TSG低、中、高剂量处理2个月后,模型小鼠的空间学习记忆障碍明显改善,且呈一定剂量依赖性趋势。为验证TSG是否具有修复受损神经元的功能,本课题组进行了尼氏染色实验,结果发现,不同剂量TSG 给药60 d后,能使AD模型小鼠脑皮层和海马部位尼氏小体数量增多、着色加深。以上实验结果表明,TSG具有改善AD模型小鼠学习记忆能力、修复其受损神经元的作用。
JNK是参与Tau蛋白过度磷酸化的一个重要激酶[14-15]。JNK信号通路的激活可增加海马神经炎症、Tau蛋白过度磷酸化、神经毒性和神经元退化死亡,进一步导致认知功能障碍[6,15]。减少JNK信号通路的活化被认为是解决病理性Tau蛋白导致AD的一个重要靶标[14]。本研究结果显示,模型组小鼠脑组织中JNK mRNA及其蛋白的相对表达量均较正常对照组显著升高,这提示AD模型小鼠的发病可能与JNK蛋白表达增强有关。给药后,不同剂量TSG组小鼠脑组织中JNK mRNA及其蛋白的相对表达量均较模型组不同程度地降低,特别以高剂量TSG的作用最为明显。这提示TSG对AD模型小鼠的改善作用可能是通过抑制JNK mRNA的转录及其蛋白的表达来实现的。
PP2B是唯一受钙和钙调素调节的一种丝氨酸/苏氨酸蛋白质磷酸酶,广泛分布于机体各个组织。在细胞信号传递的过程中,PP2B通过对靶蛋白脱磷酸化而实现其对生理活动的调节,故被认定为是保护AD的一个重要磷酸酶[7]。PP2B通过抑制星形胶质细胞中活化T细胞核因子(NFAT)和核因子κB(NF-κB)的活化以及抑制星形胶质细胞增生而减轻促炎性细胞因子的产生,从而抑制Tau蛋白过度磷酸化而缓解AD的病症[7,16]。本研究结果显示,模型组小鼠脑组织中PP2B mRNA及其蛋白的相对表达量较正常对照组均显著降低,这提示AD模型小鼠的发病可能与PP2B蛋白表达的增强有关。给药后,TSG各剂量组小鼠脑组织中PP2B mRNA及其蛋白的相对表达量均较模型组不同程度地升高,这提示TSG对AD模型小鼠的改善作用可能是通过增加PP2B mRNA的转录及其蛋白的表达来实现的。
综上,TSG可能是通过下调3×Tg-AD小鼠蛋白激酶JNK的mRNA转录及蛋白表达和上调磷酸酶PP2B的mRNA转录及蛋白表达,修复小鼠脑受损皮层和海马神经元,进而改善其认知功能障碍。然而,本研究还存有一定不足之处,如每组的研究小鼠数量有限、只选用了单一时间点进行考察等。在后续研究中,本课题组将进一步对此进行完善。
参考文献
[ 1 ] 刘肇瑞,黄悦勤,陈红光.中国≥55岁人群归因于痴呆的精神残疾描述性流行病学研究[J].中国心理卫生杂志,2016,30(9):683-688.
[ 2 ] 周源源.阿尔茨海默病的流行病学、发病危险因素、治疗及早期筛查研究进展[J].内科,2019,14(6):690-692.
[ 3 ] OBRIEN JT,HOLMES C,JONES M,et al. Clinical practice with anti-dementia drugs:a revised (third) consensus statement from the british association for psychopharmacology[J]. Psychopharmacol,2017,31(2):147- 168.
[ 4 ] 杨晓颖,刘宁,黄岑汉,等.二苯乙烯苷对APP/PS1双转基因小鼠APP、PS1基因表达的影响[J].中国老年学杂志,2016,36(7):1573-1575.
[ 5 ] 黄蕊,杨翠翠,李林,等.二苯乙烯苷对APP/PS1小鼠老年斑形成和炎症反应的影响[J].中国康复理论与实践,2018,24(1):2-10.
[ 6 ] KAMETANI F,HASEGAWA M. Reconsideration of amyloid hypothesis and tau hypothesis in Alzheimers disease[J]. Front Neurosci,2018. DOI:10.3389/fnins.2018. 00025.
[ 7 ] VOGELS T,LEUZY A,CICOGNOLA C,et al. Propagation of tau pathology:integrating insights from postmortem and in vivo studies[J]. Biol Psychiatry,2020,87(9):808-818.
[ 8 ] PICKETT EK,ROSE J,MCCRORY C,et al. Region-specific depletion of synaptic mitochondria in the brains of patients with Alzheimers disease[J]. Acta Neuropathol,2018,136(5):747-757.
[ 9 ] LI HQ,IP SP,YUAN QJ,et al. Isorhynchophylline ameliorates cognitive impairment via modulating amyloid pathology,tau hyperphosphorylation and neuroinflammation:studies in a transgenic mouse model of Alzheimers disease[J]. Brain Behav Immun,2019. DOI:10.1016/j.bbi. 2019.08.194.
[10] LEE KI,LEE HT,LIN HC,et al. Role of transient receptor potential ankyrin 1 channels in Alzheimers disease[J]. Neuroinflammation,2016. DOI:10.1186/s12974-016- 0557-z.
[11] 王利利,納鑫,朱小南,等. Tau/APP/PS1三转基因小鼠模型的建立及生物学特征[J].中国生理学杂志,2012,28(4):294-297、385.
[12] XING SH,ZHU CX,ZHANG R,et al. Huperzine A in the treatment of Alzheimers disease and vascular dementia:a meta-analysis[J]. Evid Based Complement Alternat Med,2014. DOI:10.1155/2014/363985.
[13] BRAAK H,DEL TREDICI K. Spreading of tau pathology in sporadic Alzheimers disease along cortico-cortical top-down connections[J]. Cereb Cortex,2018,28(9):3372-3384.
[14] BUCCARELLO L,MUSI CA,TURATI A,et al. The stress c-Jun N-terminal kinase signaling pathway activation correlates with synaptic pathology and presents a sex bias in P301L mouse model of tauopathy[J]. Neuro- science,2018. DOI:10.1016/j.neuroscience.2018.09.049.
[15] CHANG KW,ZONG HF,MA KG,et al. Activation of α7 nicotinic acetylcholine receptor alleviates Aβ1-42-induced neurotoxicity via downregulation of p38 and JNK MAPK signaling pathways[J]. Neurochem Int,2018. DOI:10. 1016/j.neuint.2018.09.005.
[16] ODAY DH,ESHAK K,MYRE MA. Calmodulin binding proteins and Alzheimers disease[J]. Alzheimers Dis,2015,46(3):553-569.
(收稿日期:2020-07-17 修回日期:2020-08-22)
(编辑:林 静)
