基于网络药理学及分子对接技术探讨沙棘治疗阿尔茨海默病的作用机制
2020-10-30汤威威赵宏孔令洲高琪焦莹莹张宇吴丽丽沈宇王宇亮
汤威威 赵宏 孔令洲 高琪 焦莹莹 张宇 吴丽丽 沈宇 王宇亮


摘 要 目的:揭示沙棘治療阿尔茨海默病(AD)的作用机制,为进一步探究沙棘治疗AD的药效物质基础提供理论参考。方法:通过TCMSP、Uniprot、GeneCards等数据库筛选沙棘活性成分、靶点及AD相关靶点基因;采用Cytoscope 3.7.1软件构建化合物-靶点-疾病网络图;通过STRING数据库制作靶点相互作用(PPI)网络,筛选度值较高的沙棘治疗AD的潜在靶点与沙棘活性成分进行分子对接;采用Clue GO插件对沙棘治疗AD的潜在靶点进行GO基因本体(GO)分析、京都基因与基因组百科全书(KEGG)通路富集分析。取50只小鼠随机分为空白组、模型组[D-半乳糖120 mg/(kg·d)及AlCl3溶液20 mg/(mL·d)]、阳性药物组[奥拉西坦260 mg/(kg·d)]、沙棘果油提取物组[1.6 g/(kg·d)]、沙棘多酚提取物组[1.6 g/(kg·d)],每组10只。各组小鼠分别灌胃相应药物的同时灌胃造模剂,空白组灌胃等体积蒸馏水,每天1次,连续给药60 d。通过Morris水迷宫实验测定各组小鼠学习记忆能力,采用酶联免疫吸附(ELISA)法检测小鼠海马体组织免疫因子水平,采用苏木素-伊红染色(HE)法观察海马体的病理学变化,对沙棘治疗AD的作用机制进行初步验证。结果:沙棘22个活性成分(槲皮素、山柰酚、异鼠李素、β-胡萝卜素、β-谷固醇等)可能通过调控丝氨酸/苏氨酸激酶编码蛋白(AKT1)、氨基端激酶 (JUN)、丝裂原活化蛋白激酶(MAPK1)等147个靶点影响核受体活性、脂多糖介导的信号通路等生物过程及白细胞介素17(IL-17)信号传导途径、肿瘤坏死因子(TNF)信号传导途径等114条代谢通路。分子对接结果显示,沙棘主要活性成分与主要靶点蛋白结合分值均在4.25以上,具有较好的结合活性。药理学实验结果显示,沙棘提取物能够使AD模型小鼠的逃避潜伏期缩短、穿越平台次数增加,减轻其脑海马体组织损伤,降低其脑海马体组织中炎性因子TNF-α、IL-1β、IL-6、IL-17含量。结论:沙棘的活性成分可调控AD发病重要通路中的多个靶点;动物实验初步验证其可通过抑制炎症因子的表达,来减轻AD模型小鼠海马体损伤,改善小鼠学习记忆能力。
关键词 沙棘;阿尔茨海默病;网络药理学;分子对接
ABSTRACT OBJECTIVE: To explore the mechanism of Hippophae rhamnoides in the treatment of Alzheimers disease (AD), and to provide theoretic reference for further exploring the material basis. METHODS: TCMSP, Uniprot, GeneCards database were used to screen the active components of H. rhamnoides, targets and AD-related target gene. The “ingredients-targets-related diseases” network was constructed by Cytoscape 3.7.1 software. STRING database was adopted to construct protein interaction (PPI) network, molecular docking was conducted between the potential targets with high degree values and active components of H. rhamnoides. The gene ontology (GO) analysis and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were performed by Clue GO for the potential target of H. rhamnoides in the treatment of AD. Totally 50 mice were randomly divided into blank group, model group [D-galactose 120 mg/(kg·d), AlCl3 solution 20 mg/(mL·d)], positive drug group [oxiracetam 260 mg/(kg·d)], seabuckthorn oil extract group [1.6 g/(kg·d)], seabuckthorn polyphenols group [1.6 g/(kg·d)], with 10 mice in each group. The mice was given relevant medicine intragastrically and modeling agent; blank group was given constant volume of distilled water intragastrically, once a day, for consecutive 60 d. The learning and memory abilities were detected by Morris water maze test; the levels of immune factors in hippocampus tissue were measured by ELISA. Pathological morphology of hippocampus tissue was observed by HE staining. The mechanism of H. rhamnoides in the treatment of AD was validated preliminarily. RESULTS: Totally 22 active components of H. rhamnoides (quercetin, kaempferol, isorhamnetin, β-carotene, β-sitosterol) may affect biological processes such as nuclear receptor activity, lipopolysaccharide-mediated signal pathway, and may affect 114 methabolism pathways such as IL-17 signal transduction pathway, TNF signal transduction pathway by regulating 147 targets such as serine/threonine kinase coding protein (AKT1), amino terminal kinase (JUN) and mitogen activated protein kinase (MAPK1). The results of molecular docking showed that binding scores of the main active components of H. rhamnoides and the main target proteins were all above 4.25, which showed good binding activity. Results of pharmacology experiment showed that H. rhamnoides extract could shorten the escape latency of AD model mice, increased the times of crossing platform, relieved hippocampus injury of cerebral tissue, and decreased the contents of inflammatory factors TNF-α, IL-1β, IL-6 and IL-17 in hippocampus of cerebral tissue. CONCLUSIONS: The active components of H. rhamnoides can regulate multiple targets in the important pathway of AD; animal experiments preliminarily verify that H. rhamnoides can relieve the hippocampus injury and improve the learning and memory ability of AD model mice by inhibiting the expression of inflammatory factors.
KEYWORDS Hippophae rhamnoides; Alzheimers disease; Network pharmacology; Molecular docking
阿尔茨海默病(Alzheimers disease,AD)是一种严重威胁老年人生命健康的中枢神经系统退行性疾病。目前,全世界约有5 000万人患有AD,且患病人数逐年上升,预计到2050年AD患病人数会增加3倍以上[1]。传统中医认为,AD归属于中医“呆病”“神呆”“善忘”的范畴,其病机涉及脾胃虚弱、气血虚衰、痰瘀交阻、气血凝滞等[2]。现代医学研究表明,AD发病机制与氧化应激、胆碱能损伤、神经炎症等相关[3-5]。目前,治疗AD的药物主要为胆碱酯酶抑制剂,如多奈哌齐、美金刚等单一靶点药物,治疗效果不显著,因此寻找高效低毒、便于长期服用、有效延缓或治愈AD的新型药物已成为研究者的首要目标[6]。
传统中药及其提取物具有安全、不良反应少等特点,已被用于治疗AD新药的研发,并显示出良好的效果[7]。沙棘是胡颓子科植物沙棘Hippophae rhamnoides L.的干燥成熟果实,味酸、涩,性温,归脾、胃、肺、心经,常用于脾虚食少、咳嗽痰多、瘀血经闭、跌扑瘀肿的治疗[8]。据《民族药成方制剂》记载,沙棘的成方制剂吉祥安神丸具有补气安神作用;《蒙医金匮》中记载有沙棘十七味散,主治胃、肾、肝等脏腑之瘀血症,与中医治疗AD患者时使用增补气血、化瘀血、充盈脑髓的药物相符[9]。本课题组前期研究表明,沙棘中含有多酚、油脂等活性成分,具有抗氧化、抗AD等作用[10]。因此,沙棘抗AD的作用,可能与其补气健脾、化痰祛浊、活血化瘀的药效相关[11-13]。
网络药理学是利用计算机科学、分子生物学、药学等学科的成果,对传统中药成分的潜在靶点、药理作用进行多基因、多靶点、多途径的系统研究,可为中医药现代化研究提供新的思路[14]。分子对接则是通过受体特征及受体与药物分子之间的相互作用方式来预测其结合模式和亲合力的一种理论模拟方法[15]。本文采用网络药理学结合分子对接法對沙棘治疗AD的分子机制进行研究,阐明沙棘活性成分治疗AD的药理作用机制并进行初步的药理学实验验证,为沙棘在治疗AD方面的应用提供参考。
1 材料
1.1 仪器
FA2004型电子分析天平(上海舜宇恒平科学仪器有限公司);Morris 水迷宫视频跟踪分析系统(成都泰盟科技有限公司);FC型酶标仪[赛默飞世尔(上海)仪器有限公司];XH-C型漩涡混合器(无锡莱浦仪器设备有限公司);JJ-12J型脱水机、JB-L7型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);XSP-13C-LP型显微镜(上海精密仪器仪表有限公司)。
1.2 药品与试剂
氯化铝(AlCl3,天津市凯通化学试剂有限公司,批号:170814,分析纯);D-半乳糖(北京化学试剂公司,批号:1711016,分析纯);奥拉西坦胶囊(石药集团欧意药业有限公司,批号:485180416,规格:0.4 g/粒) ;肿瘤坏死因子α(TNF-α)试剂盒(批号:2018011)、白细胞介素 1β(IL-1β)试剂盒(批号:2011104)、IL-6试剂盒(批号:2018031)、IL-10试剂盒(批号:2017125)均购自碧云天生物科技公司。
沙棘购于佳木斯民生药行(批号:180312),经佳木斯大学药学院张宇教授鉴定为胡颓子科植物沙棘H. rhamnoides L.的干燥果实,经石油醚回流提取,经高温水化法脱胶、高温淡碱法脱酸、活性白土脱色精制后,得沙棘果油提取物。沙棘用71%乙醇提取,得沙棘多酚提取物(多酚含量:56.25%)。以上提取物由佳木斯大学药学院药物化学实验室提供并测定。
1.3 动物
清洁级KM小鼠60只,6周龄,体质量18 g~22 g,购自哈尔滨医科大学,动物使用许可证号:SYXK(黑)2014-003。小鼠饲养于SPF 级动物实验室。
2 方法
2.1 沙棘活性成分与相应靶点基因收集与筛选
在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)数据库(http://tcmspw.com/tcmsp.php)中,以“沙棘”为关键词,以类药性(DL)≥0.18、口服生物利用度(OB)≥30%为条件对化学成分进行筛选,获取沙棘活性成分及对应靶点信息,然后在 UniProt数据库(https://www.uniprot.org/)获取靶点对应基因名,并下载活性成分的三维结构文件,得到沙棘的主要活性成分[16]。
2.2 沙棘活性成分-疾病靶点网络构建
以“Alzheimers disease”为关键词,通过人类基因平台(GeneCards)数据库(https://www.genecards.org/)获取AD的相关靶点,使用R语言中Venny程序映射活性成分、预测靶点和疾病相关靶点,获得沙棘与AD的交集靶点,即为沙棘治疗AD的潜在靶点。将“2.1”项下获得的沙棘活性成分与沙棘治疗AD的潜在靶点,导入生物信息分析软件Cytoscape 3.7.1,构建沙棘活性成分-AD靶点网络。网络中的节点(Node)表示靶点或化合物,边(Edge)表示活性成分与疾病之间相互作用。复杂网络节点中心性可用于衡量节点在网络中影响能力大小,以判断节点的重要性。其中,度值为重要参数,度值越高代表该成分或靶点在网络中的位置越重要。
2.3 沙棘治疗AD靶点相互作用网络构建
将“2.2”项下映射后的沙棘治疗AD的潜在靶点导入蛋白质相互作用(STRING)数据库(https://string-db.org/),将最低相互作用阈值调整为“中置信度(Medium confidence)”,其值为0.400,其余参数选择默认设置,获得靶点的相互作用关系数据,导入Cytoscape 3.7.1软件中以“Network analyzer”插件制作靶点相互作用(PPI)网络[17]。选择度值排名靠前的沙棘治疗AD的潜在靶点作为关键靶点进行分子对接。
2.4 分子对接
筛选“2.3”项下的关键靶点与“2.1”项下的沙棘活性成分,导入SYBYL-X 2.1软件(https://en.freedownloadmanager.org/Windows-PC/SYBYL-X.html)中进行分析、预测,评价沙棘活性成分与关键靶点之间的结合活性,并以分值来评价其结合活性:分值>4.25表示两者有一定的结合活性,分值>5.0表明有较强的结合活性,分值>7.0表明具有很强的结合活性[18]。
2.5 GO分析与KEGG通路富集分析
将“2.2”项下沙棘治疗AD的潜在靶点导入Cytoscape 3.7.1软件,使用“Clue GO”插件进行基因本体(Gene ontology,GO)分析、京都基因与基因组百科全书(Kyoto encyclopedia of genes and gnomes,KEGG)通路富集分析。以P<0.05表示信号通路为显著富集。
2.6 动物实验
2.6.1 分组、造模及给药 选取50只小鼠随机分为空白组、模型组[皮下注射5% D-半乳糖溶液,120 mg/(kg·d);灌胃AlCl3溶液,20 mg/(mL·d)]、阳性药物组[奥拉西坦,260 mg/(kg·d)]、沙棘果油提取物组[按2015年版《中国药典》[8]人用剂量折算为小鼠等效剂量,即相当于生药量1.6 g/(kg·d);下同]、沙棘多酚提取物组[相当于生药量1.6 g/(kg·d)],每组10只。各组小鼠分别灌胃,给予相应药物的同时给予造模剂,空白组给予等体积的蒸馏水,每天1次,连续给药治疗60 d。
2.6.2 各组小鼠学习记忆能力检测 采用Morris水迷宫实验检测。(1)定位航行实验:给药结束后,以小鼠面向池壁放入水中至找到平台时间为逃避潜伏期。实验时间设置为120 s,若超时未找到平台,则引导小鼠至平台停留片刻,将其逃避潜伏期计为120 s。实验进行5 d,每天训练1次,于第5天记录小鼠逃避潜伏期。(2)空间探索实验:于水迷宫定位航行实验第6天撤去水池中的平台,将小鼠面向池壁放入无平台的水池中自由游泳。实验时间设置为120 s,记录120 s内小鼠穿越原来平台位置的次数[19]。
2.6.3 各组小鼠血清中免疫因子检测和海马体组织病理学变化观察 采用酶联免疫吸附(ELISA)法和苏木精-伊红(HE)染色检测。水迷宫实验结束后,各组小鼠禁食、自由饮水24 h。然后将小鼠脱颈处死后,于冰台上迅速剥离大脑并取出海马体。取海马体的一半,制成10%海马组织匀浆液,4 ℃下以1 000 r/min離心10 min,取上清液于4 ℃下保存,严格按试剂盒说明书测定海马组织匀浆中TNF-α、IL-1β、IL-6、IL-10的水平。另一半海马体用4%多聚甲醛固定,采用HE法染色,于100倍显微镜下进行图像采集分析,观察其病理结构[20]。
2.6.4 统计学分析 采用SPSS 20.0 统计学软件进行实验数据分析。计量资料以x±s表示,组间比较采用单因素方差分析和LSD-t检验。以P<0.05为差异有统计学意义。
3 结果
3.1 沙棘活性成分与其作用靶点
经DL≥0.18、OB≥30%条件筛选,获得沙棘活性成分33个,删除无对应靶点信息的活性成分后得到22个活性成分,主要包括多酚及油脂类成分,例如槲皮素、山柰酚、异鼠李素、β-胡萝卜素、β-谷固醇等,结果详见表1。22个活性成分共对应423个作用靶点,删除重复靶点后剩余213个作用靶点,包括AKT1、JUN、MAPK8、MAPK14等。
3.2 沙棘活性成分-疾病靶点网络
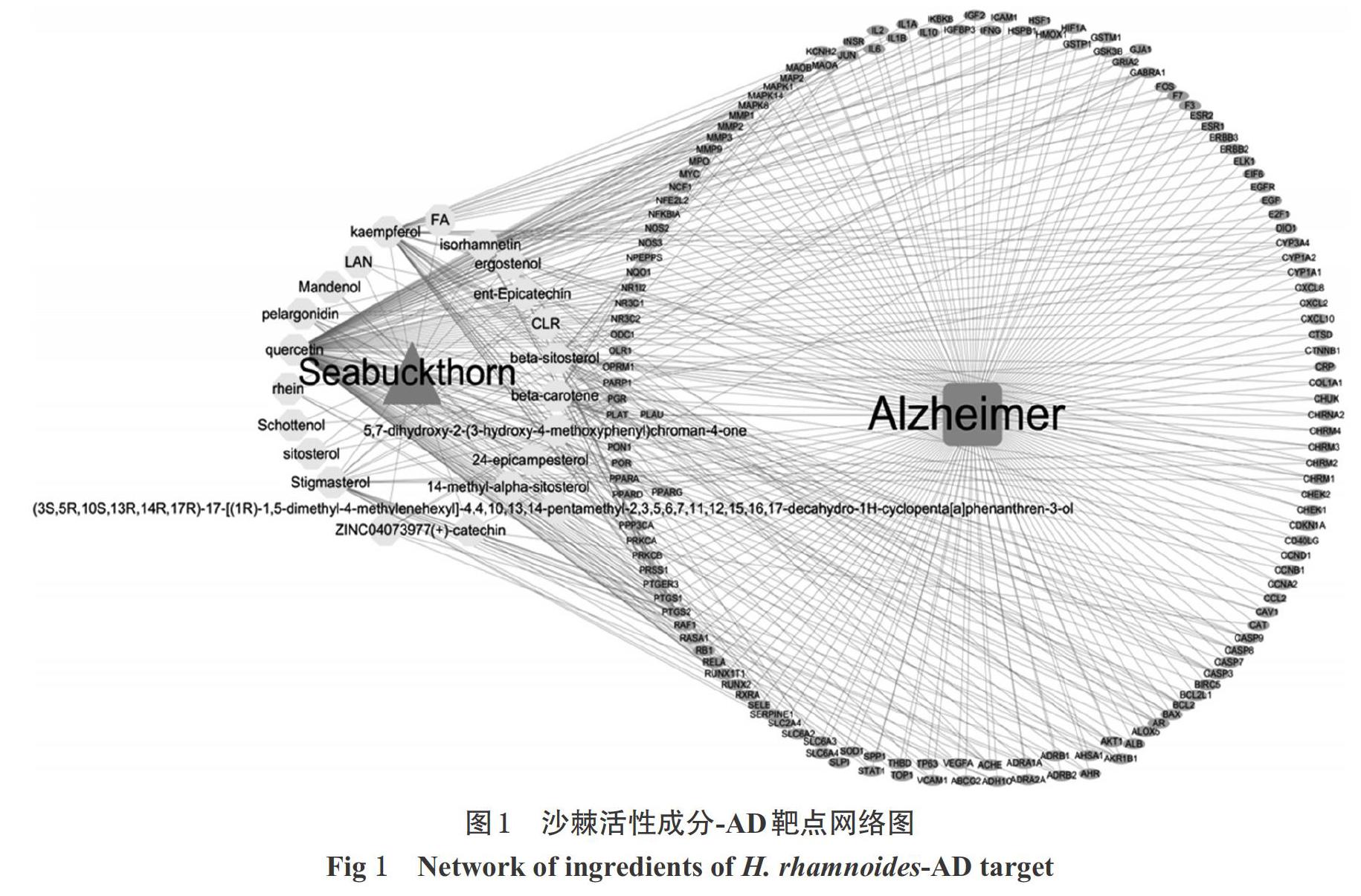
由GeneCards数据库得到8 731个AD相关基因,经R语言Venny映射,得到147个沙棘治疗AD的潜在靶点。建立的沙棘活性成分-AD靶点网络图中共包括171个节点及450条边,其中槲皮素、山柰酚、β-胡萝卜素、异鼠李素、β-谷甾醇、豆甾醇的度值较高,为主要活性成分,结果详见图1(图中,一个活性成分可对应多个靶点,如槲皮素对应IL-6、IL-1β、JUN等;一个靶点也可与多个活性成分相对应,如JUN对应槲皮素、山柰酚、β-谷甾醇等)。
3.3 PPI网络
采用Cytoscape 3.7.1软件构建的沙棘治疗AD靶点PPI网络图共包括129个节点及514条边,图中度值越大则节点颜色越深。度值排名靠前的靶点有AKT1、JUN、MAPK1、转录因子p65 (RELA)、IL-6、MAPK8、MAPK14、表皮生长因子受体(EGFR)、c-fos原癌基因蛋白(FOS),结果详见图2。
3.4 分子对接结果
分子对接结果显示,沙棘主要活性成分与主要靶点蛋白的结合分值均在4.25以上,部分分值超过5.0、接近7.0;β-胡萝卜素对接JUN、MAPK1的分值甚至超过了7.0,表明其具有很强的结合活性,结果详见表2。
3.5 GO分析和KEGG代谢通路富集分析结果
将147个沙棘治疗AD的潜在靶点进行GO富集分析,主要包括分子功能、细胞组成和生物过程3个部分。结果,上述靶点的分子功能集中于激活转录因子结合、抑制转录因子结合等;其细胞组成与小窝等相关性较大;主要参与了细胞对活性氧的反应、核受体活性、脂多糖介导的信号通路、神经递质的生物合成过程等生物过程,结果详见图3。
在KEGG代谢通路富集分析中,共富集到114条相关代谢通路(P<0.05),包括Toll样受体(TLRs)信号通路、IL-17信号传导途径、神经营养蛋白信号通路等,结果详见图4。
3.6 动物实验结果
3.6.1 Morris水迷宫实验结果 与空白组比较,模型组小鼠逃避潜伏期显著延长(P<0.01),穿越平台次数显著减少(P<0.05),表明模型组小鼠出现学习记忆障碍,造模成功;与模型组比较,阳性药物组、沙棘果油提取物组和沙棘多酚提取物组小鼠逃避潜伏期显著缩短(P<0.05或P<0.01),穿越平台次数显著增加(P<0.05或P<0.01),结果详见表3。
3.6.2 大鼠海马体病理学观察结果 空白组小鼠海马体细胞排列整齐、紧密,细胞层次较多、结构清楚,细胞核形态完整、染色正常;模型组小鼠海马体细胞分布较稀疏、排列较散乱,出现大面积细胞坏死,有大量空泡,细胞核着色较深;与模型组比较,各给药组小鼠海马体细胞排列整齐、紧密,细胞层次增多,局部有少量细胞核染色加深,未出现空泡,细胞整体状态较好,结果详见图5。
3.6.3 小鼠海马体组织中免疫因子检测结果 与空白组比较,模型组小鼠海马体组织中TNF-α、IL-1β、IL-6、IL-17水平显著升高(P<0.05);与模型组比较,阳性药物组、沙棘果油提取物组及沙棘多酚提取物组上述水平含量显著降低(P<0.05或P<0.01),结果见表4。
4 讨论
在传统中医治疗中,对痴呆病症的认识相对较早,但是缺乏系统性的诊断标准[21]。中药网络药理学是融合系统生物学、生物信息学、计算机网络分析技术、蛋白组学等多个领域的新兴学科,可通过计算机构建网络模型对中药的整体作用进行分析,为中药的有效性和科学性提供理论科学基础,同时一步阐释中药多靶点协同作用的特点[22]。
本研究基于网络药理学对沙棘抗AD的作用机制进行探讨,发现沙棘抗AD共有22个活性成分,包括槲皮素、山柰酚、异鼠李素、β-谷甾醇、豆甾醇、β-胡萝卜素等。清代陈士铎在《辨证录》中指出:“治呆无奇法,治痰即治呆”,在中医治疗中考虑对AD患者化痰祛浊的治疗[23]。李学坚等[24]研究发现,芒果苷有抗炎和祛痰作用,槲皮素有抗炎作用但无祛痰作用,但两药在祛痰实验中有明显的协同效应,槲皮素能明显提高芒果苷的祛痰药效。因此,沙棘在治疗AD过程中,其活性成分槲皮素或可与其他成分相互作用而发挥化痰祛浊的作用。AD患者多由于年老体虚、肝血不足、血虚精少导致脾胃虚弱、气血虚衰,因而在AD的临床治疗中应当注意对患者气血的补充。边亚倩等[25]基于系统中药学的黄芪补气潜在功效标志物的研究,发现异鼠李素可通过改善物质代谢、调节机体免疫等方面发挥补气功效。因此,沙棘在治疗AD过程中,其活性成分异鼠李素可能发挥补气健脾作用。可见,对于瘀血内阻而气血精微不能上荣于元神者,治宜活血化瘀、醒脑开窍。赵文竹[26]在对玉米须功能因子活性评价及其降血糖机制研究中发现,甾醇类化合物具有抗凝血作用。因此,沙棘在治疗AD过程中,其活性成分豆甾醇或将发挥活血化瘀作用。
本研究对沙棘活性成分作用靶点与AD 疾病靶点进行了交集分析,共發现147个关键靶点,这147个靶点可能是沙棘治疗AD的靶点。结合PPI网络与分子对接结果发现,AKT1、JUN、MAPK1、RELA、IL-6、MAPK8、MAPK14、EGFR、FOS是网络的关键靶点,且与沙棘活性成分具有较好的结合活性。其中,AKT1作为一种丝氨酸/苏氨酸激酶编码蛋白,在神经系统发育中是一个关键的调控因子,用于神经细胞调节,而AKT1的氧化修饰可导致突触功能障碍,导致AD患者产生认知功能障碍[27]。MAPK可传导细胞膜受体信号到细胞核,参与调节神经元增殖、凋亡等,其与学习记忆能力联系紧密,可调控与AD密切相关的病理机制如神经毒性、神经炎症和突触功能障碍等[28]。因此,以上靶点可能在沙棘治疗AD中发挥重要作用。
GO富集分析结果显示,从分子功能富集结果来看,沙棘治疗AD主要体现为激活转录因子结合;从细胞组成富集结果来看,沙棘治疗AD主要体现在小窝;从生物过程富集结果来看,沙棘治疗AD主要体现为细胞对活性氧的反应、核受体活性、脂多糖介导的信号通路。这提示沙棘治疗AD呈现多成分、多靶点、多途径的作用特点。
KEGG代谢通路富集结果显示,沙棘治疗AD涉及的信号通路包括TLRs信号通路、IL-17信号转导途径、神经营养蛋白信号通路等。TLRs是天然免疫受体,TLRs家族中的TLR4信号转导通路可通过髓样分化因子88的激活和相应的下游效应因子,使核因子κB(NF- κB)的抑制因子IκB磷酸化,从而活化NF-κB,启动相应的基因转录[29]。NF-κB是最重要的转录因子之一,具有多向性转录激活功能,可参与炎症反应、免疫反应、细胞凋亡等多种生理病理过程[30]。神经营养蛋白家族可通过Trk酪氨酸激酶受体结合发挥作用。神经营养蛋白/Trk信号通路通过连接多种细胞内信号转导调节,对于神经发育、学习记忆起着重要作用[31]。因此,推测沙棘活性成分可通过抑制TLRs家族中TLR4信号的转导,减少NF-κB信号通路下游的炎性因子(如IL-1β、IL-6、TNF-α)等的分泌;同时还可抑制IL-17信号转导途径,降低IL-17含量;激活神经营养蛋白信号通路,增加神经营养蛋白因子含量,发挥抗AD作用。结合分子对接和KEGG代谢通路富集分析结果发现,沙棘治疗AD是通过炎症相关通路及炎症因子发挥着重要作用,因此后续需通过体内药理实验对炎症相关通路进行验证。
本研究通过动物实验发现,沙棘提取物对AlCl3联合D-gal所致AD模型小鼠有积极影响:在水迷宫试验中,沙棘提取物能够使模型小鼠的逃避潜伏期缩短,穿越平台次数增加,提高其学习记忆能力;组织病理学观察结果显示,沙棘提取物能使模型小鼠的脑海马体组织损伤减轻;机制研究显示,沙棘提取物能够降低模型小鼠脑海马体组织中炎性因子TNF-α、IL-1β、IL-6、IL-17含量,该结果与网络药理学分析结果一致。
综上所述,本研究初步预测了沙棘治疗AD的活性成分、靶点以及信号通路,其中活性成分可调控多个靶点,关键靶点同时参与多个重要信号通路的调控,体现出沙棘多靶点、多通路协同作用的特点;同时,通过动物实验初步验证了沙棘可通过抑制炎症因子的表达,来减轻AD模型小鼠海马体损伤,改善小鼠学习记忆能力。本课题组将以此结果为理论基础,对沙棘的活性成分及治疗AD的药理机制进行深入研究,为沙棘治疗AD机制的进一步研究及其相关产品的开发提供依据。
参考文献
[ 1 ] 王威丽,宋沧桑.阿尔兹海默病发病机制的研究进展及临床用药[J].中国药物评价,2019,36(3):204-209.
[ 2 ] 关运祥.王宝亮教授治疗阿尔茨海默病经验[J].中医研究,2020,33(1):35-37.
[ 3 ] SIMUNKOVA M,ALWASEL SH,ALHAZZA IM,et al. Management of oxidative stress and other pathologies in Alzheimers disease[J]. Arch Toxicol,2019,93(9):2491- 2513.
[ 4 ] 李晓瑩,张敏.阿尔茨海默病发病机制分析[J].世界最新医学信息文摘,2019,19(44):27-28.
[ 5 ] OZBEN T,OZBEN S. Neuro-inflammation and anti-inflammatory treatment options for Alzheimers disease[J]. Clinical Biochemistry,2019. DOI:10.1016/j.clinbiochem.2019.04.001.
[ 6 ] 程鹏,李泰明.乙酰胆碱酯酶抑制剂在阿尔兹海默症治疗中的研究进展[J].科学技术创新,2018,22(9):50-55.
[ 7 ] 耿美玉.新型抗阿尔茨海默病药物甘露寡糖二酸[J].中国药理学与毒理学杂志,2017,31(5):459-460.
[ 8 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:185-189.
[ 9 ] 赵统超,张宇,王丽红,等.沙棘果油索氏提取及体外抗氧化活性研究[J].安徽农业科学,2018,46(22):145-148.
[10] 王伟铧,张宇,王宇亮,等.沙棘果多酚提取工艺优化及其抗阿尔茨海默症活性[J].食品工业科技,2020,41(6):135-141.
[11] 李松,唐锴,郭一楠.健脾消食的沙棘[J].首都食品与医药,2017,24(7):57.
[12] 孙钧,柴玲霞,翟德忠,等.复方沙棘黄精颗粒联合抗痨西药治疗耐药肺结核25例[J].中医研究,2015,28(11):8-10.
[13] 赵可惠,王静,苏永文,等.藏药江孜沙棘对急性血瘀证大鼠血液流变学的影响[J].中药与临床,2016,7(5):35- 37、41.
[14] 付海荣,庞毅,谭家华,等.山豆根治疗白血病作用机制的网络药理学研究[J].中国药房,2019,30(24):3392-3398.
[15] 吴娜,毛祥坤,魏武,等.基于网络药理学和分子对接的理肠四方治疗溃疡性结肠炎分子机制的比较研究[J].中药材,2020,43(1):186-192.
[16] 颜学玲,时政,张云.金荞麦中优效组分的网络药理学研究[J].中国药房,2020,31(5):558-563.
[17] 赵杰,许波,刘金豹,等.基于网络药理学探讨牛膝治疗骨质疏松的潜在活性成分及作用机制[J].中国药房,2019,30(22):3090-3095.
[18] 姚运秀,贺桢翔,刘晓凤,等.基于网络药理学和分子对接技术的抗病毒颗粒治疗新型冠状病毒肺炎(COVID-19)的潜在物质基础研究[J].中草药,2020,51(6):1386- 1396.
[19] 付雪媛,刘丰海,张铃玉,等.海参极性脂质对东莨菪碱致痴呆小鼠学习记忆能力的保护作用[J].中国食品学报,2016,16(9):26-32.
[20] 马赫佟,祝洪艳,郜玉钢,等.人参茎叶三醇组皂苷酶解产物对三氯化铝/D-半乳糖诱导的阿尔茨海默症小鼠治疗作用的研究[J].中药材,2019,42(6):1380-1386.
[21] 高子任,李跃华.中医药治疗老年痴呆的基础研究[J].中华中医药杂志,2016,31(12):5358-5359.
[22] 邵君傲,李佳川,顾健,等.基于网络药理学的黄连总生物碱防治糖尿病的作用机制研究[J].中药材,2019,42(6):1374-1379.
[23] 杜曦.涤痰化瘀汤治疗老年痴呆38例临床观察[J].浙江中医学院学报,1995,19(1):25.
[24] 李学坚,胡文姬,邓家刚,等.析因分析法研究槲皮素对芒果苷抗炎祛痰作用的影响[J].时珍国医国药,2012,23(1):27-28.
[25] 边亚倩,李晶,彭莎,等.基于系统中药学的黄芪补气潜在功效标志物的发掘[J].中国中药杂志,2020,45(14):3266-3274.
[26] 赵文竹.玉米须功能因子活性评价及其降血糖机理研究[D].长春:吉林大学,2014.
[27] AHMAD F,SINGH K,DAS D,et al. Reactive oxygen species-mediated loss of synaptic Akt1 signaling leads to deficient activity-dependent protein translation early in Alzheimers disease[J]. Antioxid Redox Signal,2017,27(16):1269-1280.
[28] 张锐,张季林,李冰涛,等.基于网络药理学研究栀子入血成分抗阿尔茨海默病的作用机制[J].中国中药杂志,2020,66(11):2601-2610.
[29] 唐芳芳. TLR4/NF-κB及其炎性因子IL-1β在大鼠创伤性脑损伤中的表达[D]. 郑州:郑州大学,2015.
[30] 朱士彦,甘平,曹院国,等.苦参碱对高糖致大鼠腹膜间皮细胞NF-κBp65表达的影响[J].临床军医杂志,2010,38(5):689-692.
[31] CALELLA CA,NERLOV C,LOPEZ RG,et al. Neurotrophin/Trk receptor signaling mediates C/EBPalpha,-beta and NeuroD recruitment to immediate-early gene promoters in neuronal cells and requires C/EBPs to induce immediate-early gene transcription[J]. Neural Dev,2007. DOI:10.1186/1749-8104-2-4.
(收稿日期:2020-04-13 修回日期:2020-09-07)
(编辑:罗 瑞)
