‘烟73’葡萄果皮花色苷合成、修饰与转运相关基因的表达
2020-10-28田萌勃郑茗源徐国前惠竹梅
田萌勃,郑茗源,徐国前,惠竹梅,3
(1.西北农林科技大学 葡萄酒学院,陕西杨凌 712100;2.宁夏大学 农学院,银川 750000;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌 712100)
花色苷(Anthocyanin)是一种黄酮类化合物,除了在植物授粉和种子传播方面起作用外,最重要是作为植物色素使葡萄表现出各种颜色[1]。花色苷主要在内质网中合成与修饰,转运到液泡内发挥生理功能。因此研究花色苷合成,修饰与转运相关基因的表达与花色苷积累关系不仅有助于理解花色苷修饰与液泡转运,还有助于解析植物次生代谢产物的转运机制。
花色素是一种黄酮类化合物,结构不稳定,一般会在类黄酮-3-O-葡萄糖基转移酶(UDPG-flavonoid-3-O-glycosyltranferase, UFGT)作用下与一分子或几分子糖以糖苷键形式结合,合成产物就是花色苷[2]。甲基转移酶(O-methyltransferase, OMT)可将由S-腺苷甲硫氨酸(S-adenosyl-methionine, SAM)提供的甲基转移至花色苷B环羟基上,增加花色苷结构稳定性[3-4],部分花色苷还会被酰基转移酶修饰为酰化花色苷。最终各种修饰程度花色苷被转运至液泡中积累[5]。关于花色苷转运,目前共发现3种模型:(1)由谷胱甘肽转移酶(Glutathione S-transferase, GST)介导的转运:GST催化谷胱甘肽(GSH)与花色苷共价结合,形成谷胱甘肽共轭复合体(Glutathione S-conjugate),随后在液泡膜上的多药耐药相关蛋白(Multidrug Resistance-related Protein, MRP)作用下将谷胱甘肽共轭复合体转运至液泡内[6-11]。多种GST基因家族包括玉米BZ2[12]、矮牵牛AN9[13]、拟南芥TT19[14]等被证实参与花色苷转运;(2)由多药和有毒化合物排出家族(Multidrug and toxic compound extrusion, MATE)介导的转运:MATE介导花色苷跨膜转运机制依赖于H+/Na+逆向转运机制,ATP存在时,液泡膜上的MATE转运蛋白利用膜两侧H+/Na+浓度梯度作为推动力,将花色苷向液泡内转运,同时将质子泵出液泡外[15-17]。拟南芥TT12编码MATE型蛋白已被证实参与种皮中花色苷积累[18],苜蓿中MATE2编码的转运蛋白可以转运包括花色苷在内多种黄酮类化合物[19];(3)囊泡转运[20-22]。
尽管葡萄花色苷合成、修饰与转运完整通路已被建立[23],但‘烟73’作为富含花色苷的染色葡萄品种,果皮中与花色苷有关基因的表达模式及其与花色苷积累关系尚未见报道,本试验选取酿酒葡萄品种‘烟73’为材料,在分析‘烟73’葡萄果实基本品质基础上,进一步通过分析果皮中与花色苷合成、修饰与转运相关基因表达水平及其与花色苷积累关系,以探讨染色葡萄品种花色苷代谢规律,为植物次生代谢产物合成、修饰与转运机制的深入研究提供理论基础。
1 材料与方法
1.1 材料与试剂
试验于2018年在宁夏塞上江南酒庄(宁夏回族自治区青铜峡市小坝镇,105.52°E, 38.03°N)进行,供试材料为酿酒葡萄染色品种‘烟73’是中国张裕公司以‘紫北塞’为母本、‘玫瑰香’为父本,经多年选育而成的优质染色葡萄品种。2016年定植,南北行向,株行距1 m×2.5 m,树形采用“厂”字形。选择树势中庸、挂果一致的植株,采用正常田间管理,葡萄成熟期气候与往年相同。
样品采集从花后8周(转色期前)开始,每隔2周采1次样,直至采收。采样依据对角线法则。随机选取并标记10棵葡萄树,为了使取样具有代表性,分别在每棵葡萄树上、中、下部随机各选取1穗葡萄,然后分别在每穗葡萄上、中、下部各随机选取3粒葡萄,共选取10棵果树30穗葡萄,共计270粒葡萄。随机选取50粒迅速用液氮冷冻处理,随后放入-80 ℃冰箱保存,剩余220粒存入-20 ℃冰箱。
1.2 理化及多酚指标测定
随机选取100粒葡萄,揉碎过滤取汁,测定果汁可溶性固形物含量(手持糖度计法)、可滴定酸含量(以H2SO4计,g·L-1,NaOH滴定法)和pH(pH计法)。葡萄果皮单宁、总酚、总花色苷的测定参考乐小凤等[24]的方法。
1.3 基因表达分析


表1 用于实时定量PCR的引物
1.4 数据处理
采用Excel 2013对试验数据进行处理,采用SPSS 23.0软件进行相关性分析,用Duncan’s新复极差法比较差异显著性。
2 结果与分析
2.1 葡萄理化和多酚指标
‘烟73’葡萄果实在转色过程中的基本理化指标见表2,可溶性固形物及果汁pH基本呈逐渐上升趋势,成熟期(花后18周)含量分别为(23.50±0.30)%及3.59±0.10。可滴定酸含量逐渐下降,从花后8周的(25.50±0.17)g·L-1下降至成熟期的(3.22±0.03)g·L-1。
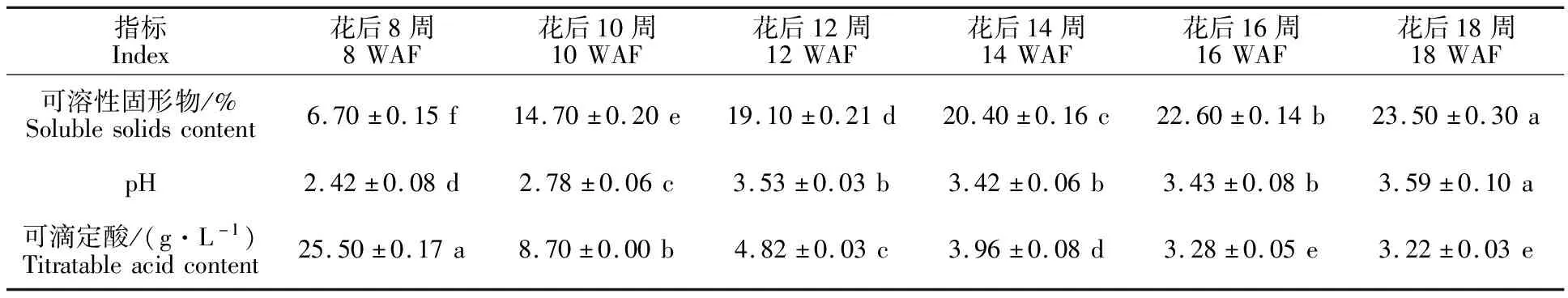
表2 不同成熟期果实理化指标
‘烟73’葡萄果皮多酚指标见图1,随着果实成熟,果皮中总酚、花色苷含量呈先上升后小幅下降趋势,单宁含量总体呈下降趋势。成熟期果皮总酚、单宁和花色苷含量分别为66.76 mg·g-1、22.32 mg·g-1和46.49 mg·g-1。葡萄理化和多酚指标说明该地区‘烟73’葡萄成熟度好,可以满足后续试验要求。
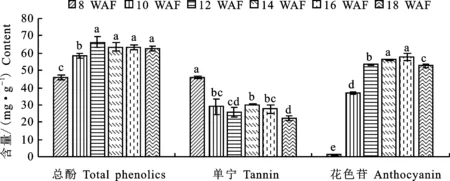
图中不同小写字母表示同一指标不同时期的差异达到显著性水平(P<0.01),下同
2.2 果皮花色苷合成,修饰与转运基因表达量
VviUFGT调控葡萄糖基转移酶,使花色素与糖结合成花色苷,VviOMT调控甲基转移酶,参与花色苷甲基化进程。因此对VviUFGT和VviOMT及可能参与花色苷转运的VviGST和AM进行荧光定量PCR分析。由图2可见,‘烟73’葡萄果皮中,VviUFGT、VviGST1、VviGST2、VviGST3、VviGST4表达量先上升,在花后10周达到最高值后逐渐下降,在花后 12~14周变化差异基本不显著。VviOMT表达量呈下降趋势,花后8周和10周表达量较高,且与其他时期存在显著性差异。AM1与AM3表达量呈“M”型变化,在花后10周和14周表达量较高,并与其他时期存在显著性差异。

图2 不同成熟期‘烟73’果皮中花色苷相关基因相对表达量
2.3 花色苷积累量与基因表达水平的相关性
为了解这8个基因与花色苷积累量之间共同变化趋势,对‘烟73’不同成熟期果皮花色苷积累量和8个花色苷合成、修饰与转运基因表达量进行相关性分析(表3)。结果表明,在‘烟73’品种中,这8个基因都与花色苷积累量呈正相关,其中VviGST1和VviGST2与花色苷积累量呈显著相关,VviGST3、VviGST4与花色苷积累量呈极显著正相关。说明这4个基因都参与花色苷的液泡转运,特别是VviGST3、VviGST4发挥了主要作用。VviOMT与VviGST1显著相关,说明VviGST1与花色苷的甲基化有关。
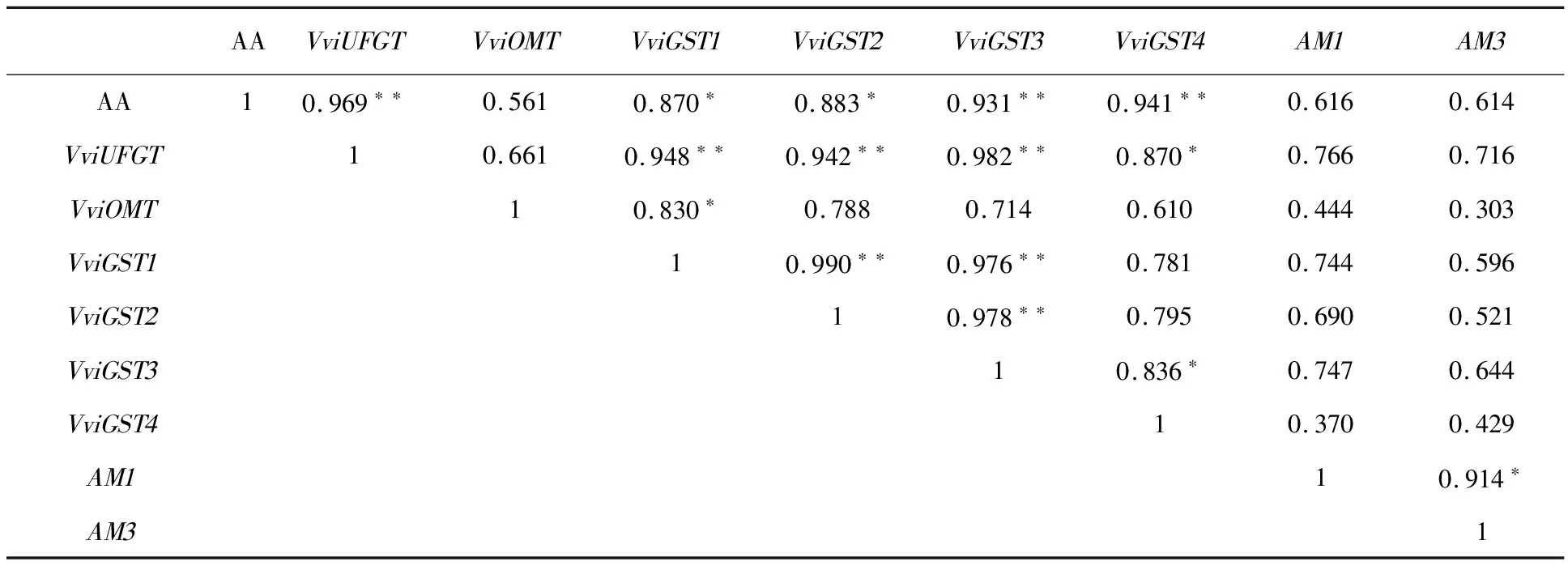
表3 ‘烟73’果皮花色苷积累量与基因表达量间相关性
3 讨 论
酿酒葡萄只有具备一定含量的可溶性固形物,同时具备一定含酸量,才有酿造优质葡萄酒潜力。酚类物质是一类重要植物次生代谢产物,可以保护植物机体内生物大分子免受氧化损伤[26],也是鉴定葡萄成熟情况的重要指标。宁夏贺兰山东麓地区光热条件好,日较差大,葡萄生长季干旱少雨,十分利于葡萄生长以及糖类物质,多酚物质的积累。该地区‘烟73’可溶性固形物含量适中,可滴定酸含量较低,说明葡萄果实理化成熟度较好。果皮多酚物质与其他欧亚种葡萄如‘蛇龙珠’‘梅鹿辄’等相比,总酚和单宁含量是其5~10倍[24, 27]。同时‘烟73’作为染色品种,成熟期果皮总花色苷含量达到52.49 mg·g-1,也远高于其他红色酿酒葡萄品种,具有较高红葡萄酒调色价值[28]。综上,本地区‘烟73’葡萄果实品质较好,成熟度较高。
Pilati等[29]通过基因组分析表明,“转色前期”是细胞代谢的重组阶段,伴随着大量激素传导和众多基因表达。因此本试验所测8个与花色苷合成、修饰与转运相关基因在转色前期表达量较高。其中VviUFGT调控类黄酮-3-O-葡萄糖基转移酶(UFGT)催化不稳定的花色素糖苷化形成各种类型花色苷,是花色苷生物合成途径中最关键的酶[30]。在本试验中,‘烟73’UFGT表达量在花后8~10周迅速上升,果皮总花色苷在这段时期也迅速积累,两者具有较高相关性,这证明了UFGT对花色苷合成的调控作用[3]。O-甲基转移酶(OMT)催化花青素-3-O-葡萄糖苷和花翠素-3-O-葡萄糖苷甲基化,生成甲基花青素、甲基花翠素和二甲基花翠素葡萄糖苷。‘烟73’VviOMT相对表达水平较高,说明‘烟73’葡萄果皮中甲基化花色苷含量较高,同时与其他7个基因不同,VviOMT在花后8周的表达量最高,说明在花后8周时VviOMT还参与除花色苷外其他黄酮类化合物的甲基化进程,这也在Kim等[31]和Cho等[32]的研究中得到验证。GST是与花色苷转运有关的酶,GST家族基因可以分为Phi、Zeta、Theta、Tau、DHAR和Lambda亚类,其中Phi和Tau类GST为植物中特有[33]。VviGST1是与BZ2高度同源的Tau类GST,有报道表明VviGST1可以在与GSH结合情况下转运包括花色苷在内多种黄酮类化合物[9],本试验中,VviGST1与花色苷积累相关,说明VviGST1参与花色苷转运,并且其与控制花色苷甲基转移酶基因VviOMT的相关性系数说明VviGST1可能参与甲基化花色苷转运,这是关于GST家族基因对花色苷转运的新见解,但其对甲基化花色苷的转运机制还需进一步研究验证。VviGST3和VviGST4是Phi类GST,通过分子对接分析表明,此类GST主要转运原花色素等黄酮类化合物,还能协同转运GSH,但其对花色苷转运不依赖GSH,并且响应不同信号刺激[8],因此VviGST3和VviGST4相对表达量远高于VviGST1是转运原花色素、转运GSH等物质以及两者的结构不同导致。关于VviGST2的研究较少,本试验中VviGST2与VviUFGT、VviGST1和VviGST3的表达模式呈极显著相关,说明VviGST2在参与花色苷转运同时,可能还参与原花色素转运。所有4个GST家族基因在转色期相对表达量共同达到最高值,因此花色苷合成与转运在时空上可能具有较高的协同性。葡萄MATE型转运蛋白基因anthoMATE(AM)同源于拟南芥TT12,定位于液泡膜并负责转运花色苷特别是酰化花色苷[15],本试验中AM1与AM3在转色期表达趋势相近,说明AM1与AM3在转色期发挥相近功能,但未见AM1或AM3与花色苷积累量相关,这可能是花色苷酰化进程与总花色苷积累趋势的差异导致,若能监测转色期酰基转移酶活性或其对应基因表达量变化趋势,则能较好地解释AM对酰化花色苷的转运作用。
4 结 论
本研究通过分析‘烟73’葡萄理化、多酚物质含量,同时分析与花色苷合成、修饰和转运相关基因表达水平,以期为染色葡萄花色苷代谢通路提供理论基础。结果表明,成熟期‘烟73’理化及多酚成熟度较好,在葡萄酒生产中有较高调色价值。基因表达水平与花色苷积累的相关性分析显示,VviUFGT调控果皮中花色苷合成。GST家族基因参与果皮花色苷转运,并且VviGST1与VviOMT的相关系数显示,VviGST1可能参与甲基化花色苷的转运。
