Fe3+和Al3+分离实验的微型化
2020-10-26段秀琴张晔范强
段秀琴 张晔 范强
摘 要:在Fe3+和Al3+分离实验中,乙醚用量大、空气逸散量大,因此造成环境污染。针对给环境和操作者带来危害的现象,用微型仪器代替常量仪器分离Fe3+和Al3+离子。用分光光度法对萃取多次的水相产物进行分析。实验数据表明,常量法萃取三次的吸光度为0.055,萃取五次的吸光度为0.005,而微量法萃取三次的吸光度为0.004。微量法萃取三次完全达到常量法萃取五次的分离效果。每次实验可减少乙醚用量约2000mL,减少乙醚的逸散量约500mL,逸散率仅为常量的3.4%,极大降低了乙醚的逸散率,减轻了对环境的污染,符合绿色化学的要求。
关键词:萃取分离;绿色化学;微型化
中图分类号:O06-332 文献标识码:A 文章编号:1673-260X(2020)09-0013-04
绿色化学是当今国际化学科学研究的前沿。目标是化学过程不产生污染[1]。绿色化学十二条原则中谈到,要尽可能不使用、不产生对人类健康和环境有毒有害的物质。但是,在实验教学中,实验室污染非常严重,已经成为一类典型的小型污染源,其危害不可估量[2]。
因此,要按照绿色化学的原则,在研究中尽量减少实验室的污染,这是科研工作者的研究理念。
而实现实验绿色化的有效途径之一是实验的微型化。自从20世纪80年代美国科学家在基础有机化学的微型制备实验研究中取得成功后,微型化学实验的探究与应用就成为一种趋势[3]。
微型化实验,就是以尽可能少的化学试剂,在微型化学仪器中,获取所需化学信息的实验方法与技术[4]。微型化实验是化学实验的创新性变革,未来化学发展的趋势。采用微量化实验的方法,试剂用量比常规实验可节省约70%—90%[5]。但却可以达到准确、明显、安全、节约药品和防止环境污染的目的[6-8]。在化学实验教学中,实验的微型化,是降低污染的有效手段。在减少试剂用量的同时,往往也能节省实验所需要的时间。因此,近年来在化学实验中得到广泛应用[9-10]。
常规方法的Fe3+和Al3+分离实验过程中,乙醚用量较大且回收率低。乙醚是挥发性较强的液体,且对人体有较强的毒害作用。吸入大量乙醚蒸氣会导致失去知觉,乙醚曾经被用作外科手术上的全身麻醉剂[11]。
鉴于乙醚的危害较大,本文对Fe3+和Al3+分离实验的微型化做了探讨。用微型仪器代替常量仪器分离Fe3+和Al3+离子。用分光光度法对萃取的产物进行分析。结果表明,用微量法萃取三次,完全可以达到常量法萃取五次的分离效果。即节省了原料,降低了污染物的排放,还缩短了实验时间,缩短了人与有害物的接触时间,有效降低了对人的危害。
1 实验
1.1 仪器与试剂
试剂:乙醚、三氯化铁、三氯化铝、浓盐酸、硫氰化钾均为分析纯。
仪器:紫外-可见分光光度计(北京普析通用仪器有限责任公司);100mL分液漏斗、25mL滴液漏斗、25mL蒸馏瓶、5mL\10mL注射器、1mL\5mL吸量管、微型蒸馏装置(中国教学仪器设备上海公司,高中微型化学实验箱ML-2A,专利号:ZL94243806)等。
1.2 实验原理
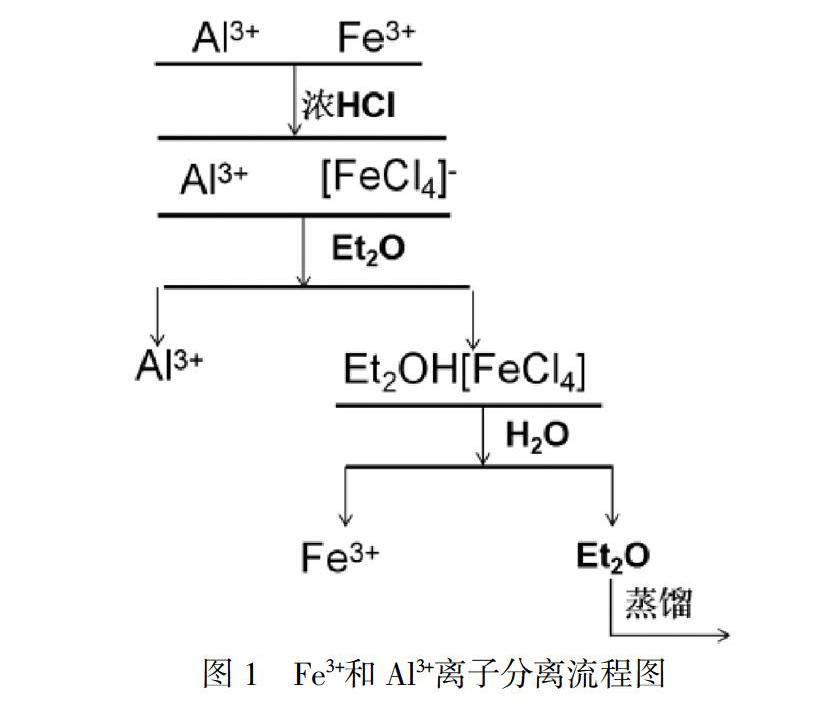
Fe3+离子与Cl-离子在6mol.L-1的盐酸中,能够生成[FeCl4]-四氯合铁配离子。在强酸和乙醚(Et2O)的萃取体系中,Et2O与H+氢离子结合,生成较大体积的乙醚-氢配离子(Et2O·H+),[FeCl4]-四氯合铁配离子也有较大的体积,乙醚-氢配离子和[FeCl4] –四氯合铁配离子均有较低的电荷。因此,容易形成缔合物Et2O·H+·[FeCl4]-。在这种离子缔合物中,Cl-氯离子和Et2O分别取代了Fe3+三价铁离子和H+氢离子的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,加入乙醚后Fe3+就从水相转移到有机相。
在6mol.L-1的盐酸中,Al3+离子与Cl-离子生成配离子的能力很弱,因此Al3+仍然留在水相中。通过萃取,分离为有机相和水相。
在含有Fe3+离子的有机相中加水,使体系的H+离子浓度和Cl-离子浓度降低。在这种条件下,乙醚-氢配离子Et2O·H+与[FeCl4]-配离子解离趋势增加,Fe3+离子又生成了简单的水合铁离子,被反萃取到水相中。由于乙醚沸点较低(35.6℃),因此,采用普通蒸馏的方法,就可以实现水和乙醚的分离。这样Fe3+离子又恢复到了初始的状态,从而达到了Fe3+和Al3+分离的目的。流程如图1。
1.3 装置图
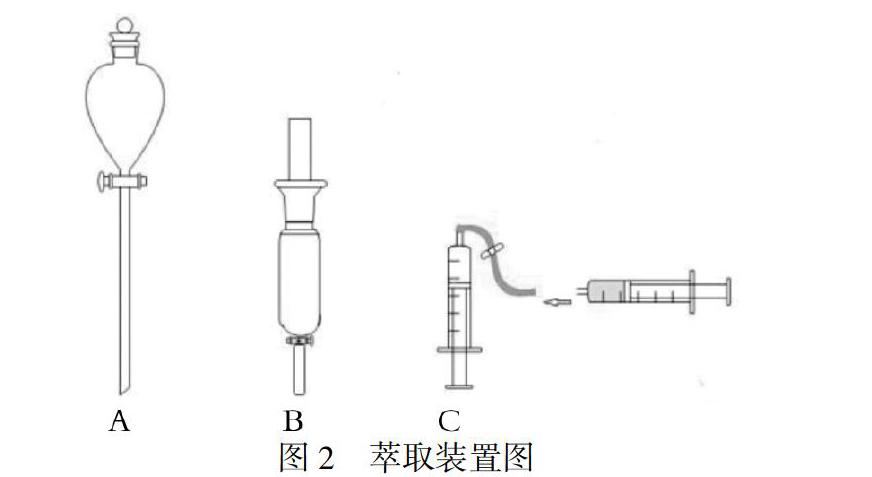
图2是萃取装置。该萃取装置中的A是常规用的100mL梨形分液漏斗。B是一个25mL滴液漏斗,和梨形漏斗相比,中部呈柱状,容积略小。装置C由两个注射器(5mL\10mL)和一段乳胶管构成,替代常量仪器。改进后的萃取装置与常规装置的主要不同有两点,一个是漏斗的容量小,由常规容量改为微量;另一个是漏斗为圆柱形。漏斗细长,虽然振摇后静置分层时间略长,但分离较彻底,可以减少萃取次数[12]。
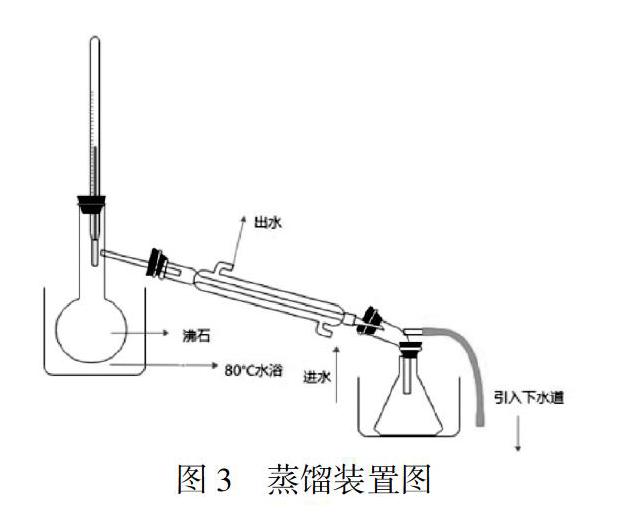
图3是蒸馏装置。仪器规格有常规和微型两种。
1.4 萃取
混合液的制备。以1:1的体积比,分别移取5% FeCl3溶液和5% AlCl3溶液,混合均匀,再加入等体积的浓盐酸,制备成混合液。
分别用装置A、B、C进行萃取实验,探索萃取分离效果及乙醚的使用情况。
首先按照常规方法[8]。用装置A萃取。将30ml混合溶液和30mL乙醚,先后倒入100mL梨形分液漏斗,盖上瓶塞,摇晃均匀后,放气,静置,待分层后,从下端放出含有Al3+的水层,再从上端倒出含有Fe3+的乙醚层。由于每次萃取量有限,此时水层会呈明显的黄色,说明水相中依然含有大量Fe3+。因此,要继续进行萃取。
将含有Al3+的水层倒回分液漏斗,再次加入30mL乙醚,进行第二次萃取。盖上瓶塞,摇晃均匀后,放气,静置,待分层后,从下端放出含有Al3+的水层,再从上端倒出含有Fe3+的乙醚层。如此重复操作四次。
鉴于柱形漏斗分离效果较好的特点,我们改用25mL滴液漏斗,用装置B进行萃取实验。同时减少混合液的用量为8mL,加入8mL乙醚。操作方法与常规方法相同。
最后用装置C进行萃取,用5mL注射器抽取1.5mL混合液,再抽取等体积的乙醚。拔下针头,在出口处连接乳胶管,乳胶管上放置一个输液器上的控制阀。充分摇动,通过控制阀进行放气操作,重复几次摇动和放气后,将注射器倒置在铁架台上静置。待分层后,用另一个注射器抽出上边含Fe3+的乙醚层。然后给萃取装置再次按上针头,抽取乙醚,进行第二次萃取。如此重复操作四次。
装置C有三个优点,第一、可以实现微量化,每次萃取仅用1.5mL乙醚。第二、针管为柱形,相当于柱形漏斗,柱形漏斗有利于更好地萃取。第三、在移取乙醚及乙醚和水两相分离时,可以采用抽出的方法,和常规的倾倒方法相比,避免了乙醚与空气更多地接触,降低了乙醚在空气中的逸散量。
1.5 蒸馏
将三种萃取方法所得的乙醚相,分别用常量仪器和微量仪器进行蒸馏,根据蒸出乙醚的量,计算乙醚回收率和逸散量。
1.6 分析测定
Fe3+与SCN-在酸性条件下,可以生成血红色配合物。该反应非常灵敏,据此分析水相中Fe3+的含量。
Fe3++SCN-=[Fe(SCN)]2+(血红色)
首先移取1mL5%FeCl3溶液,加入4mL0.1mol.L-1的KSCN溶液,稀释到10mL,在分光光度计上进行全波段扫描,确定硫氰合铁配离子的最大吸收峰。
移取萃取分离后的水相溶液1mL,加入1mL 0.1mol.L-1的KSCN溶液,稀释到10mL,在最大吸收峰处用分光光度计测定吸光度,从而确定水相中Fe3+的含量。
测量蒸馏出来的乙醚体积,计算回收率和逸散量。
回收率的计算:回收率%=×100%
逸散量=使用体积-回收体积
2 结果分析
2.1 最大吸收峰的确定
经过全波段扫描,得到图4。从图谱中看出,硫氰合铁的最大吸收峰在465nm处。
2.2 萃取分离效果分析
在465nm处,对三种萃取分离方法得到的水相产物,分别测定吸光度。用萃取装置A,使用30mL乙醚,第一次萃取物吸光度为0.974。第五次产物基本无色,吸光度为0.005。
用B装置,改梨形漏斗为柱形滴液漏斗,混合物减少到8mL,和梨形漏斗的分离效果比,吸光度明顯变小。第一次萃取物吸光度为0.569。第四次产物基本无色,吸光度为0.004。说明Fe3+的含量明显减少,每一次的分离效果明显变好。但也需要萃取四次以上。
改用C装置,用医用注射器替代漏斗,混合液的体积进一步减少为1.5mL,第一次萃取物吸光度为0.432。萃取分离三次的吸光度为0.004,已经低于常量萃取五次的数值,达到常量分离五次的效果。与装置B相比,滴液漏斗的下部为球形,不是柱形。而注射器是规整的柱形,非常有利于分离。
由图5也可以看出,装置C的每一次萃取效果,都明显好于前两个装置。
2.3 乙醚回收率
我们将乙醚的用量和回收量进行了统计。从乙醚的耗用量来看。因为用C装置萃取,仅仅三次就可以达到分离的目的,而且每次只用1.5mL,所以乙醚总用量是4.5mL。而用A和B装置萃取,均需要萃取五次,乙醚总用量分别为150mL和40mL。使用A和B装置萃取,不仅乙醚的用量大,而且因为乙醚易挥发,又由于操作中有倾倒乙醚的过程,逸散到空气中的量增多,回收量明显降低,逸散量分别为38mL和9.6mL。而装置C的逸散量仅为1.3mL。尽管回收率相差不大,均在70%以上,但逸散总量却相差很多,直接影响环境中乙醚的含量。
通常情况下,一个实验室要有14组以上的学生一起做实验。根据表1的统计情况,我们做了进一步计算。逸散到实验室的总量分别为:
装置A用30mL混合液,需要萃取五次,每次实验逸散乙醚:38×14=532mL。
装置B用8mL混合液,需要萃取五次,每次实验逸散乙醚:9.6×14=134.4mL。
装置C微量法用1.5mL混合液,每次逸散乙醚1.3×14=18.2mL。
用注射器萃取乙醚逸散量占常规法的百分数为18.2÷532=3.4%。
从计算结果看,微量法的逸散量仅仅是常规的3.4%,大幅度减少了乙醚对环境的污染。微量法每次实验可节省乙醚2037mL。在实验室的逸散量可以减少513.8mL。常量实验
与微量实验相比,相当于多逸散约一瓶试剂的乙醚。
3 结论
实验证明,将常量法改为微型实验,是完全可行的。经过更换仪器减少试剂用量,经过三次萃取,仅用4.5mL乙醚就可以达到Fe3+和Al3+分离的目的。每次实验比常量法节省乙醚约2000mL。让学生学会分离萃取的方法的同时,大大减少了乙醚的用量和空气中的逸散量,逸散量比常量法减少约500mL,逸散量仅为常规方法的3.4%。极大程度的减少有害物质的释放量,降低了对实验室的污染。另外萃取的次数减少,整个实验的时间缩短,这样就缩短了学生在实验室停留的时间,减轻了与乙醚的接触,减轻了对健康的危害。总之,该实验的微型化是完全可行的,是非常必要的。
——————————
参考文献:
〔1〕胡常伟,李贤均.绿色化学原理和应用[M].北京:中国石化出版社,2002.
〔2〕徐静年,苏建茹,郭奋.高等实验室污染不容忽视[J].实验技术与管理,2005,22(11):130.
〔3〕杨天林,杨文远,倪刚.改革实验教学,走绿色化学之路[J].实验技术与管理,2012,29(04):18.
〔4〕刘爱文,赖悦腾,高永辉.微型化学实验在无机化学实验中的实践与评价[J].广东化工,2006,33(09):93.
〔5〕周宁怀,迟玉兰,沈君朴,等.微型无机化学实验[M].北京:科学出版社,2000.
〔6〕杨庆.加强高校化学实验室绿色化的思考[J]广东化工,2015,42(09):229-230.
〔7〕钟国清,吴治先,白进伟.硫酸亚铁铵的绿色化制备与表征[J].实验室研究与探索,2015,34(02):46-49.
〔8〕钟国清.滴定分析化学实验的小量化和减量化改革与实践[J].实验技术与管理,2013,30(10):186-189.
〔9〕吴文华,史同娜,施镇江,等.微型实验在材料加工中探索与实践[J].实验室研究与探索,2015,34(01):48-51.
〔10〕王敏,蒋炳英,李军,等.有机化学实验微型法教学改革的探索[J].实验室科学,2012,15(03):12-14.
〔11〕汪小兰.基础化学[M].第1版.北京:高等教育出版社,1995.
〔12〕赵新华.无机化学实验[M].第4版.北京:高等教育出版社,2014.
