以“氯气的性质”例说元素化学的“实验化教学”
2016-11-16李虎山
摘要:如何在“非金属元素及其化合物”的教学中由传统讲授型向“实验化教学”转移,文章以“氯气的性质”浅述例说,并期待抛砖引玉。
关键词:实验教学法;形象记忆;实验设计;验证性;探究性;微型化
文章编号:1008-0546(2016)10-0081-02 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.10.028
高中化学“元素及其化合物”部分的核心思想,就是通过元素单质及其化合物性质的学习,提高学生对“化学是一门以实验为基础的科学”的认识,培养学生的实验意识、操作技能,观察能力和分析问题的能力[1]。通过结合实验的教学并侧重于实验为主线进行的课堂设计,进而让学生系统掌握“元素及其化合物”的学习方法,实现学生实验能力的提升与发展。
一、从事实现象提出问题
笔者曾听过多所学校的青年教师的“氯气的性质”公开课。多数老师采用的是:“物理性质(展示氯气以供观色)→化学性质(演示氯气与氢气混合光照、氯水的漂白等系列实验)→由性质推及制法与用途”的经典但很传统的授课模式。尽管老师们都试图突破传统,如采用先实物展示,再根据其所观察到的理化性质加以总结归纳……但仍给人以脱不开“以讲为主的灌输式教学”烙印之感,没有充分利用化学以实验为基础的学科教学优势。作为“旁观者”,我想,如果根据所学元素的性质精心设计实验,甚至将实验贯穿于整个“元素及其化合物”的教学始终,再结合实验思考题,那学生获得的学习体验将会是更好的,他(她)的观察、思维、探究等综合学习的能力也定会得以提升。怎样设计这样的实验呢?
二、基于问题的解决方法
非金属元素氯、氮、硫等的单质、氧化物、氢化物、含氧酸及其盐的许许多多的物理化学性质,都可以设计成系列实验进而将整个知识体系贯穿起来,从而实现元素化合物的“实验化”教学。下文以“氯气的性质”为例,示设如下:
1. “实验化教学”思路
氯气是活泼的非金属气体,有强烈的刺激性气味,有毒,易液化,在水中的溶解度为1∶2.0,溶于水形成黄绿色的氯水,并与水反应生成HClO(极不稳定、极强氧化性、漂白性且有弱酸性);氯气氧化性极强,能与几乎所有的金属反应,能与碱、还原性酸、还原性盐等物质反应。Cl2与水的反应内容丰富,知识点众多,且与水生成的HClO因具有强氧化性,而使有机色素发生漂白褪色,但干燥的氯气则不能,这一现象会给学生留下先疑后释的思维冲击,从而加深对氯水成分的深刻认识,而氯水中各成分的分析正是本课需要重点讨论的内容之一。所以优化编制好实验的先后顺序并设计好实验流程,会让学生在鲜明的实验现象的“耳濡目染”下取得良好的学习效果。
2. “实验化教学”设计
[实验Ⅰ]①出示一瓶氯气,观色、闻味,后放入一片红色布条,置于桌面2到3分钟;②在静候现象时完成如下实验:将收集有30mL氯气的针筒吸进10mL的水,观察现象;③用酒精喷灯加热密封有氯气的“香蕉管”的一端,观察现象。
[问题Ⅰ]①集气瓶中观察到的现象说明什么问题?②据针筒中的现象你能得到什么结论?③怎么解释加热时“香蕉管”的一端却出现了黄绿色的液体?
依据学生的反应或引导或追问,最终通过实验现象的分析,让学生得到氯气的诸多物理性质(色、态、味、溶解性和常温下的溶解度以及易液化等性质)包括干燥氯气无漂白性的结论。
这一阶段,教师实际上无须讲述太多,因为现象“鲜活”,学生大多会轻松有效地完成氯气物理性质及部分化学性质的学习。
[实验Ⅱ]①打开放有色布条的氯气瓶塞,滴水将布条润湿,注意观察现象;②将“实验Ⅰ”针筒里的溶液分别滴加到盛有AgNO3、NaHCO3、淀粉-KI溶液、品红溶液的四支试管中,观察现象。
[问题Ⅱ]①的现象说明什么问题?你是怎样推理到这一结论的?
②中分别观察到什么现象?其对应的离子方程式如何书写?通过分析说明氯水中含有哪些分子,哪些离子?
[说明]由于此处设计的验证性实验较多,所以应该分门别类地对每一组实验取得的现象进行讨论、分析、研判,由此推理得出氯水中所含的各种成分,特别是与淀粉-KI溶液形成蓝色时,I2到底是被何物质氧化而来?而品红褪色又是谁的功劳?这些都是本课的关键之处。
通过上述的实验设计,基本上完成了氯气物理性质的观察与总结,氯水成分的分析与推理,而所有这些都是以眼见为实的实验现象展现在学生面前的,对照实验现象的分析以及由此得到的结论也是学生亲自体验并自行完成的。
[实验Ⅲ]①展示一倒置烧瓶(告知学生:这是课前制得的一满瓶饱和氯水,倒立水槽中并在阳光直射下二小时以上)。②将烧瓶中溶液取出,分别滴加到硝酸银溶液、蓝色石蕊试纸、CaCO3粉末中,观察发生的现象。
[问题Ⅲ]①倒置的烧瓶底部有一较大的无色气泡,通过观色确定不是氯气,则可能是什么气体?如何验证你的推测?②中的现象表明溶液中含有Cl-、H+,还有其他物质存在,它能使蓝色石蕊试纸褪色,可与CaCO3反应,这些物质可能是什么?如何证明你的猜测?
事实上问题②的提出是在原有问题基础上的再深化,是为深入探究HClO的强氧化性、漂白性和酸性弱于H2CO3而设计的。那么怎样检出氯水中加入CaCO3后HClO的浓度提高了呢?这是整个实验设计中比较困难的部分。可以启发学生设计对比实验加以验证:理论上可以将新制氯水和加入了CaCO3粉末后的新制氯水,同时在阳光下照射,观察其冒气泡的快慢程度,进而推断出HCl、H2CO3、HClO三者的相对强弱。但现象的对比会因光照强度、观察环境、等待时间等因素的不同而存在一定的不确定性。讨论以上问题时学生或热烈或冷场,作为老师要时刻关注并积极调控学生的情绪。
另一思路是,借助传感器(这要视学校条件而定),引出如下“可视化”的实验:
[实验Ⅳ]用两只小烧杯,取新制饱和氯水25mL,一支加入2g左右的CaCO3粉末后,搅拌静置,一支不作变化。连接好电脑与H+浓度传感器,分别测定溶液中c(H+),投影测定曲线。结果表明与CaCO3反应消耗了溶液中大量的H+;再换成检测HClO含量的余氯传感器(烟台东润仪表有限公司DRCL-99 极谱型余氯检测仪),结果表明加CaCO3的试管中HClO的浓度增大了。
[问题Ⅳ]上述实验的结论说明什么?为何消耗了酸反而换来了HClO浓度的增大?
实验设计和问题讨论目标明确,指向的都是氯气性质的核心知识点,作为“氯气的性质”的教学,其主要的核心内容在本设计中几乎都得以体现,而且现象与结果直观可靠。
3. “实验化教学“效果
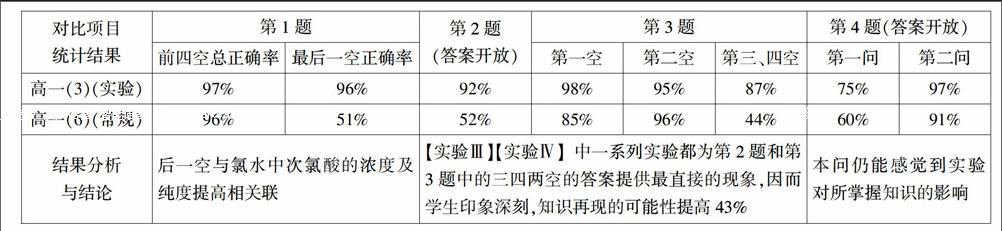
课后一周,笔者在所教的两个平行班(“实验化教学”班与“常规教学”班)做过一次比较性小测试(4大题共50分限于篇幅,此处不再列出题目)结果如下:
对比实验与采集的数据(数据4舍5入全部取整)如下:
数据表明,将元素单质或化合物呈现的某些性质巧妙地设计成表征性、验证性或探究性实验,对元素化学的学习来说,其作用和效果都是不错的。
三、实验设计的原则
上述实验设计对于“氮的氧化物、氢化物(氨气)及其盐、氮的含氧酸及其盐”;“硫的氧化物、氢化物、含氧酸(硫酸、亚硫酸等)”的教学也有一定借鉴作用,关于元素化学“实验化教学”中的实验设计须注意如下几点:
(1)要根据所学元素的知识,认真思考实验设计的内容,实验现象呈现的先后和所要达成的实验教学目标,切忌仅仅为了热闹好玩吸引学生眼球而进行实验和问题设计。
(2)由于实验过程的现象综合而复杂,除在实验及课程的设计上要认真谋划外,对可能会耗时较多的实验,可做前期的准备工作,例如先配好溶液,搭好装置等;实验现象展示时应该尽可能将现象完整明显地呈现给每位同学,以便学生通过现象,依据创设的问题去寻找结论或结果。
(3)根据不同元素的特点,还可以进行分组实验,采用“微型化”实验等,让学生参与其中,既给了学生更清晰的实验现象,又在大大满足学生的参与欲望的同时,提升其动手能力。
(4)课堂上能通过实验解决说明的问题,那就少讲或不讲,能做的实验就不要以实验视频代替,能亲自体验实验就不必以课本结论为据……总之要将“实验化”充分发挥、充分挖掘!
四、课堂实践的点滴反思
“实验化教学”在学生掌握与记忆“元素化学”知识时是有优势的,常言道“百闻不如一见”也说明了这一点。同时“实验化教学”对于提升学生观察能力、思维能力、思维的品质皆有其优势,如此,就值得去推行去尝试,因为“教育就是生长,其本质是人的发展,也就是说,教育的过程就是发掘人的天性、潜能以及潜在价值的过程[4]。”
“实验化教学”的优点是在提高学生的学习兴趣的同时,可以将整个元素及化合物的知识巧妙地穿插在所设计的实验中,让学习者去观察、发现、分析、讨论、概括直至进行探究性尝试,培养学生多渠道获取知识及信息加工的能力,让学生逐步掌握学习元素化合物知识的一般方法,这正是“实验化教学”的优势所在[5]。
参考文献
[1] 人民教育出版社课程教材研究所化学课程教材开发中心.普通高中课程标准教科书·化学1(必修) 教师教学用书[M].北京:人民教育出版社,2007:38-43
[2] 江苏省教育考试院. 2013江苏省普通高中学业水平测试(选修科目)说明[M].南京:江苏教育出版社,2013:32
[3] 北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学下册[M].北京:高等教育出版社,2003:456
[4] 林格. 教育是一种大智慧 [M].北京:清华大学出版社,2007
[5] 李虎山.“金属元素及其化合物”的“实验化教学”方法初探[J]. 化学教与学,2014(12):33~34,46
