荞麦叶大百合组织培养初步研究
2020-10-26李婷婷李娜李波汪小飞万志兵
李婷婷 李娜 李波 汪小飞 万志兵


摘 要:目的:荞麦叶大百合长期处于野生状态,不适宜连续分球、扦插等繁殖方式。采用组织培养进行繁殖,探究启动培养、诱导愈伤组织及不定芽的最佳培养基,以期建立荞麦叶大百合快速繁殖体系。方法:所有实验采用MS基本培养基。在外植体灭菌实验中,采用75%乙醇与0.1%升汞灭菌,对比污染率与诱导率筛选最适消毒方式;鳞片启动培养实验中,附加不同浓度的6-BA与NAA,计算并对比诱导出愈伤组织或不定芽的诱导率;诱导愈伤组织实验中,采取不同浓度的2,4-D与相同浓度的6-BA(0.5mg/L)和NAA(0.1mg/L)进行配比来诱导愈伤组织,并比较诱导率;在诱导不定芽分化的实验中,不同浓度的6-BA(0.5、1.0、1.5、2.0mg/L)与NAA(0.1mg/L)诱导愈伤组织分化不定芽。结果:以75%乙醇50s,0.1%升汞8min,对鳞片的灭菌作用最好;MS+1.5mg/L 6-BA+0.1mg/L NAA最适于鳞片的启动培养,诱导率高达90.67%;MS+0.5mg/L 6-BA+0.1mg/L NAA+2.0mg/L 2,4-D的培养基对叶片愈伤组织的诱导效果最佳,诱导率为49.43%;MS+2.0mg/L 6-BA+0.1mg/L NAA时,愈伤组织分化的不定芽数量最多,诱导率达到78.81%。
关键词:荞麦叶大百合;组织培养;鳞片
中图分类号:Q943.1 文献标识码:A 文章编号:1673-260X(2020)09-0022-05
引言
荞麦叶大百合(Cardiocrinum cathayanum),多年生粗壮草本植物,属百合科大百合属,多处于野生状态,为中国特有[1,2],在我国江苏、浙江、安徽、江西、湖南、湖北等地均有分布,生长在海拔600~1050m的山坡、谷地疏林和灌木丛中,是华中华东分布的特有种[3,4]。大百合属植株高大,姿态挺拔优美,春季萌发基生叶莲座状,叶片碧绿油亮,夏季总状花序顶生,花大洁白而美,可做切花、盆花和花境植物等,具有较高的观赏价值[5]。大百合属基生叶的叶柄基部膨大形成鳞茎,富含多种营养物质,鳞茎研磨后可取食,具有保健和营养价值[6]。百合属植物具有药用功能,果实入药[7],已研制出具有清肺止咳、解毒、散瘀功效的药用百合七,作为一味中药广泛运用[8]。
百合科植物通常通过扦插、分球或分株进行繁殖,荞麦叶大百合为野生,繁殖多采用种子繁殖和分球繁殖,种子发芽率极低,而分球繁殖具有繁殖率低,不能满足规模化生产的需要,而且这些繁殖方式容易造成百合品质和优良性状的退化,使荞麦叶大百合的价值降低,在一定程度上影响野生花卉荞麦叶大百合的推广和应用[9,10]。
解决荞麦叶大百合繁殖问题较为行之有效的方法是进行组织培养,组织培养能在短期内大量快速繁殖,是有效的商业化、产业化生产的途径。本实验对荞麦叶大百合的组织培养进行初步研究。而鳞茎一般作为百合科植物组织培养的外植体[11,12],本实验同样采用鳞茎作为启动培养的外植体,但由于鳞茎长期生长于地下,具有大量的真菌和细菌,很难做到完全消毒灭菌,总体上污染率偏高。本实验通过75%乙醇与0.1%升汞的处理,筛选污染率较小的消毒方法为后续实验做准备。
采用组织培养的方法繁殖大百合,可以加快繁殖速度,荞麦叶大百合虽一直处于野生状态,但目前对其离体培养已有了一定的研究,并且得到了一些较理想的方法[11-13]。以往在百合科植物进行组织培养的研究中,肖玉菲[13]等人在进行大百合鳞茎诱导出芽的实验中,采用不同浓度梯度的6-BA和NAA处理大百合鳞茎,观察接种后是否产生愈伤组织,或产生不定芽。结果表明,MS+5mg/L 6-BA+0.1mg/L NAA更有利于誘导鳞茎产生愈伤组织,作为启动培养基;马生军[13]等人以不同浓度的6-BA和NAA进行配比诱导不定芽分化,其中MS+1.0mg/L 6-BA+0.5mg/L NAA为最佳诱导不定芽培养基。
本实验首先以鳞茎为外植体,以MS为基本培养基,附加不同浓度6-BA与NAA,通过对比诱导率筛选最适启动培养基;在诱导愈伤组织的实验中,在MS+0.5mg/L 6-BA+0.1mg/L NAA培养基的基础上附加不同浓度的2,4-D,对比愈伤组织的状态与诱导率选出最适愈伤组织诱导培养基;成功诱导愈伤组织后,不同浓度的6-BA与0.1mg/L NAA配比,附加于MS基本培养基中诱导不定芽的分化,并将在培养过程中生根的组培苗移栽至温室中,以期达到后续可持续利用的目的。同时,为荞麦叶大百合的人工培养和大量繁殖提供理论依据,更好地开发利用荞麦叶大百合资源。
1 实验材料与方法
1.1 实验材料
荞麦叶大百合的外植体为鳞茎,取自安徽省黄山风景区温泉附近的荞麦叶大百合野生群落,取回后立刻对其进行假植。
1.2 培养基及培养环境
1.2.1 培养基
实验以MS为基本培养基,不同的培养阶段设置不同激素浓度组合。
1.2.2 培养环境
培养室温度为25±2℃,空气相对湿度为70%,日光灯光源,光照强1000lx,光照12h/d。
1.3 实验方法
1.3.1 外植体的预处理
取生长健壮、无病虫害的荞麦叶大百合鳞茎作为外植体,清洗表面泥污,小心剥离鳞茎,将中层内层的鳞片在洗衣粉溶液中浸泡5min,再用自来水流水冲洗2h。
1.3.2 接种方法
接种前将鳞片切成0.5cm×1cm的小块,用无菌水冲洗掉流出的组织液,在5mg/ml的抗坏血酸(Vc)溶液中浸泡5min备用。将小鳞片腹面向上接种到培养基上。每瓶培养基接种1个,每个处理30瓶,3次重复。
1.4 实验设计
1.4.1 不同消毒方式对鳞片启动培养的影响
采用75%的乙醇、0.1%的升汞和吐温-80对鳞片进行4个时间梯度处理,不同消毒时间处理方法如表1所示。将鳞片接种在MS+0.5mg/L 6-BA+0.1mg/L NA蔗糖30g+琼脂6.4g的培养基中,培养20天后统计污染率和诱导率。
1.4.2 不同激素配比对鳞片启动培养的影响
采用最佳的消毒方式处理鳞片后,分别接种到不同的诱导培养基中,具体激素配比如表2所示,培养30天后统计诱导率。
1.4.3 不同激素配比对愈伤组织诱导的影响
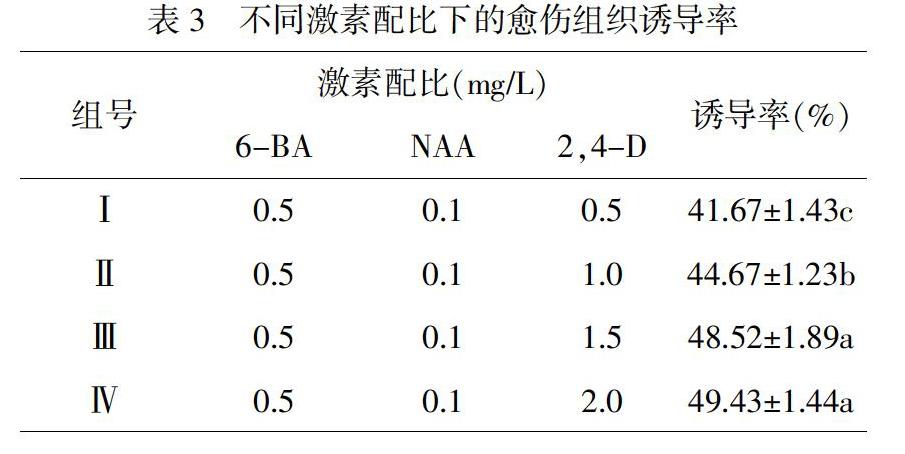
以鳞片启动培养诱导出的健壮、无褐化现象的叶片为材料,分别接种到相应的愈伤组织诱导培养基中,激素配比如表3所示,培养30天后统计结果。
1.4.4 不同激素配比对不定芽诱导的影响
选择生长状况良好、嫩绿且结构紧密的愈伤组织为接种材料,切成0.5cm×0.5cm的小块,分别转接到不同处理的培养基上,培养30天后统计分化情况。
1.4.5 组培苗移栽
在上述实验过程中会诱导出根,将生根且生长良好的组培苗移栽至温室的基质中,移栽前喷洒一定浓度的多菌灵进行基质杀菌消毒,并在移栽后定期喷洒营养液。
1.5 数据统计与分析
接种后每隔10d进行一次观察,记录产生愈伤组织及不定芽的数量,以及组培苗生长状况。
数据统计使用Excel 2010进行,数据处理使用SPSS 20.0软件的ANOVA過程对各处理进行差异性的检验和Duncan法对结果进行多重比较。
2 结果与分析
2.1 不同消毒方式对启动培养的影响
在组织培养的过程中,出现污染的情况是很常见的,污染率的高低是植物组织培养成功的关键。本实验通过用75%乙醇与0.1%升汞处理外植体的时间长短不同,来探究消毒时间对污染率与诱导率的影响。
由表1可以看出,每种消毒方法都对污染率产生一定遏制作用,随着消毒时间的延长,污染率逐渐降低。A组处理(75%乙醇30s,0.1%升汞6min)下的外植体污染率最高,达到83.64%,显著高于其他三组处理,且A组处理最先出现污染情况;同时A组处理下的诱导率最低,为24.33%,明显低于其他三组处理下的诱导率,显然A组消毒处理不适宜荞麦叶大百合启动培养。同样,B组处理(75%乙醇40s,0.1%升汞7min)下外植体污染率为57.65%,诱导率为34.25%,二者均次于C、D两组处理。
D组处理(75%乙醇60s,0.1%升汞9min)污染率最小,为42.35%,并且明显低于另三组处理,但该处理下的诱导率为46.28%,显著低于C组处理75%乙醇50s,0.1%升汞8min下的诱导率52.67%。猜测可能是由于升汞处理的时间过长,使鳞片的诱导率降低。
上述分析表明,本实验中C组消毒处理的效果最好,后续接种实验均采用该消毒方法。
2.2 鳞片启动培养的诱导
本实验以MS为基本培养基,附加不同浓度6-BA和NAA配制培养基接种荞麦叶大百合鳞片,进行初代启动培养,通过对比诱导率筛选最适启动培养基,结果见表2。接种后的鳞片在培养的第四天,鳞片体积显著增大,颜色逐渐变绿,部分鳞片出现红紫色的条纹。有些鳞片经诱导后直接形成的绿色的大型叶片,叶片在培养的过程中可形成愈伤组织,甚至可以分化出淡绿色的不定芽。
从表2可以看出,当6-BA浓度为0.5mg/L时,诱导率随着NAA的浓度增加而降低,且四组激素配比处理下的诱导率均较低。其中,5组处理(MS+1.5mg/L 6-BA +0.1mg/L NAA)下的诱导率最高,为60.00%,相同浓度的6-BA处理下,当NAA为0.1mg/L时诱导率明显高于0.5mg/L的处理结果。可得出结论:NAA在低浓度(0.1mg/L)条件下对荞麦叶大百合鳞片启动培养效果最佳。
当NAA浓度为0.1mg/L时,随着6-BA浓度的增加,诱导率逐渐增高,除1组处理(MS+0.1mg/L NAA)诱导率较低为51.62%外,其他三组处理诱导率均较高。其中,4组处理(MS+1.5mg/L 6-BA +0.1mg/L NAA)下,诱导率最高为90.67%,且显著高于其他激素配比处理,相对于1组处理诱导率提高了39.05%,而在本次实验所有处理组中,明显高于8组处理,其诱导率为42.33%,提高了48.34%;同时,诱导率仅次于4组处理的3组处理,其诱导率为75.33%,相对于4组处理,显著降低了15.34%。
实验表明细胞分裂素6-BA对鳞片的启动培养有促进作用,而高浓度的生长素NAA对鳞茎的诱导有抑制作用。由上述分析得出,本实验中培养基中的激素配比为MS+1.5mg/L 6-BA +0.1mg/L NAA时,鳞片的启动效果最好。
2.3 愈伤组织的诱导
由2.2可知,MS+1.5mg/L 6-BA +0.1mg/L NAA诱导率最高。本实验将不同浓度梯度的2,4-D(0.5mg/L、1.0mg/L、1.5mg/L、2.0mg/L)和0.5mg/L 6-BA、0.1mg/L NAA配制愈伤组织诱导培养基接种叶片。叶片在接种后,逐渐出现淡绿色、半透明的疏松组织,随着培养时间的延长,慢慢变为白色的、结构紧密的愈伤组织,激素配比对诱导率的影响差异见表3。
由表3可知,2,4-D对叶片愈伤组织诱导率有显著影响,且有助于提高叶片愈伤的诱导率。随着2,4-D的浓度的增加,诱导率递增。当2,4-D浓度为2.0mg/L时,诱导率最高,达到49.43%,与浓度为1.5mg/L时诱导率无明显差别,但显著高于剩余两组处理。1组处理,当2,4-D浓度为0.5时,诱导率最低,为41.67%,相对4组处理,显著降低了7.76%。
综上所述,MS+1.5mg/L 6-BA +0.1mg/L NAA+2.0mg/L是用于诱导愈伤组织的最佳培养基。
2.4 不定芽的分化
愈伤组织转接到相应的诱导培养基后,其体积不断地增大,同时形成2-4个淡绿色的小突起,继而伸长形成不定芽。本实验通过不同浓度的6-BA与0.1mg/L的NAA配比处理愈伤组织诱导不定芽,探究不同激素配比对不定芽诱导率的影响,结果见表4。
由表4分析可知,6-BA对愈伤组织对不定芽的诱导有促进作用,当NAA浓度为0.1mg/L时,不定芽的诱导率随着6-BA浓度的增加而显著增加。4组处理(2.0mg/L 6-BA+0.1mg/L NAA)下不定芽的诱导率最高,达到78.81%,且显著高于另外三组处理,相对于1组处理(0.5mg/L 6-BA+0.1mg/L)诱导率为29.71%,显著提高了29.1%。而2组处理(1.0mg/L 6-BA+0.1mg/L NAA)与3组处理(1.5mg/L 6-BA+0.1mg/L NAA)下的不定芽诱导率分别为34.56%与54.55%,显著高于1组处理,但明显低于4组处理。
综上所述,4组处理(2.0mg/L 6-BA+0.1mg/L NAA)最适宜诱导愈伤组织分化不定芽。
3 结论与讨论
植物根际存在大量微生物,因而在以荞麦叶大百合鳞茎作为外植体时,接种前灭菌的方式与时间至关重要,灭菌剂浓度过大或灭菌时间过长都容易使外植体受到伤害,浓度过小或过短,灭菌不彻底,而达不到灭菌的最终效果。本研究中75%乙醇消毒50s、0.1%升汞消毒8min鳞片的启动效果好,成活率高,且污染率相对较低;而75%乙醇消毒60s、0.1%升汞消毒9min時虽然污染率低,但鳞片褐化死亡现象严重,影响到了鳞片的成活率。李国瑞[14]在紫薇灭菌时间的研究与本研究结论一致,较嫩的外植体应当适当减少灭菌时间。
在植物组织培养过程中,添加适当的外源激素是成功诱导愈伤组织的关键因素[15]。在荞麦叶大百合的组织培养实验中,多数研究者采用6-BA与NAA,本实验采用2,4-D与6-BA、NAA相互配比诱导愈伤组织,且结果表明,2,4-D对荞麦叶大百合愈伤组织的诱导有明显的促进作用。
任江萍等在大麦幼胚立体培养条件的建立中也提到,不同浓度2,4-D对大麦愈伤组织的诱导存在较大差异[16]。本研究中荞麦叶大百合叶片愈伤组织的诱导实验中,2,4-D能够促进叶片的出愈率.2,4-D浓度为2.0mg/L时,诱导效果最佳,与任江萍的研究相似,她认为2,4-D的浓度在1-2 mg/L时,愈伤诱导率较高[15]。
植物生长发育过程与植物的内源和外源激素种类、含量及配比等有密切关系。在诱导愈伤组织产生不定芽的实验中,可以看出6-BA对不定芽的诱导有较明显的影响,在马生军[12]等人的实验中,NAA浓度不变时,随着6-BA浓度的增加呈现先增加后下降的趋势,该结果与本实验结果相同,6-BA2.0mg/L与NAA0.1mg/L配比时,分化的不定芽数量多,生长速度快。
由于荞麦叶大百合长年生长于野生状态,移栽后需要多加管理,并于后期喷洒一定量的营养液使移栽后的组培面生长良好,为其后续利用提供更多材料,以满足市场需求。
——————————
参考文献:
〔1〕汪小飞,周志光,王蕾.荞麦叶大百合鳞茎大小与基生叶的生长关系[J].东北林业大学学报,2014,42(07):80-82+104.
〔2〕Wu Zhengyi, Peter H K. Flora of China[M]. Beijing: Science Press, 2000.
〔3〕李合.荞麦叶大百合[J].农村新技术,2003(07):32.
〔4〕马跃杰,蔡建国.黄山猴谷百合科植物资源调查与开发利用价值[J].江苏农业科学,2013,41(02):364-365,402.
〔5〕汪小飞,刘方圆,王玉义.黄山风景区室内野生观赏植物资源调查与分析[J].黄山学院学报,2013,15(03):31-35.
〔6〕关文灵,李世峰,李叶芳,等.大百合鳞茎营养成分分析与评价[J].西部林业科学,2011,40(01):8-11.
〔7〕Hayashi K, Kawano S. Bulbous monocots native to Japan and adjacent areas-their habitats, life histories and phylogeny[C].//Proceedings of the Ninth International Symposium on Flower Bulbs, International Society for Horticultural Science press, 2005,673:43-58.
〔8〕周志光.荞麦叶大百合繁育技术及种子传播能力研究[D].南京林业大学,2015.
〔9〕关文灵,李枝林,黄建新.野生花卉大百合的引种栽培[J].北方园艺,2003,27(04):33.
〔10〕叶睿超,董艳芳.大百合组织培养研究进展[J].安徽农学通报(上半月刊),2010,16(19):54-55.
〔11〕孙君社,方晓华.植物激素对百合鳞片愈伤组织生长的影响[J].中国农业大学学报,2001(02):58-61.
〔12〕马生军,丁万红,李淑珍,靳元元,周晋.百合鳞片组织培养研究[J].生物技术通讯,2018,29(06):819-824.
〔13〕肖玉菲,陈博雯,覃子海,覃玉凤,晏巢,刘海龙.不同因素对大百合鳞茎诱导出芽的影响[J].江西农业学报,2018,30(08):25-28.
〔14〕李国瑞,紫薇快速繁殖及植株再生的研究[D].华中农业大学,2010.
〔15〕刘明,赵琦,王小青,等.诱导突变高粱愈伤组织初探[J].生物技术通报,2004,20(4):47-52.
〔16〕任江萍,李磊,王新国,等.大麦幼胚离体培养条件的建立[J].麦类作物学报,2005,25(06):33-36.
