松果菊苷通过调控SIRT1/PGC-1α信号通路改善肥胖糖尿病小鼠肝损伤
2020-10-26唐凤娟郝亚荣
杨 洛 唐凤娟 张 祥 廖 敏 郝亚荣
2型糖尿病(T2DM)作为严重威胁人类身心健康的慢性代谢性疾病,会造成全身多器官损伤,其肝脏损伤以非酒精性脂肪性肝病(NAFLD)最常见。肝细胞中过多的脂质积累,不仅会干扰代谢过程,还可能导致炎症、肝纤维化,甚至肝癌[1]。由于这种疾病的发病机制在很大程度上仍然未知,因此尽管肝脏并发症在T2DM患者中具有较高的发生率和重要的临床意义,但在临床实践中通常会被忽视。目前普遍使用治疗糖尿病的临床药物包括二甲双胍、磺脲类、TZDs、DPP-4抑制剂等,多会导致肝功能受损等不良反应从而禁用于肝功能不全的患者。因此,新药的开发与研究具有非常重要的意义。松果菊苷是肉苁蓉的主要成分,并且具有许多药理性质,例如抗氧化、抗炎、抗肿瘤、保肝和免疫调节活性[2]。沉默信息调节因子2相关酶1(silent information regulator factor 2 related enzyme 1,SIRT1)是脂类和葡萄糖代谢的关键调节因子之一,它可以提高肝脏和其他组织的胰岛素敏感度,并减轻肝脏脂肪变性[3]。db/db小鼠是一种自发性肥胖2型糖尿病小鼠,随着周龄增加可出现贪食、肥胖,明显的高血糖、高血脂、胰岛素抵抗等特征,其发病过程与2型糖尿病患者相似[4]。本研究拟采用db/db小鼠作为2型糖尿病肝损伤模型,予以松果菊苷(ECH)灌胃,观察松果菊苷对糖尿病肝损伤的影响及其作用机制。
材料与方法
1.实验动物:自发性2型糖尿病db/db小鼠(6周龄,20只);同窝db/m小鼠(6周龄,9只),均为雄性,购自南京大学-南京生物医药研究所,动物生产合格证编号:SCKK(苏)2015-0001,饲养在武汉大学人民医院中心实验室动物房(SPF级),每笼4~5只,室温22±2℃,相对湿度60%,每日12h光照/12h黑暗交替,期间自由摄食、饮水,常规普通饲料喂养。本实验均符合武汉大学人民医院实验动物伦理学相关规定的要求。
2.主要仪器与试剂: One Touch Ulta血糖仪及血糖试纸(美国强生公司);电子天平(Metter Toledo公司);AU640全自动生化仪(日本Olympus公司);BX63型光学显微镜(日本Olympus公司);多功能酶标仪DR-200Bs(美国Diatek公司);实时荧光定量PCR检测仪(美国ABI公司)。松果菊苷(美国Sigma公司,纯度94%);4%多聚甲醛(谷歌生物科技有限公司);苏木精染液(国药集团化学试剂有限公司);伊红生物染色剂(北京索莱宝科技有限公司);油红O染液(上海晶都生物技术有限公司);兔抗人单克隆抗体SIRT1(货号#9475)购自美国CST公司,PGC-1α(货号ab54481)、PPARα(货号ab8934)、GAPDH(货号ab37168)购自英国Abcam公司,CPT1(货号15184-1-AP)购自武汉三鹰生物技术有限公司;BCA蛋白浓度检测试剂盒(碧云天生物技术公司);预染蛋白Marker(美国Thermo公司);SDS-PAGE凝胶制备试剂盒(谷歌生物科技有限公司);RT-PCR反转录试剂盒(日本TaKaRa公司);荧光定量PCR试剂盒(日本TaKaRa公司)。
3.动物分组与给药:实验开始前,6周龄小鼠经过检疫1周及适应性饲养1周。编号并采用数字表法将db/db小鼠随机分为两组:1~10号为糖尿病模型组(db/db组,n=10),11~20号为松果菊苷治疗组(db/db+ECH组,n=10),db/m小鼠9只作为正常对照组(db/m组,n=9),8周龄时分别给予如下干预:正常对照组和糖尿病模型组每天按照0.05ml/10g体质量进行0.9%氯化钠注射液灌胃,松果菊苷治疗组按松果菊苷300mg/(kg·d)灌胃。期间自由饮食饮水,持续10周。
4.一般情况与空腹血糖:实验期间观察小鼠的状态、摄食、饮水和毛色光泽度等一般情况。各组从实验第1周(小鼠8周龄)开始,每周检测体质量,尾静脉取血测空腹血糖。
5.标本采集:干预10周后,禁食不禁水处理12h,麻醉后眼眶采血,迅速分离血清,保存于-80℃冰箱用于生化指标检测。取血后处死小鼠,用生理盐水心脏灌流,解剖取肝脏并称取质量。肝质量指数(liver index,LI)=[肝质量(g)/体质量(g)]×100%。留取部分新鲜肝组织行病理切片,剩余肝脏组织置于液氮1h后保存在-80℃冰箱用于后续蛋白检测和实时免疫荧光定量PCR。
6.肝脏病理组织学检查:迅速分离新鲜肝组织,一部分用4%多聚甲醛固定24h后脱水石蜡包埋切片,二甲苯将切片脱蜡至水,苏木精染细胞核,伊红染细胞质,脱水后中性树胶封片;另一部分组织OTC包埋后切片,50%乙醇稍洗后用油红O工作液染色,50%乙醇分化,蒸馏水浸洗,苏木精复染,盐酸乙醇分化,流水返蓝,风干后封片。光学显微镜下观察肝组织病理组织学改变。
7.血清、肝组织生化指标检测:血清标本送至武汉大学人民医院检验科使用全自动生化检测仪检测,血脂指标:甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C);肝功能指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。
8. Western blot法检测肝组织中SIRT1、PGC-1α、PPARα、CPT1蛋白质表达:取冻存的肝组织剪碎,取50mg,加入1ml RIPA 裂解液提取总蛋白,4℃13000r/min离心5min,收集上清液即为总蛋白溶液,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。各组取40μg蛋白量上样,转膜至 PVDF 膜上,抗体孵育后行化学发光检测,将胶片进行扫描存档,AlphaEaseFC软件处理系统分析目标带的吸光度值,GAPDH作为内参照进行半定量分析。
9.RT-PCR检测肝组织中SIRT1、PGC-1α mRNA表达:从-80℃冰箱取各组小鼠肝组织约100mg,按Trizol试剂盒提取总RNA,紫外吸收法进行RNA质量检测后反转录成cDNA。按照SYBR Green法配置反应体系扩增cDNA,每组样本至少3个复孔,操作在冰上进行。使用Primer Premier 5.0软件设计SIRT1、PGC-1α引物序列,由武汉赛维尔生物科技有限公司合成,以管家基因β-actin为内参照, β-actin上游引物序列为5 ′- CTATCCTTCTTCGCAT-3′,下游引物序列为 5′-TAATTGTCGCAGATCG-3′;SIRT1上游引物序列为5′-TCGTGGAGACATTTTTAATCAGG-3′,下游引物序列为5′-GCTTCATGATGGCAAGTGG-3′;PGC-1α上游引物序列为5′-CCCTGCCATTGTTAAGACC-3′,下游引物序列为5′-TGCTGCTGTTCCTGTTTTC-3′。扩增条件:95℃预变性30s;95℃变性5s,65℃退火30s,共40个循环。反应结束后通过溶解曲线分析来确定PCR扩增特异性,读取 Ct 值并采用2- △△Ct法计算目的基因 mRNA 相对表达量。
结 果
1.一般情况:实验过程中正常对照组小鼠状态良好,毛色光滑,精神活跃;糖尿病模型组出现多饮多食现象,明显肥胖,蜷伏不喜动,毛发粗糙暗沉;松果菊苷治疗组与糖尿病模型组比较,在各方面均有一定程度的好转。
2.松果菊苷对糖尿病小鼠肝质量指数和空腹血糖的影响:在实验进行第10周时,与正常对照组比较,糖尿病模型组肝质量指数和空腹血糖都显著增加(P<0.01),而松果菊苷治疗组小鼠肝质量指数较糖尿病模型组下降,差异有统计学意义(P<0.05),血糖降低,差异有统计学意义(P<0.01),详见表1。

表1 各组小鼠肝质量指数及空腹血糖的比较
3.松果菊苷对糖尿病小鼠肝脏形态学改变的影响:HE染色可见正常对照组肝细胞大小形态正常,肝小叶和肝窦结构清晰;糖尿病模型组可见广泛肝细胞变性气球样改变,肝细胞体积增大,胞核大小不均,病灶细胞坏死与汇管区炎性细胞浸润;松果菊苷治疗组明显脂滴和炎性细胞减少,细胞坏死损伤减轻;油红O染色镜下观察正常对照组肝脏组织细胞排列整齐,未见脂滴和病理改变;糖尿病模型组细胞排列紊乱,胞质中出现大量大小不一的脂肪颗粒。与糖尿病模型组比较,松果菊苷治疗组脂滴染色明显减少。

图1 各组小鼠肝脏组织HE染色和油红O染色(×200)
4.松果菊苷对糖尿病小鼠肝功能和脂质代谢的影响:肝功能与正常对照组比较,糖尿病模型组小鼠ALT明显升高(P<0.01),同样AST也升高(P<0.05);与糖尿病模型组比较,松果菊苷治疗组ALT降低(P<0.05),AST也明显降低(P<0.01);血脂水平与正常对照组比较,糖尿病模型组TC、TG、LDL-C显著升高(P<0.01),HDL-C显著降低(P<0.05);与糖尿病模型组比较,松果菊苷治疗组TC、TG、LDL-C降低, HDL-C升高(P<0.05),详见图2。

图2 各组小鼠血清中ALT、AST、TC、TG、HDL-C、LDL-C含量与正常对照组比较,*P<0.05,**P<0.01;与糖尿病模型组比较,#P<0.05
5.松果菊苷对糖尿病小鼠肝脏SIRT1、PGC-1α、PPARα、CPT1蛋白质表达的影响:Western blot法检测结果显示,与正常对照组比较,糖尿病模型组小鼠肝脏组织SIRT1、PGC-1α、PPARα、CPT1α蛋白质水平明显降低(P<0.01);与糖尿病模型组比较,松果菊苷治疗组蛋白质水平明显升高(P<0.01),详见图3。
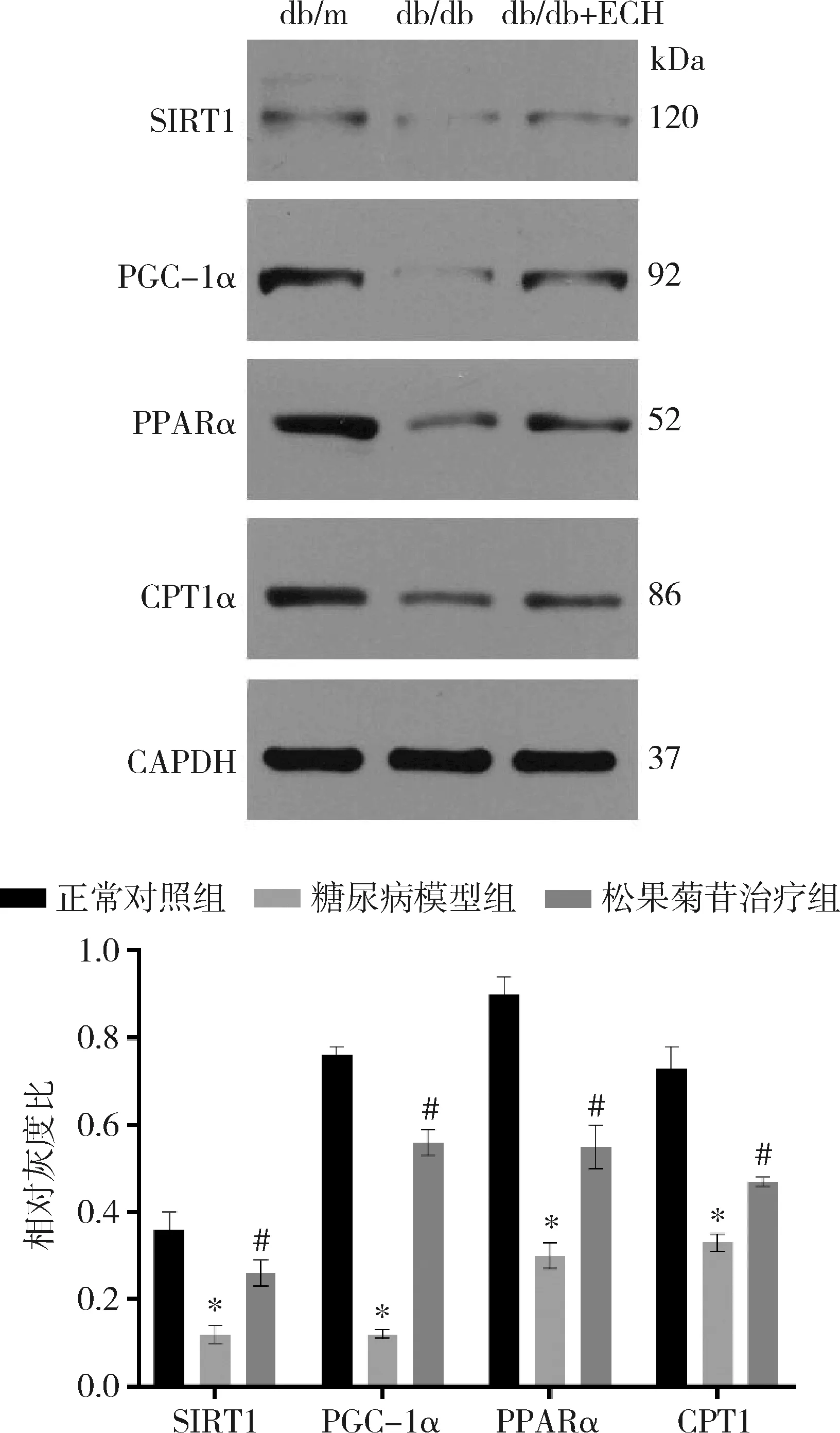
图3 各组SIRT1、PGC-1α、PPARα、CPT1蛋白表达量和相对灰度比与正常对照组比较,*P<0.01;与糖尿病模型组比较, #P<0.01
6.松果菊苷对糖尿病小鼠肝脏SIRT1、PGC-1α mRNA 表达的影响:RT-PCR检测结果显示,与正常对照组比较,糖尿病模型组SIRT1、PGC-1α明显降低差异有统计学意义(P<0.01);与糖尿病模型组比较,经松果菊苷干预后,SIRT1明显增加(P<0.01)以及PGC-1α明显增加(P<0.05),详见图4。

图4 各组SIRT1、PGC-1α mRNA相对表达量与正常对照组比较,*P<0.01;与糖尿病模型组比较,#P<0.05,##P<0.01
讨 论
糖尿病是全球主要的医学问题之一,到2035年全球糖尿病发生预计将达到5.92亿。我国糖尿病发生率呈明显增加趋势,其中大部分为2型糖尿病。2型糖尿病与肝病变有着复杂的牵连,其引起的肝损伤以非酒精性脂肪性肝病(NAFLD)最为常见。NAFLD现已被公认为全球最常见的慢性肝病,是一种以肝脏脂肪沉积过多为特征的病理状态[5]。NAFLD与胰岛素抵抗和血脂异常密切相关,在2型糖尿病和(或)肥胖者中高度流行。许多代谢因素已被证明与NAFLD的发展有关,尽管如此,这种疾病的发病机制仍然很大程度上未知[1]。管花肉苁蓉是一种多年生寄生植物,生长于固沙植物的根部,根据《中国药典》,肉苁蓉通常被用作治疗肾脏疾病和不孕不育[6]。
近年来有研究证实管花肉苁蓉能够显著抑制db/db小鼠空腹和餐后血糖水平升高,改善胰岛素抵抗和血脂异常,减轻体质量[7]。本实验结果显示,肥胖和糖尿病会引起小鼠肝损伤,表现为血清ALT、AST水平显著升高和典型组织病理学改变。松果菊苷可显著降低小鼠的肝质量指数和血糖,同时降低TC、TG、LDL-C的水平并且提高HDL-C水平,组织病理检查上显示松果菊苷能够减轻肝细胞脂肪样变性和炎性细胞浸润,证实松果菊苷能够改善肥胖糖尿病小鼠肝损伤。
沉默信息调节因子2相关酶1 (silent information regulator factor 2 related enzyme 1,SIRT1),是一种NAD依赖性脱乙酰酶,最近已被证明与NAFLD的病理生理有关[8]。SIRT1参与各种细胞生理过程,例如脂质和葡萄糖的稳态以及胰岛素敏感度,是代谢的关键调节因子。该酶在肝脏中高度表达,抑制SIRT1会上调糖异生和脂肪生成相关基因的表达,从而导致细胞内葡萄糖和脂质水平的升高[9]。肥胖患者,尤其是胰岛素抵抗、糖尿病和NAFLD患者的SIRT1水平较低[10]。Price等[11]已经介绍了SIRT1在预防肝脏脂肪变性中的作用,并且发现NAFLD患者中的SIRT1表达水平降低。有研究表明,肝细胞特异性敲除SIRT1可减少脂肪酸氧化,诱导了肝脏中脂肪变性和炎症;而过表达SIRT1可通过过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)转导通路改善脂质代谢[12]。PGC-1α活性受SIRT1调节,并且二者都是维持细胞能量稳态的关键[13]。因此,SIRT1/PGC-1α可能是肝损伤的关键靶点。PGC共激活因子是一种可以与转录因子或核受体相结合增加转录活性的蛋白质,大多数转录因子均需要辅助激活因子,特别是核受体PPAR,过氧化物增殖物激活受体α(PPARα)主要存在于肝脏、心肌和骨骼肌等氧化组织中,它可激活促进脂肪酸转运和氧化、酮生成和糖异生的基因转录[14]。肉碱脂酰转移酶1 (CPT1)是脂肪酸氧化的关键限速酶,其表达受复杂的转录机制调控,涉及多种转录因子(TF)和辅助激活因子,包括SIRT1、PGC-1α、PPARα等。
本研究在糖尿病模型组高血糖浓度下,伴随着SIRT1的表达下调,肝细胞中脂质积累增加;在松果菊苷治疗组中SIRT1、PGC-1α蛋白质和mRNA表达显著增加,下游因子PPARα、CPT1蛋白质表达显著增加,这表明SIRT1 / PGC-1α信号轴及其下游因子参与了糖尿病肝损伤后治疗的有益作用。综上所述,松果菊苷通过调控SIRT1/PGC-1α及其下游因子的表达能够调节血糖和脂质代谢,从而改善糖尿病肝损伤。
