LncRNA FGD5-AS1靶向miR-103a-3p对IL-1β诱导的关节软骨细胞凋亡的机制研究
2020-10-26郭秀珍高斌礼郭文刘庆梁冯睿吴燕珍
郭秀珍 高斌礼* 郭文 刘庆梁 冯睿 吴燕珍
1.内蒙古医科大学附属医院, 内蒙古 呼和浩特 010050 2.包头医学院第二附属医院, 内蒙古 包头 014010 3.内蒙古包钢医院, 内蒙古 包头 014010
骨关节炎(osteoarthristis,OA)是临床常见的一种慢性退变性关节疾病,其主要病理特征为关节软骨发生退行性病变,而关节软骨由软骨细胞与细胞外基质构成[1]。研究[2-3]表明IL-6、TNF-α、IL-8等炎性因子分泌量增加可促进炎症反应的发生,从而促进OA进展。因而抑制炎症反应可减少OA中软骨退变,从而减缓疾病进展。白细胞介素-1β(interleukin-1β,IL-1β)可影响关节软骨细胞基质合成,从而参与OA发生及发展过程。研究[4]表明,IL-1β可作为体外研究中OA的诱导剂。LncRNA FGD5-AS1在牙周炎中呈低表达,过表达可抑制牙周炎的发展[5]。生物信息学分析显示miR-103a-3p可能是FGD5-AS1的靶基因,研究[6]表明miR-103a-3p在类风湿关节炎患者血清中表达上调。但FGD5-AS1是否可靶向调控miR-103a-3p参与骨关节炎发生发展过程尚未可知。研究[7]表明,抑制NF-κB信号通路的激活可有效抑制机体内炎症反应。本研究采用IL-1β诱导大鼠关节软骨细胞模拟OA环境,检测细胞中FGD5-AS1与miR-103a-3p的表达水平,探究其对关节软骨细胞炎症损伤及细胞凋亡的影响及作用机制,为进一步揭示OA发生与发展的分子机制奠定理论基础。
1 材料与方法
1.1 材料与试剂
大鼠关节软骨细胞(宁波明舟生物科技有限公司);DMEM与胎牛血清(美国Gibco公司);胰蛋白酶(上海钰博生物科技有限公司);IL-1β(美国Sigma-Aldrich公司);Lipofectamine 2000(美国Invitrogen公司);pcDNA3.1(上海远慕生物科技有限公司);miR-103a-3p mimics及阴性对照(miR-NC)、si-FGD5-AS1及si-NC(上海吉玛制药技术有限公司);Trizol试剂、反转录与荧光定量PCR试剂盒(北京天根生化科技有限公司);IL-6、TNF-α、IL-8 ELISA检测试剂盒(南京建成生物工程研究所);Annexin V-FITC/PI细胞凋亡试剂盒(上海朗智生物科技有限公司);兔抗鼠Bax、Cyt C、Cleaved Caspase-3抗体(美国CST公司);兔抗鼠p-NF-κB p65、p-IκBα抗体(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1实验分组:将软骨细胞分为NC组(未进行处理的软骨细胞)、IL-1β组(浓度为10 ng/mL的IL-1β处理软骨细胞)[8]。分别将pcDNA、pcDNA-FGD5-AS1、pcDNA-FGD5-AS1与miR-NC、pcDNA-FGD5-AS1与miR-103a-3p mimics转染至软骨细胞,在含有10 ng/mL 的IL-1β培养基内培养48 h。
1.2.2ELISA检测IL-6、TNF-α、IL-8浓度:收集各组细胞培养上清液,4 ℃条件下经1 300 r/min转速离心10 min,吸取上清,参照ELISA检测试剂盒说明书检测各组炎性因子IL-6、TNF-α、IL-8水平,严格按照试剂盒说明书进行操作。
1.2.3qRT-PCR检测细胞中FGD5-AS1、miR-103a-3p的表达水平:采用Trizol法提取各组细胞中总RNA,应用Nanodrop 2000c超微量分光光度计测定RNA浓度,参照反转录试剂盒说明书将总RNA反转录合成cDNA。以cDNA为模板进行qRT-PCR反应,反应条件:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共循环40次。FGD5-AS1以GAPDH为内参,miR-103a-3p以U6为内参,采用2-ΔΔCt法计算FGD5-AS1、miR-103a-3p的相对表达量。
1.2.4流式细胞术检测细胞凋亡率:收集各组对数期软骨细胞,预冷PBS洗涤,加入5 μL Annexin V-FITC与5 μL PI,充分混匀后,室温避光孵育10 min,置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡。
1.2.5双荧光素酶报告基因检测FGD5-AS1的靶基因:靶基因预测软件starbase预测显示FGD5-AS1与miR-103a-3p存在结合位点,利用基因突变技术将结合位点进行突变,分别将结合位点与突变位点插入荧光素酶报告基因载体分别构建野生型载体WT-FGD5-AS1与突变型载体MUT-FGD5-AS1,分别将WT-FGD5-AS1、MUT-FGD5-AS1与miR-NC、miR-103a-3p mimics共转染至软骨细胞,参照荧光素酶活性检测试剂盒检测各组相对荧光素酶活性。
1.2.6Western blot检测Bax、Cyt C、Cleaved Caspase-3、p-NF-κB p65、p-IκBα蛋白表达:收集各组对数生长期软骨细胞,加入RIPA裂解液后经1 000 r/min转速离心15 min(4 ℃),吸取上清液(总蛋白)。采用BCA检测蛋白浓度,取40 μg蛋白样品进行SDS-PAGE反应,将电泳产物转移至PVDF膜,封闭2 h,加入蛋白一抗稀释液(1∶1 000),4 ℃孵育24 h,TBST洗涤,加入二抗稀释液(1∶2 000),室温孵育1 h,TBST洗涤,滴加ECL显影,应用Quantityone软件检测条带灰度值。
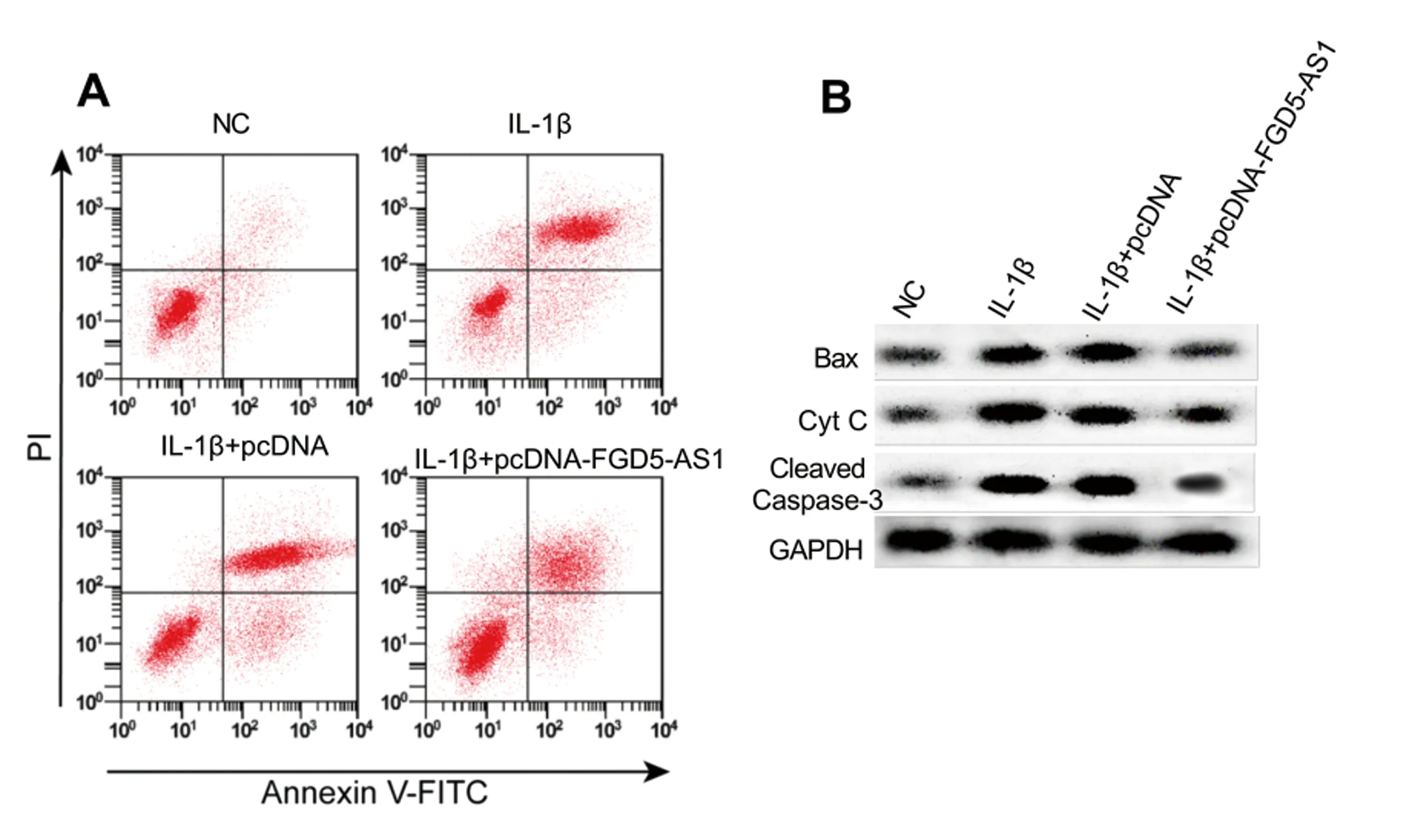
图1 FGD5-AS1过表达对IL-1β诱导的关节软骨细胞凋亡的影响 A:流式细胞术检测细胞凋亡率;B:细胞凋亡相关蛋白免疫印迹图。Fig.1 Effect of FGD5-AS1 overexpression on the apoptosis of articular chondrocytes induced by IL-1β
1.3 统计学处理

2 结果
2.1 IL-1β诱导的关节软骨细胞中LncRNA FGD5-AS1与miR-103a-3p的表达量
实验结果显示,与NC组相比,IL-1β组软骨细胞中FGD5-AS1的表达水平显著降低(P<0.05),miR-103a-3p的表达水平显著升高(P<0.05),见表1。
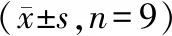
表1 IL-1β诱导的关节软骨细胞中LncRNA FGD5-AS1与miR-103a-3p的表达量
2.2 FGD5-AS1过表达对IL-1β诱导的关节软骨细胞炎症损伤的影响
与NC组相比,IL-1β组炎性因子IL-6、TNF-α、IL-8水平显著升高(P<0.05);与IL-1β+pcDNA组相比,IL-1β+pcDNA-FGD5-AS1组炎性因子IL-6、TNF-α、IL-8水平显著降低(P<0.05),见表2。
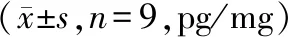
表2 FGD5-AS1过表达对IL-1β诱导的关节软骨细胞炎症损伤的影响
2.3 FGD5-AS1过表达对IL-1β诱导的关节软骨细胞凋亡的影响
与NC组相比,IL-1β组关节软骨细胞凋亡率显著升高(P<0.05),Bax、Cyt C、Cleaved Caspase-3蛋白相对表达量显著升高(P<0.05);与IL-1β+pcDNA组相比,IL-1β+pcDNA-FGD5-AS1组关节软骨细胞凋亡率显著降低(P<0.05),Bax、Cyt C、Cleaved Caspase-3蛋白相对表达量显著降低(P<0.05),见图1、表3。
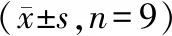
表3 FGD5-AS1过表达对IL-1β诱导的关节软骨细胞凋亡的影响
2.4 FGD5-AS1靶向调控miR-103a-3p的表达
starBase预测显示LncRNA FGD5-AS1 与miR-103a-3p存在结合位点,见图2。双荧光素酶报告实验结果显示,转染野生型载体WT-FGD5-AS1的细胞中,miR-103a-3p组荧光素酶活性显著低于miR-NC组(P<0.05);转染突变型载体MUT-FGD5-AS1的细胞中,miR-103a-3p组荧光素酶活性相较于miR-NC组差异无统计学意义(P>0.05),见表4。qRT-PCR检测结果显示,与pcDNA组相比,pcDNA-FGD5-AS1组miR-103a-3p的表达水平显著降低(P<0.05);与si-NC组相比,si-FGD5-AS1组miR-103a-3p的表达水平显著升高(P<0.05),见表5。
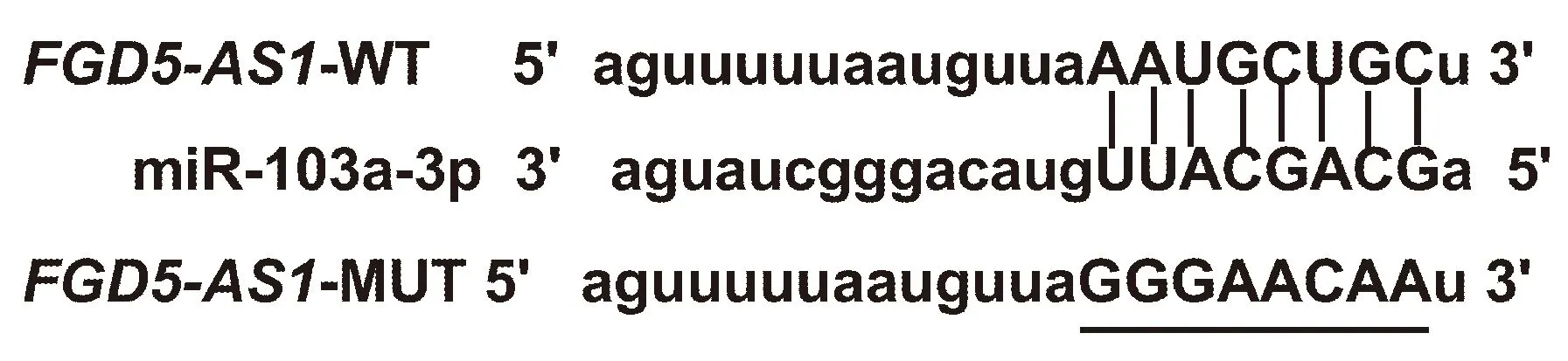
图2 FGD5-AS1的序列中含有与miR-103a-3p互补的核苷酸序列Fig.2 The sequence of FGD5-AS1 contains a nucleotide sequence complementary to miR-103a-3p
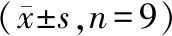
表4 双荧光素酶报告实验
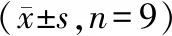
表5 FGD5-AS1负向调控miR-103a-3p的表达
2.5 FGD5-AS1调控miR-103a-3p影响关节软骨细胞炎症损伤及细胞凋亡
与IL-1β+pcDNA-FGD5-AS1+miR-NC组相比,IL-1β+pcDNA-FGD5-AS1+miR-103a-3p组炎性因子IL-6、TNF-α、IL-8水平显著升高(P<0.05),细胞凋亡率显著升高(P<0.05),Bax、Cyt C、Cleaved Caspase-3蛋白相对表达量显著升高(P<0.05),见图3、表6、表7。
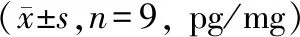
表6 FGD5-AS1调控miR-103a-3p影响关节软骨细胞炎症损伤Table 6 FGD5-AS1 regulates miR-103a-3p to affect articular chondrocyte inflammation and
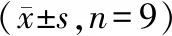
表7 细胞凋亡相关蛋白相对表达量
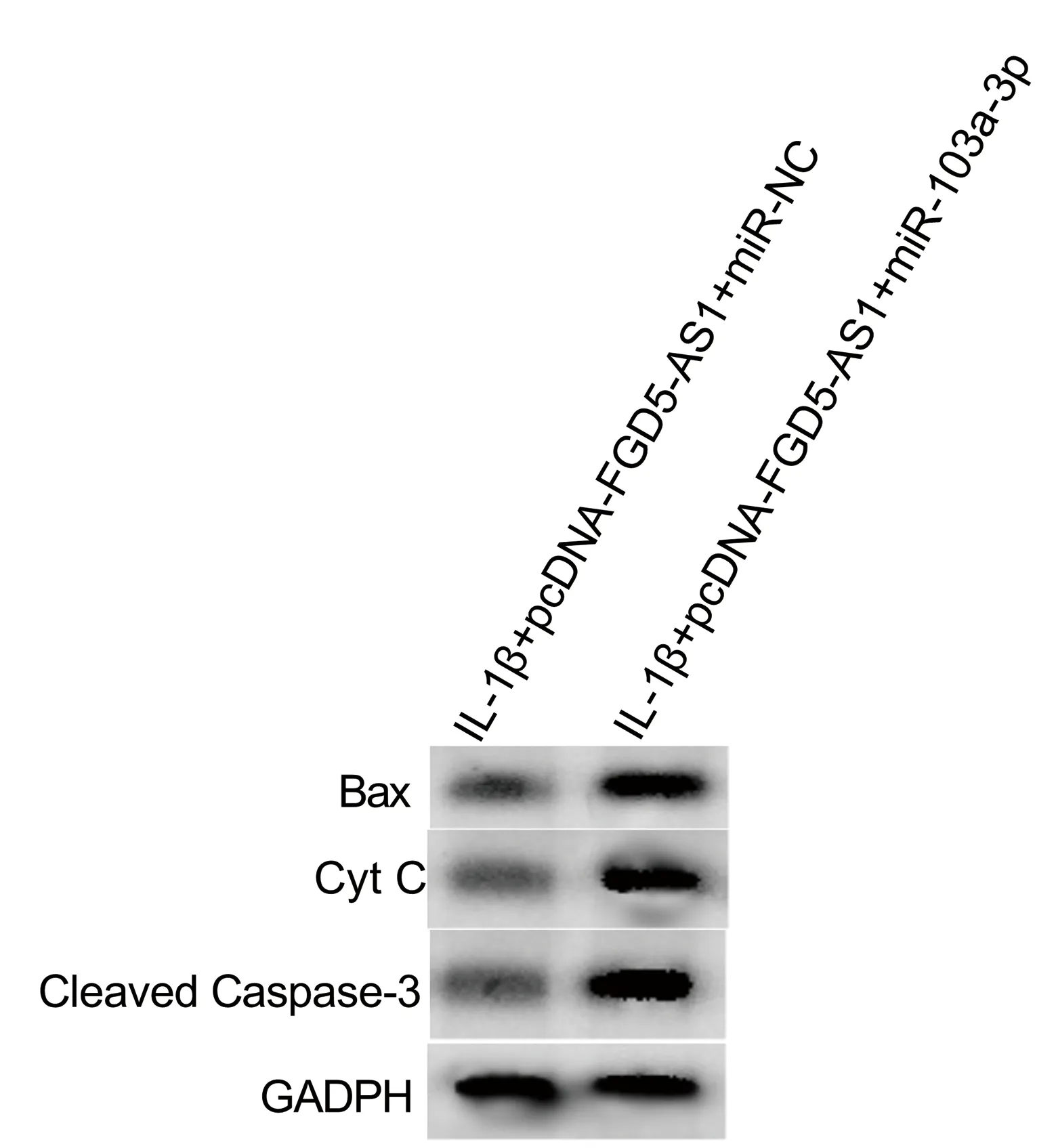
图3 细胞凋亡相关蛋白免疫印迹图Fig.3 Western blot of apoptosis-related proteins
2.6 FGD5-AS1靶向miR-103a-3p调控NF-κB信号通路
实验结果显示,与IL-1β+pcDNA组相比,IL-1β+pcDNA-FGD5-AS1组p-NF-κB p65、p-IκBα蛋白相对表达量显著降低(P<0.05);与IL-1β+pcDNA-FGD5-AS1+miR-NC组相比,IL-1β+pcDNA-FGD5-AS1+miR-103a-3p组p-NF-κB p65、p-IκBα蛋白相对表达量显著升高(P<0.05),见图4、表8。
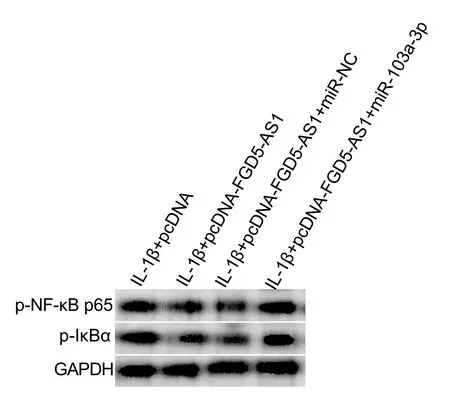
图4 NF-κB信号通路相关蛋白免疫印迹图Fig.4 Western blot of NF-κB signaling pathway related proteins
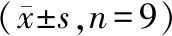
表8 NF-κB信号通路相关蛋白相对表达量
3 讨论
FGD5-AS1在急性心肌梗死患者中表达下调,并可能参与急性心肌梗死发生及发展过程[9]。研究[10]表明,FGD5-AS1可促进结直肠癌细胞的增殖、迁移及侵袭。本研究结果显示,FGD5-AS1在IL-1β诱导的关节软骨细胞中表达下调,提示FGD5-AS1表达量降低可能促进OA的发生及发展。同时还显示IL-1β诱导的关节软骨细胞中炎性因子IL-6、TNF-α、IL-8水平升高,与相关文献报道相似[11],提示IL-1β可明显造成软骨细胞炎症损伤。进一步研究结果显示,FGD5-AS1过表达后炎性因子水平明显降低,提示FGD5-AS1过表达可通过降低炎性因子水平而减轻IL-1β诱导的关节软骨细胞炎症损伤。相关报道[12]指出细胞氧化应激损伤可促进凋亡蛋白Bax表达,Bax表达上调可促进线粒体释放Cyt C进而激活Caspase级联反应最终诱导细胞凋亡。本研究结果显示IL-1β处理后关节软骨细胞凋亡率明显升高,Bax、Cyt C、Cleaved Caspase-3蛋白水平明显升高,而FGD5-AS1过表达后可明显抑制IL-1β诱导的关节软骨细胞凋亡,提示FGD5-AS1过表达可能通过调控线粒体途径而抑制IL-1β诱导的关节软骨细胞凋亡。
miR-103a-3p表达量升高可能与骨骼疾病发生过程有关[13]。研究[14]表明miR-103a-3p可促进血管紧张素II诱导的肾脏炎症及纤维化的发生。本研究通过双荧光素酶报告实验结果证实FGD5-AS1靶向负调控miR-103a-3p的表达,进一步研究显示miR-103a-3p过表达后可明显逆转FGD5-AS1过表达对IL-1β诱导的关节软骨细胞炎症损伤及细胞凋亡的作用,提示FGD5-AS1过表达可通过下调miR-103a-3p表达从而减轻IL-1β诱导的关节软骨细胞炎症损伤,抑制细胞凋亡。相关报道[15]指出p65是NF-κB信号通路主要蛋白,正常生理状态下NF-κB与IκB结合,若细胞受到刺激后IκB降解后可释放NF-κB p65进而促进关节软骨细胞炎症损伤。本研究结果显示FGD5-AS1过表达后可明显降低p-NF-κB p65、p-IκBα表达,而miR-103a-3p过表达后可明显促进p-NF-κB p65、p-IκBα表达,提示FGD5-AS1过表达可能通过靶向抑制miR-103a-3p表达而抑制NF-κB信号通路激活从而减轻IL-1β诱导的关节软骨细胞炎症损伤,抑制细胞凋亡,对软骨细胞发挥保护作用。
综上所述,FGD5-AS1过表达靶向抑制miR-103a-3p表达可抑制IL-1β诱导的关节软骨细胞炎症反应及细胞凋亡,其作用机制可能与抑制NF-κB信号通路的活化有关,可为深入探讨FGD5-AS1对关节软骨细胞凋亡及炎症的影响及分子机制奠定理论基础,有助于阐明OA发病机制及防治OA。
