淫羊藿素逆转糖皮质激素所致骨质疏松及其与Runx-2靶点的相互作用研究
2020-10-26夏海建郭文杰裴晋阳施嘉欣杜天琪肖世长侯磊王慧颖孙旭杰蒋俊
夏海建 郭文杰 裴晋阳 施嘉欣 杜天琪 肖世长 侯磊 王慧颖 孙旭杰 蒋俊*
1. 扬州大学附属医院,江苏 扬州 225001 2. 江苏大学药学院,江苏 镇江 212013
持续使用糖皮质激素是造成骨量丢失、诱发继发性骨质疏松的常见原因[1-3]。接受糖皮质激素治疗的患者每年骨量丢失约15%[4-5],持续使用5年以上,病人骨折的发生率超过30%[6]。多种模式生物研究[7-9]表明,治疗剂量的糖皮质激素可扰乱破骨细胞和成骨细胞功能,抑制骨形成,促进骨吸收,导致骨量丢失。骨髓间质干细胞(mesenchymal stem cells, MSCs)、破骨细胞(osteoclast, OC)和成骨细胞(osteoblast, OB)是参与骨重建的主要细胞[10-12]。糖皮质激素因破坏了骨形成和骨吸收之间的平衡,进而诱发了骨质疏松[13]。Runt相关转录因子2(runt-related transcription factor 2, RUNX-2)参与了OB成熟分化,能促进MSCs向OB分化[14-15]。因此,研究活性成分与RUNX-2靶点的相互作用对阐述活性成分的抗骨质疏松作用具有重要意义。
斑马鱼模型已被广泛地应用于中药抗骨质疏松研究,不仅可以用来快速筛选其活性成分,也可以用来探讨活性成分的分子机制,尤其是斑马鱼胚胎暴露模型[16]。淫羊藿素(icaritin,IT)是淫羊藿中抗骨质疏松活性最强的黄酮苷元[17-20],但是采用斑马鱼模型评价IT的抗骨质疏松活性及其机理的报道极少。因此,本研究将斑马鱼胚胎暴露在泼尼松龙(prednisolone, PNSL)溶液中,造成其骨形成过程抑制后,依次检测其头骨面积、头骨累积光密度和全鱼骨矿物质含量,最终结合分子对接(molecular docking)技术阐述IT与RUNX-2蛋白靶点的相互作用,为揭示IT抗骨质疏松机理提供重要数据。
1 材料与方法
1.1 材料
1.1.1药品与试剂:依替膦酸二钠(DE,正大天晴药业集团股份有限公司,纯度≥99%);淫羊藿素(实验室自制,纯度>98%);泼尼松龙(PNSL,阿达玛斯试剂有限公司;纯度≥98%);多聚甲醛(上海泰坦科技股份有限公司,纯度≥95%);3-氨基苯甲酸乙酯甲磺酸盐(MS222, adamas-reagent,纯度≥98%);HNO3(上海泰坦科技股份有限公司);其它为分析纯。
1.1.2实验动物:野生型斑马鱼胚胎(AB系,南京一树梨花生物科技有限公司)。将斑马鱼胚胎先置于6孔板中,然后加入空白E3培养基,胚胎和幼鱼在14 h/10 h光/暗循环的环境中保存,并且控制室温在(28.5±0.5)℃[24]。
1.2 方法
1.2.1药物的配制:取适量IT,精密称定,首先用超纯水配制成浓度为100 μg/mL的储备液,再量取适量储备液并分别稀释成0.1、1和10 μg/mL的IT药液。取适量依替膦酸二钠,精密称定,先配制成浓度为150 μg/mL的水溶液,再用培养基稀配成15 μg/mL的依替膦酸二钠溶液(含0.5% DMSO)。取适量PNSL,精密称定,DMSO促溶(≤10%),先配制成浓度为250 μmol/L储备液,再用培养基稀配成25 μmol/L的PNSL溶液(含0.5% DMSO)。
1.2.2斑马鱼分组与处理:将斑马鱼胚胎(受精后的第2天,2 PF),放入装3 mL空白培养基的6孔板中(每孔15只)。在3 PF,实验分组为:对照组(E3培养基),PNSL组(25 μmol/L),DE组(15 μmol/L DE和25 μmol/L PNSL),IT组(低、中、高剂量分别为:0.1、1.0或10.0 μg/mL IT和25 μmol/L PNSL)。每次喂食后清洗并更换空白E3培养基。
1.2.3骨骼和基质染色:在10 PF,斑马鱼麻醉处死后用4%多聚甲醛的PBS缓冲液(pH 7.4)固定,茜素红S(ARS, 0.5% KOH)染色12 h。准时取出并将染色剂洗净,新配制1% KOH和1.5% H2O2溶液交替漂洗1 h,再在甘油浸洗后借助显微镜获取骨染色图像。
1.2.4骨矿化分析:Image J软件定量分析斑马鱼头骨骨矿化面积(AMB)和累积光密度(COD)[21-22]。荧光倒置显微镜对头骨腹侧图像进行获取。
1.2.5矿物质含量检测:电感耦合等离子体质谱法(ICP-MS)测定斑马鱼全鱼中钙和磷的含量[21]。在10 PF,将收集的幼鱼(n=15)用双蒸水冲洗5次后,置于10 mL玻璃离心管中,用70% HNO3微波消解4 h。配备G3160B I-AS集成自动采样器的7500cx ICP/MS系统对各组斑马鱼进行钙和磷的含量测定。
1.2.6分子对接:RUNX2序列采用同源建模获得(template:1ljm CHAIN:A sequence identity:94% residue range:112-225),借助Molecular Operating 2015.10版软件,Maestro建立配体和IT的3D模型,诱导拟合对接模块将配体装配在蛋白质内部,最后进行Glide评分。
1.3 统计分析
所有数据以均值± 标准偏差(SD)表示,用SPSS 19.0软件(SPSS, Inc., Chicago, IL)进行one-way ANOVA分析,P< 0.05为差异有统计学意义。
2 结果
2.1 IT对骨矿化过程的影响
用IT的低、中、高剂量组(0.1、1.0、10.0μg/mL)将斑马鱼从3 PF孵育到10 PF,以探究IT作用下解除PNSL对斑马鱼幼鱼骨形成的抑制。ARS染色结果显示,与DMSO组相比,PNSL组的染色深度和染色面积均较低,而IT作用的三组染色深度和染色面积均较高(图1),说明IT解除了PNSL对斑马鱼幼鱼骨形成的抑制。骨矿化面积(AMB)和累积光密度(COD)定量结果表明,与PNSL组相比, IT干预使斑马鱼的COD(图2 A)和AMB(图2B)值显著升高(P< 0.01),且有剂量依赖性。
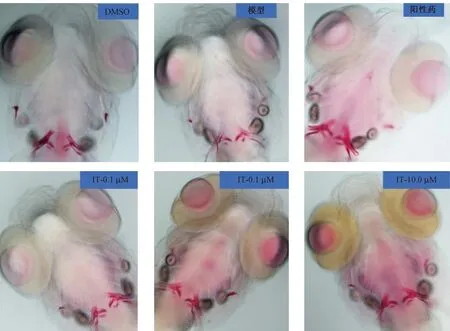
图1 IT对糖皮质激素所致骨质疏松斑马鱼的逆转作用(n=15)Fig.1 Reversal effect of different concentration of Icaritin on glucocorticoid-induced osteoporosis in zebrafish (n=15)
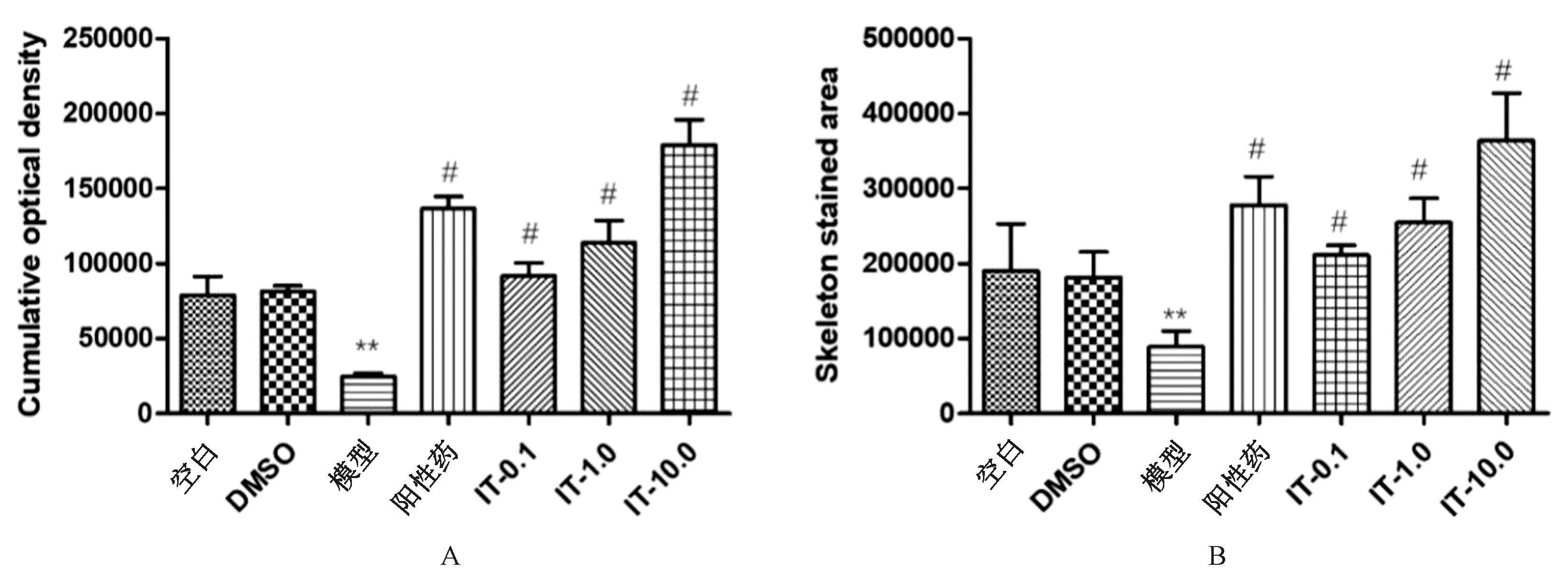
图2 IT对糖皮质激素所致骨质疏松斑马鱼的骨矿化影响(n=15)注:与对照组比较,#P<0.05;与模型组比较,**P<0.01。Fig.2 Effects of different concentrations of Icaritin on bone mineralization in zebrafish with glucocorticoid-induced osteoporosis (n=15)
2.2 IT对斑马鱼骨矿物质含量的影响
骨组织中矿物质的含量占总重量的69%~80%[23],其中又以磷和钙的含量最高。斑马鱼幼鱼中Ca和P的测定结果表明:相比DMSO,PNSL能显著降低斑马鱼钙、磷水平 (P<0.01)。而与PNSL组相比,IT干预使斑马鱼钙、磷水平显著升高(P<0.01, 图3)。随着IT浓度从0.1 μg/mL增加到10 μg/mL,斑马鱼中钙、磷元素的含量呈上升趋势,且呈明显剂量依赖性。
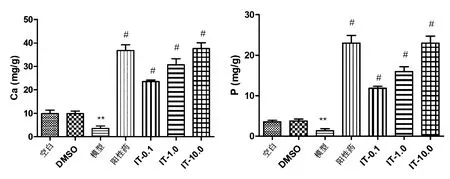
图3 IT对糖皮质激素所致骨质疏松斑马鱼钙和磷的影响(n=15)注:与对照组比较,#P<0.05;与模型组比较,**P<0.01。Fig.3 Effects of different concentrations of Icaritin on calcium and phosphorus in zebrafish with glucocorticoid-induced osteoporosis (n=15)
2.3 IT与RUNX-2蛋白靶点的分子对接
Autodock计算机模拟结果显示,IT可与RUNX-2发生对接,对接得分为-5.469 860 55,具体结果如图4所示。IT与RUNX-2蛋白的结合位点主要是3号位的-OH和2号位的苯环,受体和配体产生相互作用基团的距离分别为2.74和3.84,结合能量分别为-4.4和-1.3,一般来说能量越低,则结合越稳定。具体数据如表1所示。分子对接结果显示IT与RUNX-2蛋白有一定的结合能力。
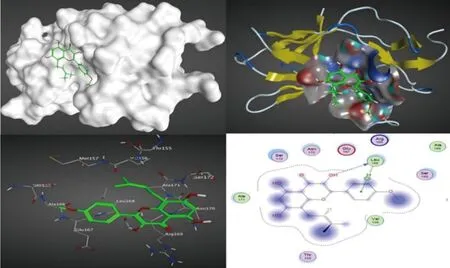
图4 受体RUNX-2与配体IT的最佳相互作用图Fig.4 The best interaction diagram of receptor RUNX-2 with small ligand Icaritin

表1 受体RUNX-2与小分子配体IT的分子对接结果
3 讨论
MSCs可以向成骨细胞分化,也可以分化为脂肪细胞,但是只有促进其成骨分化才能为骨形成和骨修复提供细胞来源[24-27]。因此,研究活性成分促进MSCs成骨分化的能力,是阐述药物抗骨质疏松作用机理的重要途径。RUNX-2是骨形态发生蛋白(bone morphogenetic protein,BMPs)的下游调控因子[28-29],RUNX-2也被称为OB的主要转录因子,是促进MSCs向OB分化和成熟[30]的重要因子。
本研究中设置了低、中、高3个剂量组IT(0.1、1.0、10.0 μg/mL)对糖皮质激素所致骨形成抑制的斑马鱼进行干预,表明IT能促进斑马鱼的骨形成和骨矿化过程,且呈剂量依赖性,由此为淫羊藿素开发成抗骨质疏松的替代药物提供了数据支撑。
