CD74介导巨噬细胞移动抑制因子对宫颈癌细胞生物学行为的影响
2020-10-26成荣杰
成荣杰, 李 楠
(哈尔滨医科大学 附属第四医院 1.妇产科; 2.病理科,黑龙江 哈尔滨150001)
宫颈癌的发病率位居全球妇女恶性肿瘤的第二位,在我国是女性生殖道最常见的恶性肿瘤,复发及转移是威胁患者生命的主要原因。2018年,全球有569847新发病例,共311,365人死于宫颈癌[1]。手术、放化疗是宫颈癌的主要治疗手段,但几十年来患者的长期生存率并未得到显著改善,晚期患者的总体生存期仍然不足1年。因此,进一步寻找宫颈癌发生发展过程中的相关调控因素是非常必要的。巨噬细胞移动抑制因子(MIF)[2]是重要的炎症反应蛋白,但近年来,MIF与肿瘤发生发展之间的关系被日益关注[3]。CD74是一种II型跨膜糖蛋白,为MIF高亲和力受体,在MHC II类分子进行外源性抗原递呈的过程中起重要辅助作用,目前,在一些疾病及肿瘤细胞中,发现MIF通过与CD74受体结合而发挥作用[4]。这也引发了我们探寻其与宫颈癌之间潜在的分子机制,以期为多靶点抗肿瘤治疗提供新思路。我们在前期研究中发现[5],MIF与其受体CD74在宫颈癌中高表达,可促进癌组织新生血管形成,表明其在宫颈癌的发生发展中发挥了重要作用。为进一步了解两者在宫颈鳞癌中所发挥的具体作用,本文通过体外细胞实验来明确MIF及CD74对宫颈癌细胞的增殖、迁移及侵袭等生物学行为的影响,明确两者在宫颈癌病理发生发展中的作用机制,从而为宫颈癌靶向分子治疗提供实验依据。
1 材料与方法
1.1 材料
宫颈鳞癌细胞株SiHa购于上海生命科学研究院,接种于含10%胎牛血清的H-DMEM中,置于5% CO2恒温培养箱内37℃培养,以0.25%胰酶消化传代。兔抗MIF及鼠抗CD74抗体购于美国Santa Cruz公司;人重组MIF因子(rhMIF)购于R&D公司;Matrigel购于美国BD 公司;CCK8试剂盒购于美国Invitrogen 公司;Tranwell 小 室 购自Santa Cruz公司。
1.2 方法
1.2.1免疫细胞化学染色法检测SiHa细胞中MIF及CD74蛋白表达 将SiHa细胞经胰酶消化后接种于24孔培养板内预先放置的盖玻片上,37℃、5%CO2培养箱内培养,待细胞80%融合时,弃去培养液,PBS清洗,4%多聚甲醛固定30 min,PBS清洗后取出细胞爬片,经蒸馏水水化、0.1% Triton X-100作用、热修复、过氧化物酶阻断液室温孵育后,血清封闭,进行一抗孵育(1∶100稀释抗MIF或CD74抗体),4℃过夜,加生物素标记二抗等,最后DAB显色,苏木精复染,常规脱水、透明、中性树胶封片。Image pro-plus 6.0软件分析,平均灰度值代表MIF和CD74蛋白表达情况。
1.2.2CCK-8法检测细胞的增殖情况 胰酶消化SiHa细胞,调整细胞密度5×104/mL,100 μL/孔接种于96孔培养板、孵育24 h。给予不同浓度rhMIF(1,10,50,100及200 ng/mL)处理细胞,24 h后更换培养基继续培养,每个浓度设3个复孔,连续观察3天。每24 h取一块培养板,每孔加入10 μl的CCK-8溶液,37℃孵育2 h后测定450 nm吸光度值(OD)。
通过上述实验筛选出加药后24 h使细胞增殖与对照组相比差异具有统计意义的最小有效rhMIF浓度用于后续实验。实验分为3组:MIF组、MIF+CD74mAb(10 μg/ml)组及MIF+对照IgG(10 μg/ml)组。观察应用抗CD74mAb后对细胞增殖的影响,细胞增殖抑制率的计算公式:(MIF组OD值-MIF+CD74mAb组OD值)/ MIF组OD值×100%。
1.2.3划痕法检测体外迁移能力 胰酶消化收集细胞,调整细胞浓度为2×105/mL,将其接种于24孔培养板,500 μl/孔。实验分组:① rhMIF刺激组(200 ng/mL);② rhMIF+CD74mAb组:细胞预先与CD74mAb孵育30 min,再加入rhMIF;③rhMIF+对照IgG组:含10 μg/mL的IgG抗体及200 ng/ml的rhMIF;④阴性对照组。待细胞单层融合,移液器枪头在培养板底部呈“一”字形划痕,无血清培养液洗涤以除去悬浮细胞,加入无血清培养基继续培养24 h。分别于划痕后0 h及24 h在倒置显微镜下观察细胞的迁移情况并照相。测量划痕后0 h的距离(A值)及24 h划痕区的距离(B值),计算细胞相对移动距离=(A-B)/A×100。
1.2.4Transwell小室检测SiHa细胞的侵袭力 实验分组同上。Matrigel胶在4℃条件下融化,与无血清培养基按1∶3比例混匀,60 μl/孔加于小室的上室膜上,37℃作用30 min。细胞经无血清培养基培养24 h后,胰酶消化细胞,调整细胞密度为1×106/mL,24孔板内加入300 μl 10%胎牛血清的培养基,小室内加入100 μl细胞悬液(细胞置于含1%胎牛血清的DMEM培养基),37℃培养24 h。取出小室,棉签擦去聚碳酸酯膜上层未穿膜的细胞,95%乙醇固定,HE染色,显微镜下计数移至微孔膜下层的细胞。每个样本计数5个视野,结果用mean±SD表示。
1.2.5统计学分析 所有数据处理采用SPSS16.0软件进行统计学分析,计量资料数据以mean±SD表示,两组间比较采用t检验;多组比较采用重复测量的One-Way ANOVA方差分析。以P<0.05为统计学意义。
2 结果
2.1 免疫细胞化学染色显示宫颈SiHa细胞高表达MIF及CD74蛋白
在宫颈SiHa细胞中,MIF和CD74阳性染色主要位于细胞的胞浆内、为棕黄色的颗粒。如图1所示,图1A显示MIF在SiHa细胞中的染色结果,主要定位于细胞浆,偶可见核着色; 图1B为CD74分子的阳性染色,其同样主要定位于细胞浆。
2.2 外源性MIF及抗-CD74mAb调控了SiHa细胞的增殖力
应用不同浓度的rhMIF处理各组细胞后,细胞的增殖情况见图2。如图2A所示:在刺激后24 h、48 h及72 h,随着MIF浓度的逐渐增加,细胞增殖力亦增强(OD值逐渐增加,24 h:F=12.125,P<0.001;48 h:F=25.147,P<0.001;72 h:F=95.812,P<0.001);且随刺激时间的延长,细胞的增殖率逐渐增加。即rhMIF呈时间-剂量依赖性促进SiHa细胞的增殖。

图1 MIF及CD74在SiHa细胞中的表达(×400)
为明确CD74是否参与MIF对宫颈癌细胞的增殖调控过程,我们进行了分组实验,结果表明(如图2B),与单纯MIF刺激组相比,抗-CD74mAb预先处理的细胞,其增殖受抑制,提示CD74参与MIF对细胞增殖的调控。

图2A:rhMIF促进SiHa细胞增殖; B:抗-CD74mAb抑制了MIF促细胞的增殖能力
2.3 MIF对SiHa细胞迁移力的影响
细胞划痕法显示(表1),200 ng/ml的MIF刺激24 h后,细胞迁移力较对照组相比明显增加(P<0.01),而当细胞与抗-CD74mAb孵育后,并不能阻断MIF对细胞迁移力的促进作用(P>0.05)。结果表明,MIF具有促进SiHa细胞迁移力的作用,但不是通过CD74实现的。

表1 MIF与CD74mAb对各处理组细胞迁移率的影响
2.4 MIF增加了SiHa细胞的侵袭力
为评估MIF对SiHa细胞的侵袭力是否有影响,利用transwell小室检测各处理组细胞穿膜的细胞数量。结果如图3及表2所示,rhMIF作用24 h后,穿膜细胞的数量与对照组相比明显增加(P<0.01);而抗-CD74mAb或IgG预处理的细胞与单纯MIF刺激组相比,差异无统计学意义。以上结果表明MIF可增加宫颈癌细胞侵袭转移力,但这种作用可能与CD74蛋白无关。
3 讨论
宫颈癌的发生发展是多步骤、多因素参与的复杂过程,涉及细胞的恶性转化、无限增殖、细胞间粘附力下降及浸润周围组织或进入脉管系统,形成浸润转移灶。因此,探寻这个复杂过程中的相关调控因素,对于阻断宫颈癌的发生发展,从而改善患者的预后具有重要的临床意义。MIF最初是在活化的T淋巴细胞中发现的,具有酶活性、参与淋巴免疫、内分泌调控及促炎作用等多种生物学功能,单核/巨噬细胞是其主要来源。Meyer-Siegle等[6]在对前列腺癌原发及转移灶进行基因差异表达分析时发现MIF在转移灶内表达上调,这是关于MIF与肿瘤间存在关联的首次报道。此后,研究者们发现MIF的其他生物学功能,如促增殖分化、调控血管生成、抑制p53基因等,由此,MIF与肿瘤关系的研究日益增多。近年研究发现,在多种恶性肿瘤中观察到MIF的过度表达,如前列腺癌、肝癌、肺癌、乳腺癌、黑色素瘤等[3,7,8],提示其参与肿瘤的发生发展。CD74作为MIF高亲和力受体,随着对MIF研究的逐渐深入,CD74的功能也备受关注,除在免疫反应中发挥作用,亦在多种癌细胞中发现CD74的过表达[9,10],Nagata等[11]研究发现CD74是评价胰腺癌患者预后的一个有用的指标。McClelland等[12]对肺癌的研究发现,MIF和CD74的表达与血管趋化因子的表达及MVD呈正相关,MIF所诱导的CXC的表达可被抗CD74抗体所阻断;在结肠癌中亦发现了MIF/CD74的共同作用[13]。而有关MIF及CD74在宫颈癌中的研究报道很少,我们在前期研究中发现了宫颈癌组织中两者的过度表达,MIF可通过调控促血管生成因子的表达,促进恶性肿瘤的血管新生,对肿瘤的生长及侵袭转移发挥作用。那么,两者是否对宫颈癌的增殖、迁移及侵袭等生物特性有调节作用,成为我们的研究目标。在本文中,我们采用一系列实验评价MIF及其受体CD74对宫颈癌细胞株生物学行为的影响,探索其参与宫颈癌发生发展的可能机制。本研究应用rhMIF处理宫颈癌SiHa细胞,结果显示MIF可促进细胞增殖,且呈时间-剂量依赖性,这与其他研究结果一致[14]。当抗CD74单抗处理细胞后,可显著抑制MIF对细胞增殖的促进作用,表明两者共同参与调控宫颈鳞癌细胞的增殖能力。
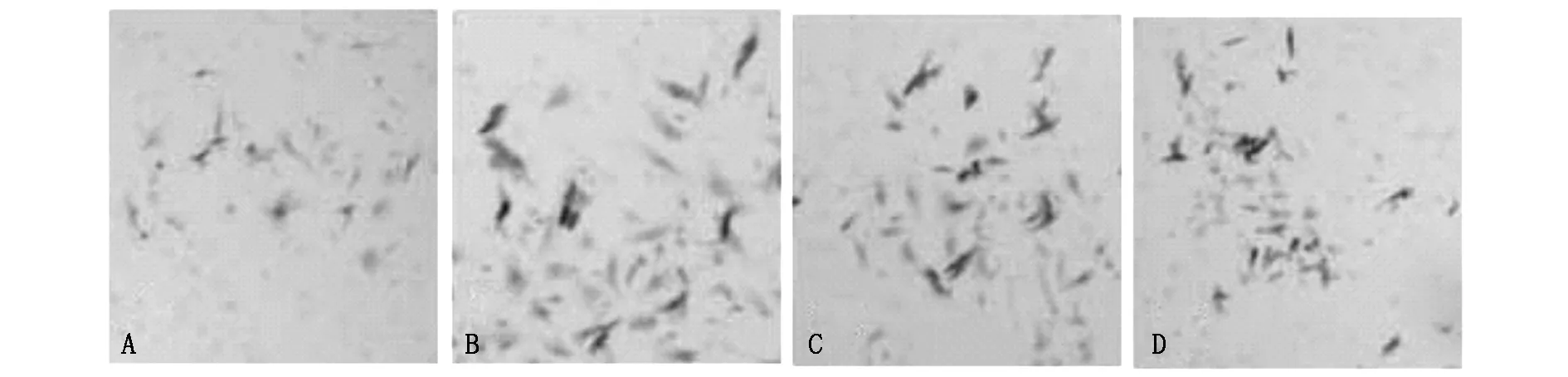
图3 MIF与CD74mAb对SiHa各处理组细胞侵袭力的影响(×100)

表2 MIF和抗-CD74mAb对各处理组SiHa细胞侵袭力的影响
细胞外基质及基底膜的降解是肿瘤侵袭转移的必要步骤,Koh等[7]通过伤口愈合实验发现,MIF基因敲除可导致癌细胞迁移减少,提示MIF与肿瘤进展密切相关。本实验通过细胞划痕法及transwell小室法分别检测MIF对SiHa细胞迁移力及侵袭力的影响,结果显示200 ng/ml rhMIF可显著促进SiHa细胞迁移及侵袭力,与对照组相比具有统计学意义;但细胞经CD74单抗预处理后,没能阻断或抑制MIF促癌细胞的迁移侵袭力,提示MIF可能通过其他受体作用途径来调控其促进宫颈癌细胞的浸润转移力。以上结果证明MIF调控了宫颈癌的增殖,迁移及侵袭等生物学行为,CD74参与了MIF对细胞增殖的调控作用,从而在宫颈癌的发生发展中发挥作用,而此过程中涉及具体的分子机制是我们将来进一步的研究方向。期望能为寻求宫颈癌的治疗新靶点提供思路,从而提高病人的生存率。
