胃癌中VEGFR2的表达及与患者预后的关系
2020-10-26唐建荣王振东
张 峰,唐建荣,王振东
(驻马店市中心医院 消化内科,河南 驻马店463000)
血管内皮生长因子受体2(VEGFR2)是参与血管生成的一种酪氨酸激酶受体,被其配体血管内皮生长因子(VEGF)激活后可促进邻近的血管生成,为癌细胞的生长提供营养,促进癌细胞的增殖、迁移和转移[1]。VEGF和VEGFR2介导生成的血管有助于胃癌的侵袭,导致胃癌的高死亡率[2]。VEGFR2在乳腺癌[3]、肺癌[4]、胶质母细胞瘤[5]、胃肠道癌症[6]、肾细胞癌[7]、卵巢癌[8]、膀胱癌[9]和骨肉瘤[10]中的高表达也得到证实。本文主要研究VEGFR2在胃癌中的表达,对患者术后生存率的影响及对胃癌细胞的作用机制。
1 材料与方法
1.1 材料胃癌细胞MNK-28和胃正常上皮细胞GES-1购于中国医学科学院基础医学研究所基础医学细胞中心;RPMI1640培养基、MTT粉末、二甲基亚砜和结晶紫等购于北京鼎国有限公司;总RNA提取试剂盒、反转录试剂盒购于日本TaKaRa公司;阿帕替尼购于上海恒瑞医药有限公司;细胞侵袭实验的小室购于美国康宁公司。
1.2 样本收集及术后随访收集2012年5月至2014年5月在我院进行胃癌手术104例患者的胃癌组织和胃癌旁组织,均经两名病理医师确诊。将患者组织放入液氮中浸润,然后放置-80℃冰箱保存待用。根据胃癌组织中VEGFR2的表达平均水平,将其分为高表达组和低表达组。所有患者在术后均进行常规的化疗未进行靶向治疗。本实验研究经过患者同意,并签署知情同意书。随访时间3-60个月,中位随访时间43个月,随访日期自手术日起到患者死亡或随访时间结束为止。
1.3 qRT-PCR按照Trizol试剂说明提取组织和细胞中的总RNA。VEGFR2上游引物序列为5′-GGACTCTCTCTGCCTACCTCAC-3′、下游引物序列为5′-GGCTCTTTCGCTTACTGTTCTG-3′,U6上游引物序列为5′-AGAAGGCTGGGGCTCATTTG-3′、下游引物序列为5′-AGGGGCCATCCACAGTCTTA-3′。根据反转录试剂盒说明书进行逆转录,逆转录条件为42℃ 60 min,72℃10 min。cDNA采用BIO-RAD CFX96系统进行实时定量PCR检测VEGFR2的表达,以U6作为内参。每个待测基因设4个复孔。数据通过BIO-RAD CFX96系统进行处理,按照公式RQ=2-ΔΔCT计算各组间的倍数关系。
1.4 RNA干扰实验VEGFR2的小干扰RNA(5′-GGAAATCTCTTGCAAGCTA-3′)和阴性对照RNA(5′-TTCTCCGAACGTGTCACGT-3′),由上海吉凯基因化学技术有限公司合成。转染至MNK-28细胞中设置为对照组和VEGFR2 sh-RNA组,24 h后检测VEGFR2的mRNA水平。
1.5 细胞增殖实验对照组和VEGFR2 sh-RNA组细胞以每孔1×104的密度接种于96孔板中,设置不同的检测时间点,将噻唑蓝溶液加入96孔板中,放置恒温箱中静置4 h。弃去上清,每孔加入150 μl二甲基亚砜溶液,在振荡器上震荡5 min,使细胞充分裂解,用酶标仪检测细胞的光密度(OD)。
1.6 细胞侵袭实验对照组和VEGFR2 sh-RNA组细胞用100 μl无血清培养基悬浮,每孔3×104个细胞接种于小室。配置600 μl含有20%血清的培养基加入小室下部,注意小室下部不能有气泡产生,否则会影响细胞的迁移或侵袭能力,在恒温箱中培养48 h。取出小室弃掉溶液,依次置于多聚甲醛和结晶紫中进行固定和染色。用棉签轻轻擦去未发生侵袭的细胞,采用贴壁细胞计数法,计算每个视野中发生侵袭的细胞数。

2 结果
2.1 VEGFR2在胃癌组织和细胞中高表达且与患者的不良生存率有关在胃癌组织中VEGFR2的mRNA水平明显高于胃癌旁组织(P<0.05);在胃癌细胞MNK-28中VEGFR2的mRNA水平明显高于胃正常上皮细胞(P<0.05);VEGFR2 高表达组患者的生存率明显低于VEGFR2低表达组(P<0.01)。见图1。
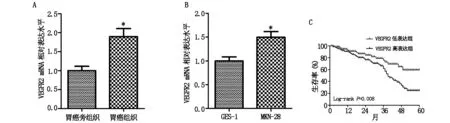
图1 VEGFR2在不同胃癌组织和细胞中的表达水平及对患者生存率的影响
2.2 VEGFR2促进胃癌细胞的增殖VEGFR2 shRNA转染至MNK-28细胞中,VEGFR2的表达降低;经过细胞增殖实验检测,VEGFR2 shRNA组细胞的增殖与对照组相比有所减弱;另外,10 μmol/L的阿帕替尼处理组细胞与对照组相比,细胞的增殖能力也明显减弱。见图2。
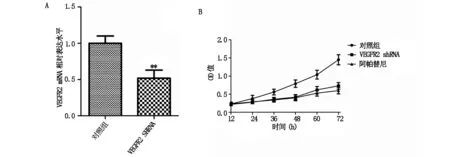
图2 VEGFR2对胃癌细胞增殖的影响
2.3 VEGFR2促进胃癌细胞的侵袭VEGFR2 sh-RNA组和阿帕替尼组细胞发生侵袭的细胞数分别为38±8、32±7,均低于对照组发生侵袭的细胞数65±7(P<0.01)。见图3。
3 讨论
VEGFR2的调节在肿瘤的研究中一直是受关注的话题,在某些肿瘤中现已确定VRGFR2及其配体的高表达,与患者预后不良相关,应用与VEGFR2相关的靶向治疗,可抑制肿瘤血管生成,可改善晚期胃癌患者的预后[11]。在乳腺癌中,仅在三阴性乳腺癌中检测到VEGFR2的高表达,并促进上皮间质转化,激活NF-κB和β-catenin信号通路[12]。在卵巢癌中,VEGFR2通过激活Src介导干细胞的能力,上调Bmi促进干细胞样细胞增殖[8]。在膀胱癌中VEGFR2可作为circRNA-MYLK的下游驱动基因,促进Ras/ERK信号通路的激活[9]。
在本研究中,我们通过收集胃癌患者术后的胃癌组织及胃癌旁组织,检测到胃癌组织中VEGFR2的表达明显增加,另外在胃癌细胞中也检测到VEGFR2的表达增加。经过对患者的术后随访,并通过统计分析VEGFR2高表达组患者的生存率明显低于VEGFR2低表达组。说明VEGFR2的高表达与胃癌患者的不良预后相关。为了进一步研究VEGFR2促进胃癌发生发展的原因,又进行以下细胞实验。采用RNA干扰实验,减弱MNK-28细胞中VEGFR2的表达,检测到VEGFR2低表达组细胞的增殖能力和侵袭能力与对照组相比明显减弱。阿帕替尼为VEGFR2的靶向药物,是第一个被证实在晚期胃癌标准化疗失败后安全有效的小分子抗血管生成靶向药物,同时,阿帕替尼也是目前晚期胃癌
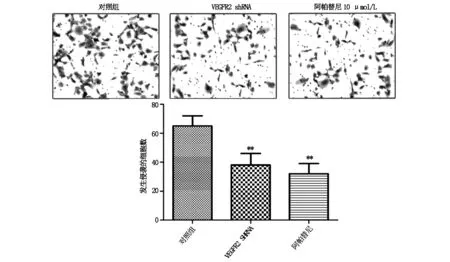
图3 VEGFR2对胃癌细胞侵袭的影响
靶向药物中唯一的口服制剂。在本文中采用10 μmol/L的阿帕替尼处理MNK-28细胞24 h后,检测到细胞的增殖能力和侵袭能力明显减弱。由此证明,VEGFR2在胃癌中促进细胞的增殖和侵袭,通过靶向药物阿帕替尼的处理,可明显减弱由VEGFR2所引起的细胞增殖和侵袭。综上所述,VEGFR2通过增加胃癌细胞的增殖和侵袭能力促进胃癌发生发展并与患者的预后不良相关。
