单纯分泌雄激素的肾上腺肿瘤临床特征研究
2020-10-26郭伟红王坤玲张玉洁
王 浩, 郭伟红, 王坤玲, 王 亮, 张玉洁, 何 庆, 刘 铭
女性体内雄激素主要有三个来源:卵巢、肾上腺及外周组织的转化,其类型包括硫酸脱氢表雄酮(dehydroepiandrosteronesulphate, DHEA-S)、脱氢表雄酮(dehydroepiandrosterone, DHEA)、雄烯二酮(androstenedione, AD)、睾酮(testosterone,T)和双氢睾酮[1-2]。其在女性早期性腺分化、青春期生长发育及调节机体代谢方面起重要作用。雄激素增多通常见于青春期及育龄期女性,而在绝经后女性中比较少见。约10%的女性在不同的年龄段存在雄激素增多[3],该病病因复杂,其中多囊卵巢综合征为72.1%,特发性雄激素增多症为15.8%,特发性多毛症为7.6%,21羟化酶缺乏症为4.3%,分泌雄激素肿瘤0.2%[4]。而单纯分泌雄激素的肾上腺肿瘤更罕见,约占肾上腺肿瘤的0.13%~2.6%[5-6]。本文通过回顾分析就诊于我科3例单纯分泌雄激素的肾上腺肿瘤患者临床特征及诊治过程,以期为临床医师提供参考。
1 临床资料
1.1 一般资料 选取2015年1月—2020年8月就诊于天津医科大学总医院内分泌代谢科的3例单纯分泌雄激素的肾上腺肿瘤患者。均为女性,发病年龄13~54岁,平均(31±20.95)岁,病程4个月~4年。
1.2 临床特征 所有患者均存在不同程度男性化表现:多毛(3例)、痤疮(3例)、声音低沉(2例)、阴蒂肥大(1例)、雄激素性脱发(1例)。其中青春期前患者(例1)除月经紊乱外,出现特异性的性发育异常及性早熟表现:阴毛、毳毛增多、阴蒂肥大、生长加速、骨龄提前(实际年龄12.6岁,骨龄15.9岁)(图1)。另1例育龄期患者(例2)存在月经紊乱。
1.3 实验室检查 所有患者入院均完善实验室检查:血清总T水平(6.03~11.36)nmol/L,平均(8.32±2.74)nmol/L(正常范围 0.49~2.64nmol/L)。DHEA10.2~54.79nmol/L, 平 均(36.19±23.20)nmol/L(正常范围(2.78~36.44) nmol/L)。AD均大于参考范围(1.05~11.52 nmol/L)。17羟孕酮(17-OHP)为(7.09~57.46) nmol/L,平均(29.78±25.55)nmol/L( 正 常 范 围 0.15~3.09 nmol/L)。为排除其他肾上腺疾病,所有患者均完善促肾上腺皮质激素(ACTH)、皮质醇(Cor)、24 h尿游离皮质醇、立卧位肾素、醛固酮及24h尿醛固酮、24 h尿香草苦杏仁酸(24hVMA)检查,均未见明显异常。性激素水平见表1。
1.4 影像学检查 所有患者均行肾上腺增强CT检查发现肾上腺肿物(图2),大小(3.7~5)cm,平均(4.17±0.72)cm,其中左侧2例,右侧1例。例1患者CT显示类圆形肿块,后下方多发较明显强化不规则结节影,延迟后廓清。例2、例3患者CT显示椭圆或类圆形肿块,边界清晰,密度不均;增强后早期明显强化,延迟期强化程度减低。所有患者均完善盆腔MRI未见明显异常。例1、例3患者均完善PET-CT检查,提示肾上腺区软组织密度肿块影,代谢异常增高,考虑为恶性病变。例3患者完善奥曲肽显像(DOTATATE)示:左侧肾上腺区低密度肿块影,DOTATATE摄取异常增高,考虑神经内分泌肿瘤可能性大。

图2 肾上腺增强CT影像
1.5 统计学方法 数据采用SPSS 20.0软件进行统计分析,计量资料均采用表示,组间比较用t检验,P<0.05为差异有统计学意义。
2 治疗及结果
2.1 术中及术后 所有患者均于全麻下行后腹腔镜肾上腺肿物切除,例1切面为暗褐色,例2为灰黄色,例3为棕黄色。肿瘤直径(3.7~5)cm,平均(4.33±0.65)cm。术后复查睾酮均降至正常水平,平均(1.39±0.65)nmol/L,低于术前的(8.32±2.74)nmol/L,差异有统计学意义(t=4.26,P=0.013)(表1、图3)。病理诊断:例1为肾上腺皮质癌,侵及肝脏;免疫组化染色:肿瘤细胞α-Inhibin、Melan A阳性,Syn部分阳性,CgA、Hepatocyte阳性,Ki-67指数局灶约10%,肝脏断端未见癌侵及。例2、例3患者病理均提示肾上腺皮质腺瘤(图4)。
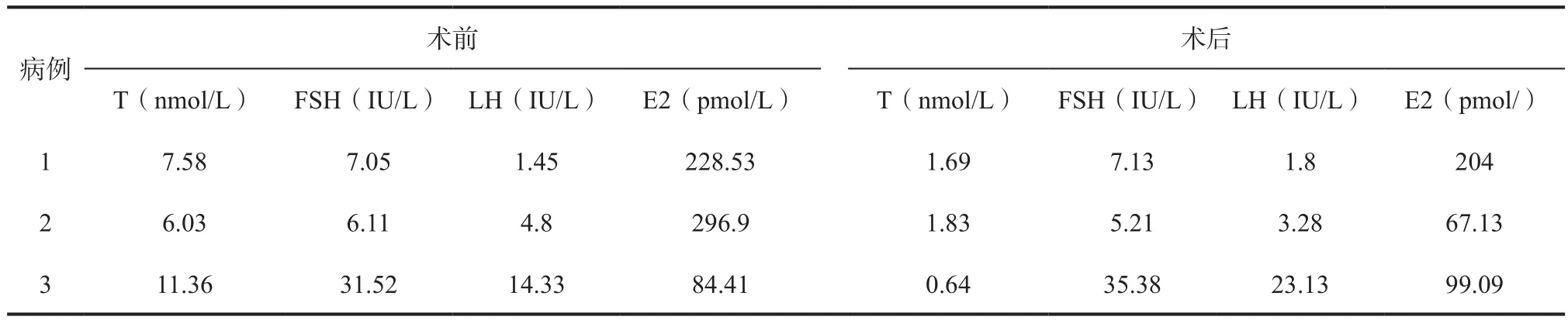
表1 3例患者手术前后性激素水平变化情况
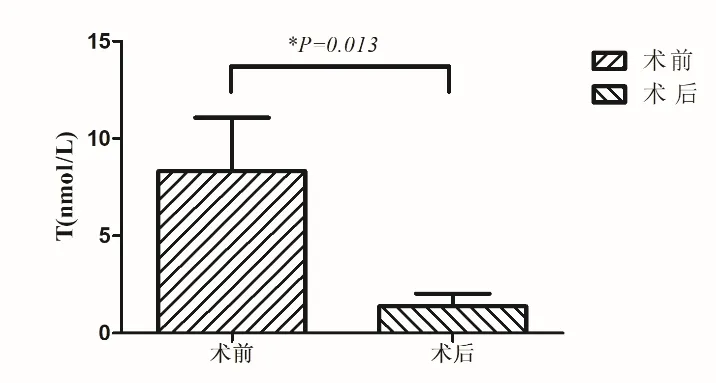
图3 患者手术前后睾酮水平变化比较
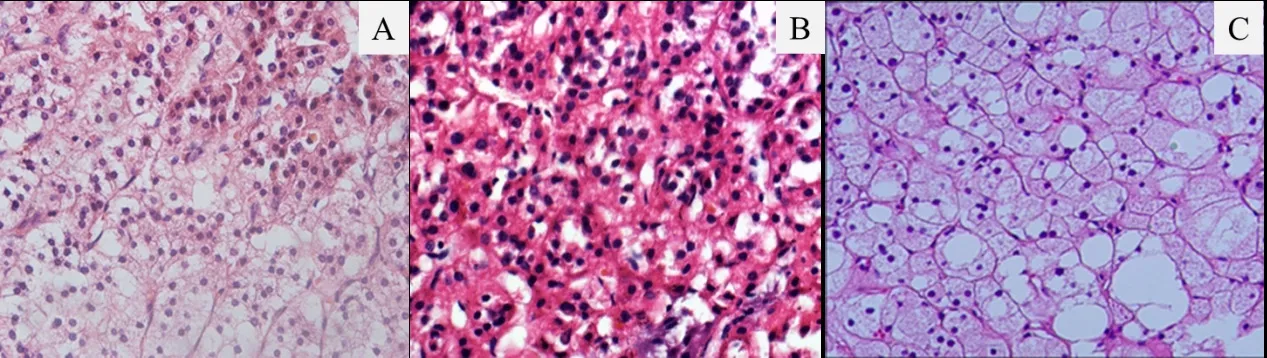
图4 3例患者肾上腺肿瘤病理结果(HE染色,×400)
2.2 随访 术后随访6个月,所有患者雄激素增多症状较前明显好转,睾酮水平处于正常范围。例1、例2患者未见肿瘤转移。例3患者仍在随访中。
3 讨论
单纯分泌雄激素的肾上腺肿瘤非常罕见,约占引起雄激素增多原因的0.1%。其中约75%的患者病理结果为肾上腺皮质癌,其余为肾上腺皮质腺瘤[7]。根据年龄和性别不同,临床表现也不尽相同。青春期前多表现为性发育异常、性早熟,如阴毛、皮肤毳毛增加、痤疮、生长加速、骨骺提前闭合,且女孩可能出现阴蒂肥大,男孩出现阴茎增大。成年女性多出现多毛、痤疮、喉结、月经紊乱或闭经、声音低沉、雄激素性脱发、第二性征退化等男性化特征[8]。由于成年男性多无明显临床表现或仅表现为不育,睾酮水平正常或高于正常,极易漏诊。
本文3例患者分别为青春期前、育龄期及绝经后女性,例1青春期前女性除多毛外,还存在痤疮、骨龄发育提前、阴蒂肥大等特异性表现;例2、例3育龄期及绝经后女性则以高雄激素表现为主。对于绝经后女性,高雄激素的表现及睾酮水平升高提示可能存在分泌雄激素肿瘤[9],该类肿瘤男性化表现更加显著,且促性腺激素的负反馈抑制更加明显。Sarfati等[10]研究显示,在雄激素增多的绝经后女性中,总睾酮>4.9nmol/L或FSH<35IU/L时,肿瘤性疾病可能性更大。例3患者总睾酮水平为11.4nmol/L,FSH水平为31.52IU/L,符合该判断,但因绝经后女性本身FSH、LH水平均因失去雌激素负反馈而升高,所以应结合患者情况综合判断,并随访术后FSH、LH水平变化。
目前没有单一雄激素被证明对该病的诊断有较高敏感性和特异性,同时检测多种雄激素对明确诊断该病至关重要。由于DHEA、DHEAS几乎都来源于肾上腺网状带分泌,所以分泌雄激素的肾上腺肿瘤患者DHEA、DHEAS及17-OHP水平更高,不被中剂量地塞米松抑制试验抑制,且与其他雄激素增多的患者相比,DHEAS、AD及睾酮水平往往同时升高[11]。本文患者均存在睾酮、17-OHP及AD升高,而例2患者DHEA处于正常范围,分析其原因可能是肾上腺来源的雄激素是由肾上腺皮质网状带合成的。有研究曾报道一例DHEA、17-OHP正常的肾上腺源性的雄激素肿瘤患者,提出3β-羟类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-HSD)和细胞色素P450 17α-羟 化 酶(cytochrome P450 17α-hydroxylase,CYP17)活性升高,能够使雄激素前体物质如DHEA、17-OHP等转化为AD,在网状带17β-羟化酶的催化下更多转化为睾酮[5]。所以仅根据DHEA、DHEAS等雄激素水平来判断病因是不全面的,要进一步完善盆腔、肾上腺影像学检查及奥曲肽显像等进一步明确该类神经内分泌肿瘤的良恶性以及是否出现转移。
针对该类肿瘤应按其他有分泌功能肾上腺肿瘤的指南进行治疗。手术切除是首选治疗方法。由于其多为恶性,为减少局部复发,推荐采用开放手术[12]。随着腔镜技术的发展,腔镜手术因减少了住院时间、出血量、脏器损伤及感染发生率,已有逐渐取代传统开放性手术的趋势。目前,腹腔镜被推荐用于直径<6cm且考虑为良性的肾上腺肿瘤[12],而对于巨大肾上腺腺瘤(直径≥6cm)及肾上腺皮质癌来说,其安全有效性目前仍有争论。因此术前需要对肿瘤性质进行初步评估以决定手术方式。同时,通过改良Weiss评分和疾病程度来进一步明确该类肿瘤的良恶性[13-15]:(1)核异形大小;(2)核分裂指数≥5/50高倍镜;(3)非典型核分裂;(4)透明细胞占全部细胞≤25%;(5)肿瘤细胞弥漫性分布(>30%);(6)肿瘤坏死;(7)侵犯静脉;(8)窦状样结构浸润;(9)侵犯薄膜。每项赋值1分,≥3分者诊断为恶性肿瘤。此外,2012年欧洲肿瘤内科学会推荐使用改良后MacFarlane评分以评估预后[13]。I期:肿瘤直径≤5cm,无局部转移;II期:肿瘤直径>5cm,无局部转移;III期:淋巴结转移和(或)肿瘤局部浸润和(或)腔静脉和(或)肾静脉的肿瘤血栓;IV期:远处转移。其中I、II期患者通过手术治疗后病情可缓解[6]。单纯分泌雄激素的肾上腺肿瘤转移主要发生在肝脏、肺及局部淋巴结,大多在肿瘤切除后1年内出现转移[12]。所以术后对电解质、肾上腺皮质功能、性激素水平及相关影像学检查的随访至关重要。本文所有患者均行后腹腔镜切除肾上腺肿物,术后随访6个月,临床症状明显改善,雄激素水平处于正常范围,例1、例2患者均未见肿瘤转移,例3患者仍在随访中。
