氧化石墨烯纳米支架培养脐源性MSC调节关节微环境对软骨的修复作用
2020-10-26刘爱峰张君涛巩树伟陈继鑫
刘爱峰, 王 平, 张 超, 张君涛, 巩树伟, 陈继鑫
膝骨性关节炎(knee osteoarthritis, KOA)是中老年人的常见病、多发病,随着社会老龄化进程的加剧,该病将来会成为困扰中老年人群的主要疾病之一[1],因此对该病研究非常有意义。虽然当前中西医的临床治疗方法众多,但均不能根除疾病[2],即使临床症状可以得到缓解,但患者也无法摆脱向晚期发展的最终趋势,而对保守治疗效果不理想的患者,大多只能通过手术的方式进行治疗[3],而手术治疗具有创伤大、风险高、费用高的问题。目前很多研究集中在膝关节软骨的再生与修复上,通过前期的研究发现氧化石墨烯(graphene oxide, GO)颗粒润滑剂能通过润滑作用促进KOA软骨细胞的修复,而脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSC)是目前研究的热点,其具有定向分化的潜能。
本课题组前期实验已经证明将GO注射于大鼠关节腔内后,其心脏、肝脏和肾脏的病理均未见异常,也没有发现病理渗出液,说明GO对大鼠未发生肝肾功能损害及组织损伤。且本实验前期通过体外培养已经证实了GO与UCMSC的生物相容性,并且初步探索了适宜的剂量浓度,通过关节腔注射的方式也安全易操作。本研究利用GO颗粒润滑剂搭载UCMSC来改善KOA关节腔内的局部微环境,通过利用不同方法制备的KOA动物模型验证其有效性,以期为治疗KOA寻求新方法。
1 材料与方法
1.1 材料、试剂及设备 GO颗粒、UCMSC、透明质酸(HA)、一氧化氮(NO)检测试剂盒、白细胞介素-6(IL-6)试剂盒、肿瘤坏死因子(TNF)-α试剂盒、GAG试剂盒、COL-II试剂盒(美国CCC公司);Micro-CT(德国Siemens公司),离心机(美国Thermo Fisher Scientific公司),酶标仪(美国Thermo Fisher Scientific公司)。实验所选用的动物均来自天津中医药大学动物实验中心提供的12周雄性新西兰兔64只(SCXK津2016-0001),体质量2kg左右,培养环境为清洁级。1.2 GO与UCMSC的体外共培养
1.2.1 GO与UCMSC的生物相容性 观察GO对UCMSC的细胞毒性,具体方法为:取P3代UCNSC细胞和GO固体颗粒,并进行分组培养观察,对照组为单纯UCMSC培养组,UCMSC浓度均为5.0×105MSC/mL;实验组为UCMSC+GO联合培养组,细胞浓度同样为5.0×105MSC/mL;GO颗粒质量为5 mg,相对混匀后接种到24孔板。在37 ℃,5% CO2培养箱中过夜培养,连续观察并拍照记录。
1.2.2 UCMSC与不同浓度GO的体外培养 将浓度为8.0×104/mL的UCMSC分别与浓度为30 mg/mL、10 mg/mL、300 μg/mL、200 μg/mL、100 μg/mL、30 μg/mL、15 μg/mL的 GO 纳 米颗粒进行体外培养,取P3代脐带UCMSC与GO混合后接种到24孔板,每孔接种密度为5.0×104/mL,每个浓度平行接种3孔。在37℃,5%CO2培养箱中过夜培养,连续观察并拍照记录。
1.2.3 不同浓度UCMSC与GO的体外培养 将浓度分别为8×104/mL、4×104/mL、2×104/mL的UCMSC分别与浓度为30 μg/mL的GO纳米颗粒进行体外培养,取P3代脐带UCMSC与GO混合后接种到12孔板,每孔接种100 μL,每个浓度平行接种4孔。在37℃,5% CO2培养箱中过夜培养,连续观察并拍照记录。
1.2.4 UCMSC与GO颗粒润滑剂的体外共培养UCMSC接种密度2×105/mL,GO颗粒润滑剂选用混合浓度为15 μg/mLGO+0.5%HA与30 μg/mLGO+0.25%HA;24孔板每孔接种1 mL;在37℃,5%CO2培养箱中过夜培养,连续观察并拍照记录。观察GO颗粒润滑剂对UCMSC体外存活影响的情况:UCMSC浓度为5×106/mL,分别接种于无培养基的普通培养皿中,一组添加生理盐水5 mL,另一组添加30 μg/mLGO+0.25%HA的GO颗粒润滑剂5 mL,室温下过夜培养24 h后统计UCMSC的存活率。
1.3 实验造模 通过改良Hulth+软骨缺损以及改良木瓜蛋白酶控释剂注射的方法建立KOA动物模型[4-5],具体造模方法如下:
1.3.1 改良Hulth+软骨损伤模型 将动物称重后以水合氯醛溶液(3 mL/kg)麻醉,然后进行右膝关节的备皮、消毒,将其仰卧于手术台上,固定四肢。在无菌条件下取右膝关节内侧纵切口长约2 cm,逐层切开显露膝关节腔,然后切断前交叉韧带,切除内侧半月板,制作关节不稳模型。利用3.5 mm直径圆形打孔器对暴露的股骨内侧髁表面软骨制作圆形软骨缺损区域(直径3.5 mm,深度3 mm)。生理盐水冲洗并取出破碎软骨组织后,缝合伤口。术后每只动物给予4U庆大霉素1 mL,连续3 d预防感染。术后不固定伤肢,自由活动及进食。
1.3.2 改良木瓜蛋白酶控释剂模型 将动物称重后以水合氯醛溶液(3 mL/kg)麻醉,将35%浓度的帕洛沙姆作为载药体加载4%的木瓜蛋白酶,制备成温敏型原位凝胶控释注射剂,注射剂量标准按0.05 mL(1.6U)/关节。将注射剂从实验兔的右膝关节内侧或外侧间隙进入,回抽无血性液体后将木瓜蛋白酶混合液注射入膝关节腔内。将完成注射后的实验兔的双膝关节及以下部分放入自制加热箱内,箱内温度控制在50 ℃,加热时间为2 h。加热期间,注意箱内温度计温度,始终保持在50 ℃左右,同时保证双膝关节以上的部分不受到加热影响。2 h后造模结束,将实验兔取出,自由活动,正常食水。.
1.4 实验分组 本研究设计遵循实行“3R原则”包括实验动物的替代、减少和优化原则。利用改良Hulth+软骨缺损以及改良木瓜蛋白酶控释剂注射两种不同方法建立两组实验动物模型,分别为改良Hulth+软骨缺损组,共制作32只,以软骨损伤为主要病理表现,继发关节内炎性改变。另一组为改良木瓜蛋白酶控释剂关节注射组,同样制作32只,以软骨细胞变性坏死,进而诱发关节内炎性改变。
以上两组动物共计64只,造模过程顺利,没有出现动物死亡情况。每组32只动物模型,分为空白对照组8只,治疗实验组24只。实验组根据治疗方法的不同将实验组分为3组:GO颗粒治疗组(GO组)、UCMSC治疗组(UCMSC组)、GO颗粒载UCMSC治疗组(GO+UCMSC组),每组各8只。
1.5 实验方法
1.5.1 治疗方法 GO组利用1 mL注射器于动物模型的右膝关节腔内注射0.5 mL的GO颗粒润滑剂,浓度为30 μg/mLGO+0.25%HA;UCMSC组利用1 mL注射器于动物模型的右膝关节腔内注射0.5 mL的UCMSC,浓度为5×106个细胞/mL;GO+UCMSC组利用1 mL注射器于动物模型的右膝关节腔注射0.5 mL的GO颗粒润滑剂搭载UCMSC混合悬液,GO颗粒润滑剂浓度为30 μg/mLGO+0.25%HA,UCMSC浓 度 为 5×106个细胞/mL。
1.5.2 操作方法 关节腔注射时首先用移液器从实验前期制备好的GO颗粒剂、UCMSC及GO颗粒剂搭载UCMSC混合悬液中抽取并分装至各组1 mL注射器中,操作过程中注意注射液、无菌枪头及无菌注射针头不要被污染。然后利用动物固定架将动物固定,助手将右髋关节外展外旋以暴露膝关节内侧,同时屈曲右膝关节90°左右,操作者对膝关节前内侧区域进行碘伏消毒。最后操作者从右膝胫骨结节内上方1 cm左右处进针,阻力感消失后进行注射。在操作期间,助手要注意对动物右下肢的固定力度不要过大,以免造成损伤,如果动物肌肉紧张明显,可以先行0.25%的利多卡因0.1 mL局部浸润麻醉。
1.5.3 治疗周期 所有关节腔注射治疗均为1次,改良Hulth+软骨缺损组造模后1个月开始治疗,治疗观察期8周,改良木瓜蛋白酶控释剂关节注射组造模后1周开始治疗,治疗观察期8周。
1.6 观察指标
1.6.1 血清学指标检测 治疗8周后,在无菌条件下分别抽取两组实验KOA动物模型耳缘静脉血5 mL,注入肝素化离心管中,以3000 r/min离心10 min收集血清,于-20 ℃保存。采用ELISA酶联免疫吸附试验法[6]检测血清IL-6、TNF-α、NO、糖胺聚糖(GAG)和II型胶原蛋白(COL-II)的含量。
1.6.2 病理学检测 空气栓塞法处死动物,取完整右膝关节,去除周围皮肤、肌肉,暴露股骨髁软骨退变缺损区域,切片,包埋,进行HE染色病理学检测。
1.7 统计学方法 采用SPSS19.0软件进行统计分析。计量资料用表示,多组比较采用方差分析,进一步两两比较用LSD-t检验;检验水准α=0.05。
2 结果
2.1 GO与UCMSC的体外共培养情况
2.1.1 UCMSC与GO颗粒体外培养情况UCMSC与GO与共培养24 h,UCMSC正常生长,GO没有引起UCMSC细胞的大量死亡,GO颗粒开始聚集成团,UCMSC细胞有向GO聚集的倾向,并将GO颗粒逐步包裹起来(图1)。
UCMSC与GO与共培养72 h,UCMSC正常生长,GO没有引起UCMSC细胞的大量死亡,观察到UCMSC细胞进一步向GO聚集的倾向,并向GO颗粒攀爬将其包裹成团,UCMSC开始立体生长,并刺激增殖(图2)。UCMSC与GO与共培养7 d,UCMSC正常生长,GO没有引起UCMSC细胞的大量死亡,观察到UCMSC细胞基本全部向GO聚集,将GO颗粒严密包裹起来,形成GO+UCMSC的集团结构(图3)。

图1 UCMSC与GO共培养24h(×40)

图2 UCNSC与GO共培养72h(×40)

图3 UCMSC与GO共培养7 d
2.2 血清NO检测结果 组内比较:改良Hulth+软骨缺损组中,GO+UCMSC组血清NO平均值(17.624±0.127)低于空白组(22.097±0.352),差异有统计学意义(P<0.01),UCMSC组血清NO平均值(21.020±0.026)与空白组差异无统计学意义(P=0.064),GO组血清NO平均值(21.436±0.031)与空白组差异无统计学意义(P=0.1925),GO+UCMSC组与UCMSC组差异无统计学意义(P>0.05)。改良木瓜蛋白酶控释剂关节注射组中,GO+UCMSC组血清NO平均值(17.799±0.049)低于空白组(23.662±0.056),差异有统计学意义(P<0.01),UCMSC组血清NO平均值(19.424±0.046)与GO组血清NO平均值(20.544±0.085)均低于空白组(P<0.05);GO+UCMSC组低于UCMSC组,差异有统计学意义(P<0.05)。组间比较:GO+UCMSC组、UCMSC组比较及GO组比较,差异均无统计学意义(P>0.05),空白组比较差异有统计学意义(P=0.029),见图 4。

图4 治疗后血清NO结果(ng/mL)
2.3 血清COL-II检测结果 组内比较:改良Hulth+软骨缺损组中,GO+UCMSC组血清COL-II平 均 值(19.372±0.063) 高 于 空 白 组(13.475±0.342),差异有统计学意义(P<0.01),UCMSC组血清COL-II平均值(15.589±0.063)高于空白组(P<0.01),GO组血清COL-II平均值(14.127±0.102)与空白组差异无统计学意义(P>0.05);GO+UCMSC组高于UCMSC组,差异有统计学意义(P<0.01)。改良木瓜蛋白酶控释剂关节注射组中,GO+UCMSC组血清COL-II平均值(16.257±0.416)高于空白组(12.253±0.147),差异有统计学意义(P<0.01),UCMSC组血清COL-II平均值(14.429±0.092)与空白组差异无统计学意义(P>0.05),GO组血清COL-II平均值(13.644±0.028)与空白组差异无统计学意 义(P>0.05);GO+UCMSC组 与 UCMSC组比较差异具有统计学意义(P<0.01)。组间比较:GO+UCMSC组比较、UCMSC组比较差异均有统计学意义(P<0.01),GO组比较、空白组比较差异均无统计学意义(P>0.05),见图5。
2.4 血清GAG检测结果 组内比较:改良Hulth+软骨缺损组中,GO+UCMSC组血清GAG平均值(37.439±2.155)高于空白组(23.832±0.891),差异有统计学意义(P<0.01),UCMSC组血清GAG平均值(29.022±0.973)高于空白组(P<0.05),GO组血清GAG平均值(26.342±1.042)与空白组差异无统计学意义(P>0.05);GO+UCMSC组高于UCMSC组,差异有统计学意义(P<0.01)。改良木瓜蛋白酶控释剂关节注射组中,GO+UCMSC组血清GAG平均值(26.554±0.450)高于空白组(18.709±0.552),差异有统计学意义(P<0.01),UCMSC组血清GAG平均值(24.028±0.675)高于空白组(P<0.01),GO组血清GAG平均值(22.689±0.641)高 于 空 白 组(P<0.05);GO+UCMSC组 高 于UCMSC组(P<0.05)。组间比较:GO+UCMSC组比较、空白组比较,差异均有统计学意义(P<0.01),UCMSC组比较、GO组比较,差异无统计学意义(P>0.05),见图6。
2.5 血清IL-6检测结果 组内比较:改良Hulth+软骨缺损组中,GO+UCMSC组血清IL-6平均值(7.426±0.294)低于空白组(16.082±0.323),差异有统计学意义(P<0.01),UCMSC组血清IL-6平均值(9.668±0.194)低于空白组,GO组血清IL-6平均值(10.957±0.343)低于空白组;GO+UCMSC组低于UCMSC组(P<0.01)。改良木瓜蛋白酶控释剂关节注射组中,GO+UCMSC组血清IL-6平均值(8.680±0.242)低于空白组(18.367±0.861),差异有统计学意义(P<0.01),UCMSC组 血 清 IL-6平 均 值(9.506±0.123)低于空白组(P<0.01),GO组血清IL-6平均值(10.002±0.191) 低 于 空 白 组(P<0.01);GO+UCMSC组低于UCMSC组(P<0.05)。组间比较:GO+UCMSC组比较、空白组比较,差异均有统计学意义(P<0.05),UCMSC组比较、GO组比较,差异无统计学意义(P>0.05),见图7。

图5 治疗后血清COL-II结果(ng/mL)

图6 治疗后血清GAG结果(ng/mL)

图7 治疗后血清IL-6结果(ng/mL)
2.6 血清TNF-α检测结果 组内比较:改良Hulth+软骨缺损组中,GO+UCMSC组血清TNF-α平均值(5.139±0.183)低于空白组(9.466±0.177),差异有统计学意义(P<0.01),UCMSC组 血 清 TNF-α 平 均 值(6.109±0.044) 低 于空 白 组(P<0.01),GO 组 血 清 TNF-α 平 均 值(8.447±0.113) 低 于 空 白 组(P<0.01);GO+UCMSC组低于UCMSC组比较(P<0.01)。改良木瓜蛋白酶控释剂关节注射组中,GO+UCMSC组血清TNF-α平均值(6.210±0.058)低于空白组(10.013±0.197),差异有统计学意义(P<0.01),UCMSC组血清TNF-α平均值(6.856±0.160)低 于 空 白 组(P<0.01),GO 组 血 清 TNF-α 平均值(8.891±0.188)低于空白组(P<0.01);GO+UCMSC组低于UCMSC组(P<0.05)。组间比较:GO+UCMSC组、空白组,差异均有统计学意义(P<0.05),UCMSC组比较、GO组比较,差异均无统计学意义(P>0.05),见图8。
2.7 HE病理学检测结果 使用HE染色股骨内侧髁关节软骨,发现A组软骨缺损程度及范围较B组呈现明显、加重趋势,损伤区域可累及整个关节软骨,并且主要累及中层及深层。B组关节软骨缺损呈现不规则分布,此时染色减少,往往伴随着局部细胞数量的减少,两组比较有明显差异。
在改良Hulth+软骨缺损组中,UCMSC+GO、UCMSC、GO、空白组的软骨修复效果呈梯度降低,其中UCMSC+GO组修复效果最好,软骨厚度最厚,与周围软骨接触较紧密,并且软骨细胞呈现一定的分层趋(图9)势。在改良木瓜蛋白酶控释剂关节注射组中,UCMSC+GO、UCMSC、GO、空白组的软骨修复效果呈梯度降低,其中UCMSC+GO组修复效果最好,软骨厚度最厚,与周围软骨接触较紧密,并且软骨细胞呈现一定的分层趋势(图10)。
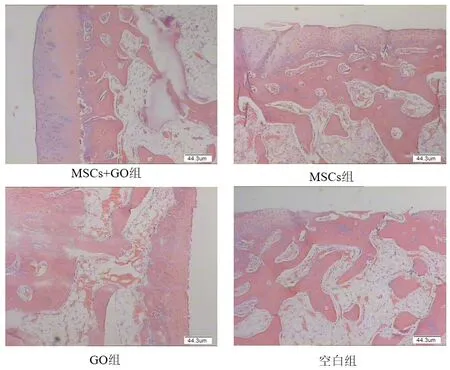
图9 改良Hulth+软骨缺损组病理组织学观察结果(HE染色×40)
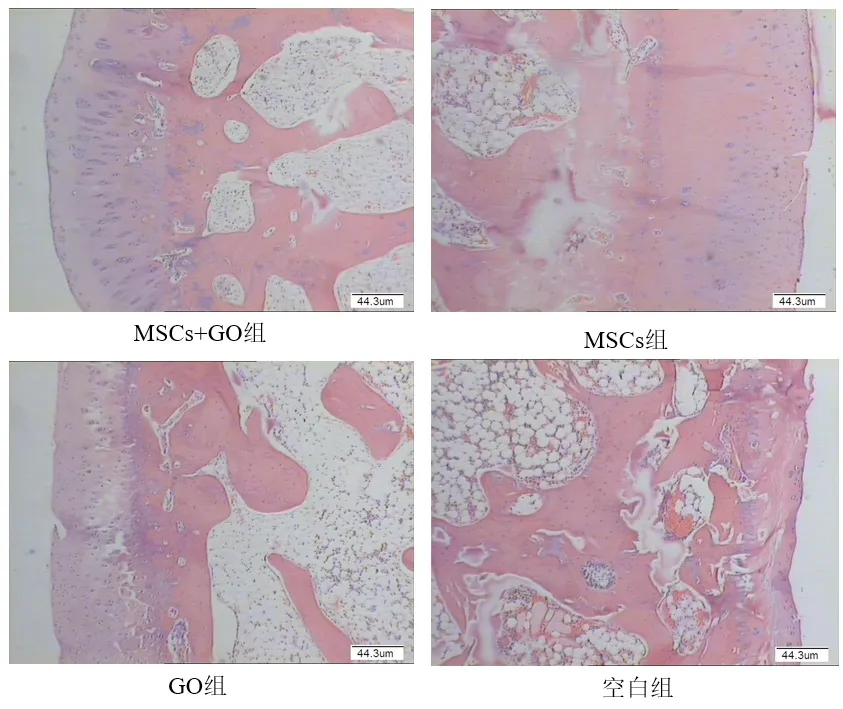
图10 改良木瓜蛋白酶控释剂关节注射组病理组织学观察结果(HE染色×40)
3 讨论
3.1 软骨修复对微环境改善 关节软骨的修复是KOA近些年研究的热点,只有软骨得到有效修复才能说明对该病进程的实质性改变。随着近年来随着干细胞技术的逐步成熟,关于干细胞介导人体组织损伤修复的研究甚至是临床报道越来越多,而UCMSC作为组织工程中理想的种子细胞已经被证实具有修复软骨的能力。Bastos等[7]利用KOA患者自体髂骨骨髓提取培养的BMSC进行关节腔注射治疗,观察12个月后发现患者的膝关节症状及关节功能都有明显改善。KOA的发病从根本上来说还是力学环境改变引起软骨损伤,所以力学因素是比较关键的两方面,由于MSC不能对关节软骨表面产生力学干预。GO具有很好的生物相容性和安全性,通过前期研究发现其可以在关节面形成一层保护层,改变软骨表面的摩擦系数。GO属于石墨烯的衍生物,是由天然石墨经强氧化剂氧化而来的一种层状纳米级材料,其表面具有大量的含氧官能团,有着良好的生物相容性[8],还能够通过静电等作用与蛋白质相结合,因此GO一直被广泛应用到药物或蛋白的传递、生物传感器及组织再生医学等领域[9-11]。通过本研究发现单纯的GO也能降低两种KOA动物模型中血清中的IL-6和TNF-α,降低其炎症反应。UCMSC具有来源广泛、取材安全方便、不违反伦理原则、低免疫源性、高增殖与多能分化等特性等优势[12]。通过本研究发现UCMSC能降低两种KOA动物模型中血清中的IL-6和TNF-α,降低其炎症反应,而且能降低血清中GAG的含量促进软骨的修复。本研究将GO颗粒润滑剂与UCMSC联用,GO颗粒润滑剂形成的三维网状结构支架,具有更大的接触表面积,可以将UCMSC牢牢吸引在自身周围,并让其在自身支架结构中黏附、伸展、存活、增殖,在低浓度HA的作用下均匀分布,制备成一种良好的复合结构,可以用于关节腔内封闭环境的治疗,在改善润滑环境的同时,又可以发挥MSC的调节免疫作用来改善生化微环境[13],并且MSC还可以一定程度上修复损伤的组织结构[14]。这有说明临床医生力求恢复关节力学平衡和解剖结构,然后生物学才能发挥作用。
3.2 退行性骨关节炎动物模型干预效果 本实验建立选择两种KOA动物模型,改良Hulth+软骨缺损组的改良Hulth+软骨缺损模型主要运动损伤模型,针对目前多发韧带撕裂、半月板破坏等,这种损伤会引起关节内炎症反应逐渐发展成为KOA,研究结果说明该类GO颗粒的三维网状支架作用就比较重要,可以让UCMSC更好地黏附着在软骨缺损区域,从而生长与增殖。可以让UCMSC更好地附着在软骨缺损区域。改良木瓜蛋白酶控释剂关节注射组模型属于化学因子诱导的软骨退变模型,可见软骨不同程度的坏死,比较接近临床中退行性骨关节炎的发病机制,实验的结果两组 中 GO+UCMSC组 血 清 NO、COL-II、GAG、IL-6、TNF-α与空白组相比差异具有统计学意义,也说明利用GO颗粒润滑剂搭载UCMSC对其有较好的治疗效果[15]。氧化石墨烯载UCMSC能促进两种KOA动物模型软骨细胞分泌,降低关节内炎性水平,起到软骨修复作用。固态润滑改善力学微环境,干细胞干预改善生物学微环境,共同作用对两种动物模型均起到很好的修复效果,间接为临床上两种损伤模式所致的退行性骨关节炎治疗提供诊治思路[16]。
GO颗粒润滑剂搭载UCMSC是结合了二者的优势,建立比传统支架搭载系统的一种新的组织工程研究,但本研究尚属于初步探索阶段,目前只证明GO颗粒润滑剂搭载UCMSC的生物相容性以及对KOA动物模型软骨修复作用,且没有发生不良反应,研究还存在许多不足及需要深入的地方。本实验中将氧化石墨烯颗粒注射于膝关节腔后,本应可在股骨髁大体观察中看到GO黑色颗粒,但并未观察到GO颗粒,说明GO在关节腔内进行了代谢,此为今后研究的重点。
