miR⁃203调控锌指蛋白281表达对黑素瘤细胞增殖、迁移的影响
2020-10-24陈小波豆倩影黄立新
陈小波 豆倩影 黄立新
南阳市中心医院整形外科,河南473000
微小RNA⁃203(miR⁃203)作为一种抑癌基因在恶性黑素瘤中低表达,可调控黑素瘤细胞增殖、迁移过程[1]。锌指蛋白281(zinc finger protein 281,ZNF281)是锌指蛋白的一种亚型,在恶性肿瘤或癌变细胞中高表达,有诱发肿瘤的作用[2]。研究[3]表明,miR⁃203 可抑制锌指蛋白217 在结直肠癌中的表达,降低其致癌性。miR⁃203是否可调节黑素瘤中ZNF281蛋白水平,从而影响黑素瘤细胞的增殖及迁移目前尚未见报道。本研究以黑素瘤细胞系A375、M14为研究对象,探讨miR⁃203对A375、M14细胞增殖、迁移的影响,并初步探讨其机制,为临床应用提供一定参考。
一、材料与方法
1.细胞系及主要试剂:人血管内皮细胞系ECV304、人黑素瘤细胞系M14(上海宾穗生物科技有限公司,批号分别为BSC⁃5107481307⁃01、BSC⁃504847958⁃01);人黑素瘤细胞系A375、SK⁃MEL⁃28、SK⁃MEL⁃2(上海名劲生物科技有限公司,批号分别为CM⁃1030、CM⁃1813、CM⁃1811)。
miRNA 提取分离试剂盒、miRcute miRNA cDNA 第1 链合成试剂盒、SuperReal PreMix Plus(SYBR Green)[天根生化科技(北京)有限公司,批号分别为DP501、FP401、FP205⁃02];LipofectamineTM2000 转染试剂盒、miR⁃203 模拟物、miR⁃203模拟物阴性对照、miR⁃203抑制剂、miR⁃203抑制剂阴性对照(广州锐博生物科技有限公司,批号分别为P0309、P0716、P0703、P5047、P3066);CCK8 试剂盒(碧云天生物科技有限公司,批号C0037);草酸铵结晶紫染色液(上海博谷生物科技有限公司,批号PT007);双荧光素酶报告基因检测试剂盒、一抗ZNF281(抗兔)、内参GAPDH(抗兔)、二抗辣根过氧化物酶标记羊抗兔抗体(美国Abcam公司,批号分别为ab228530、ab101318、ab181602、ab205718)。
2.细胞培养:各培养基添加胎牛血清制成含10%胎牛血清培养基4 ℃备用。ECV304、SK⁃MEL⁃28 细胞用RPMI1640 培养基培养,A375、M14 细胞用DMEM 培养基培养,SK⁃MEL⁃2 细胞用MEM 培养基培养,均置于CO2培养箱中37 ℃常规培养,待细胞密度达85%时扩大培养。收集各组细胞检测miR⁃203 水平,采用与ECV304 差异较大的A375、M14细胞系进行下一步研究。
3.实验分组及处理:生长良好的A375、M14细胞稀释成2×104个/ml,分别接种于24孔板中,每孔500 μl,待细胞密度达50%时转染。按照LipofectamineTM2000 转染试剂盒说明书操作,实验分5组:对照组(细胞正常培养)、miR⁃203模拟物对照组(加入50 nmoL/L miR⁃203 模拟物阴性对照)、miR⁃203 抑制剂对照组(加入50 nmoL/L miR⁃203 抑制剂阴性对照)、miR⁃203 模拟物组(加50 nmoL/L miR⁃203 模拟物)、miR⁃203抑制剂组(加50 nmoL/L miR⁃203抑制剂)。各组细胞置于37 ℃培养箱中培养24 h。
4.实时荧光定量PCR 检测miR⁃203 表达水平:收集细胞,miRNA 提取分离试剂盒提取总RNA(200 ng),用miRcute miRNA cDNA第1链合成试剂盒合成cDNA,PCR仪扩增miR⁃203、内参U6。miR⁃203 正向引物序列:5′⁃TGCTC TGAGGCGTCTAAGGCGTCCG⁃3′,反向引物序列:5′⁃CCCAA GCTTCACCTCCCAGCAGCACTTG⁃3′;内参U6 正向引物序列:5′⁃CTCGCTTCGGCAGCACA⁃3′,反向引物序列:5′⁃AAC GCTTCACGAATTTGCGT⁃3′。反应体系(20 μl):50 mg/L cDNA 1 μl,10 μmol/L 正向/反向引物各0.5 μl,SuperReal PreMix Plus(SYBR Green)10 μl,双蒸水8 μl。反应条件:95 ℃3 min,95 ℃10 s,61 ℃45 s,40 个循环。2-∆∆Ct法计算细胞中miR⁃203 水平,∆∆Ct=∆Ct目的基因-∆Ct内参。每次实验设6 个复孔,重复3次实验。
5.Western 蛋白免疫印迹法检测细胞中ZNF281 水平:收集细胞,添加蛋白裂解液,4 ℃10 000×g离心20 min,吸取上清液,BCA 试剂盒测定蛋白总浓度。每孔上样25 ng,聚丙烯酰胺凝胶分离蛋白质,280 mA 转膜后,5%脱脂奶粉室温封闭2 h;对应加入一抗ZNF281(稀释比例1/5 000)、内参GAPDH(1/5 000),4 ℃孵育过夜;加入对应二抗,室温孵育1.5 h。蛋白凝胶成像仪拍照和定量分析。蛋白表达相对值=目的蛋白灰度值/GAPDH 灰度值。每次实验设6 个复孔,重复3次实验。
6. CCK8 法检测miR⁃203 对A375、M14 细胞增殖能力的影响:各组细胞培养24 h 后,稀释成1 × 105个/ml,每孔100 μl 置于96 孔板中,分别于0、24、36、48、60、72 h 添加CCK8 试剂,继续培养2 h,酶标仪450 nm 处检测吸光度(A450),只添加培养基组作为空白对照,A450=A450实验孔-A450空白对照孔。
7. Transwell 检测miR⁃203 对A375、M14 细胞迁移能力的影响:调整细胞为5 × 103个/ml,每孔500 μl 接种于Transwell 小室中,培养48 h;取出小室,4%多聚甲醛固定,0.1%结晶紫染色5 min,流动蒸馏水清洗,显微镜下拍照并计数,每个小室5 个不重复视野计数并取平均值为该组细胞迁移数量。每次实验设6个复孔,重复3次实验。
8. 双荧光素酶鉴定miR⁃203 与ZNF281 的靶向关系:TargetScan 软件(http://www.targetscan.org/vert_72/)查找ZNF281 mRNA 的3′UTR 与miR⁃203 结合位点。设计合成ZNF281 的3′UTR 野生型(3′UTR⁃WT)和3′UTR 突变型(3′UTR⁃MUT),分别与miR⁃203模拟物或miR⁃203模拟物阴性对照(miR⁃203 NC)共转染293T细胞,双荧光素酶报告基因检测试剂盒检测miR⁃203 NC+3′UTR⁃WT组、miR⁃203模拟物+3′UTR⁃WT 组、miR⁃203 NC+3′UTR⁃MUT 组、miR⁃203模拟物+3′UTR⁃MUT组荧光素酶活性。
9.统计学分析:采用统计学软件SPSS 24.0进行数据分析。多组比较采用单因素方差分析,两两比较采用SNK⁃q法。P<0.05认为差异有统计学意义。
二、结果
1.血管内皮细胞系和黑素瘤细胞系miR⁃203表达水平比较:各细胞系中miR⁃203 表达水平不同(F = 39.501,P <0.05)。A375、M14、SK⁃MEL⁃28、SK⁃MEL⁃2 中miR⁃203 表达(0.23±0.02、0.34±0.06、0.48±0.09、0.56±0.11)均显著低于ECV304(1.01 ± 0.21),差异有统计学意义(q = 9.057、7.514、5.682、4.650,均P<0.05)。因此,选miR⁃203 表达量差异较大的黑素瘤细胞系A375、M14进行下一步研究。
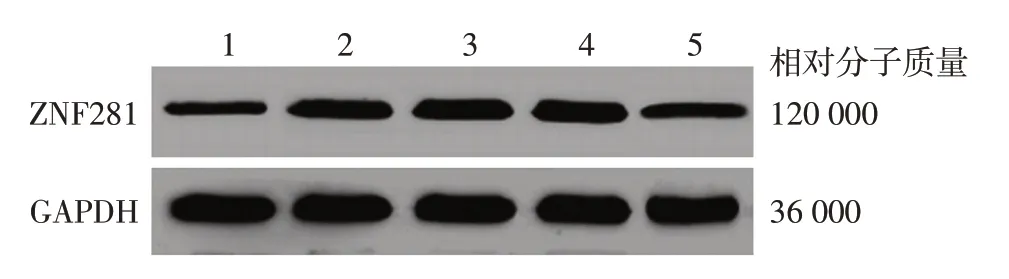
2.血管内皮细胞系和黑素瘤细胞系ZNF281 表达水平比较:各细胞系中ZNF281 表达水平不同(F = 35.701,P <0.001)。A375、M14、SK⁃MEL⁃28、SK⁃MEL⁃2中ZNF281蛋白表达(0.87±0.15、0.79±0.06、0.80±0.12、0.43±0.11)均显著高于ECV304(0.29 ± 0.06),差异有统计学意义(q =8.794、14.434、9.311、2.737,均P<0.05)。见图1。
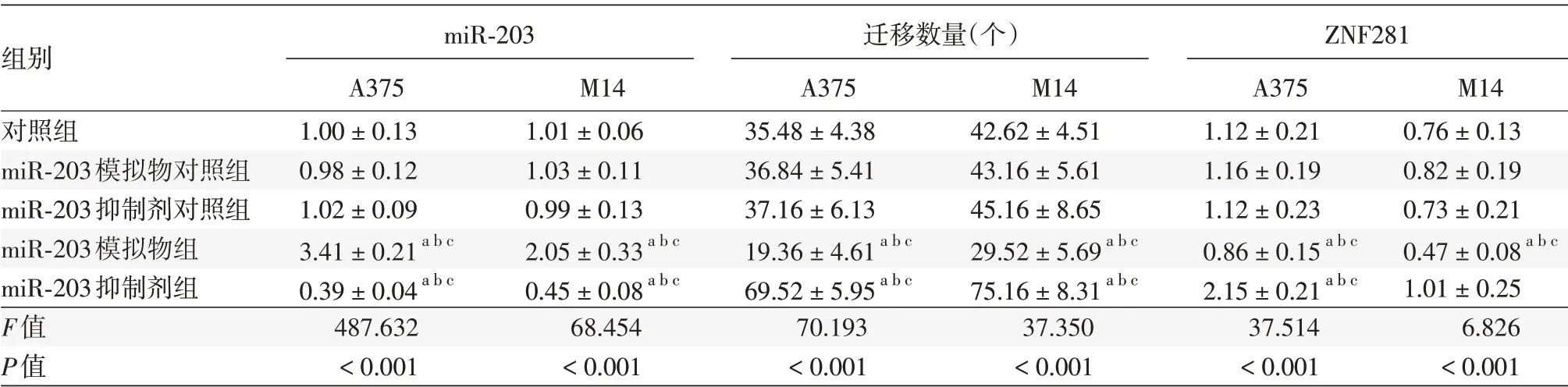
3. 各组A375、M14 细胞miR⁃203 表达的情况:与对照组、miR⁃203 模拟物对照组、miR⁃203 抑制剂对照组相比,miR⁃203 模拟物组miR⁃203 水平较高(A375:q = 23.902、24.610、25.623;M14:q=7.595、7.183、7.321),miR⁃203 抑制剂组miR⁃203 水平较低(A375:q = 10.985、11.425、15.669;M14:q = 13.717、10.445、8.665),差异均有统计学意义(均P<0.05)。见表1。
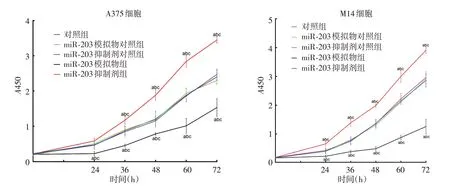
4. miR⁃203 对A375、M14 细胞增殖的影响:36、48、60、72 h,与对照组、miR⁃203 模拟物对照组、miR⁃203 抑制剂对照组相比,miR⁃203模拟物组A375、M14细胞增殖水平降低(A375:q36h= 6.311、9.417、7.564,q48h= 6.225、4.583、4.407,q60h= 3.775、4.457、3.997,q72h= 2.725、2.456、2.305,M14:q36h= 4.085、5.991、5.114,q48h= 6.171、7.652、5.353,q60h=5.465、5.571、4.603,q72h= 4.351、4.830、4.719,均P < 0.05),miR⁃203 抑制剂组细胞增殖水平升高(A375:q36h= 3.037、2.790、2.975,q48h= 3.676、3.001、4.740,q60h= 2.623、2.509、2.600,q72h= 2.622、2.615、2.409,M14:q36h= 2.421、2.327、2.378,q48h= 2.622、3.181、2.559,q60h= 2.410、2.278、2.096,q72h=2.056、1.926、1.887,均P<0.05)。24 h 时,miR⁃203 模拟物组A375、M14细胞增殖水平显著低于对照组、miR⁃203模拟物对照组、miR⁃203 抑制剂对照组(A375:q = 7.217、6.341、4.692,M14:q=4.656、6.114、4.974,均P<0.05);miR⁃203 抑制剂组M14 细胞增殖水平显著高于对照组、miR⁃203模拟物对照组及miR⁃203 抑制剂对照组(q = 5.289、5.661、4.426,均P<0.05),而miR⁃203 抑制剂组A375 细胞增殖水平与这3组差异无统计学意义(均P>0.05)。见图2。
组别对照组miR⁃203模拟物对照组miR⁃203抑制剂对照组miR⁃203模拟物组miR⁃203抑制剂组F值P值miR⁃203 A375 1.00±0.13 0.98±0.12 1.02±0.09 3.41±0.21a b c 0.39±0.04a b c 487.632<0.001 M14 1.01±0.06 1.03±0.11 0.99±0.13 2.05±0.33a b c 0.45±0.08a b c 68.454<0.001迁移数量(个)A375 35.48±4.38 36.84±5.41 37.16±6.13 19.36±4.61a b c 69.52±5.95a b c 70.193<0.001 M14 42.62±4.51 43.16±5.61 45.16±8.65 29.52±5.69a b c 75.16±8.31a b c 37.350<0.001 ZNF281 A375 1.12±0.21 1.16±0.19 1.12±0.23 0.86±0.15a b c 2.15±0.21a b c 37.514<0.001 M14 0.76±0.13 0.82±0.19 0.73±0.21 0.47±0.08a b c 1.01±0.25 6.826<0.001
5.miR⁃203 对A375、M14 细胞迁移的影响:与对照组、miR⁃203 模拟物对照组、miR⁃203 抑制剂对照组相比,miR⁃203 模拟物组A375、M14 细胞迁移数量较低(A375:q =6.209、6.024、5.685,M14:q = 4.420、4.181、3.700,均P <0.05),而miR⁃203 抑制剂组A375、M14 细胞迁移数量较高(A375:q = 11.286、9.954、9.279,M14:q = 8.340、7.818、6.126,均P<0.05)。见表1。
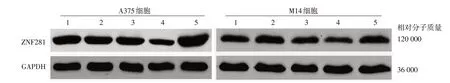
6.miR⁃203对A375、M14细胞中ZNF281蛋白表达的影响:miR⁃203 模拟物组A375、M14 细胞中ZNF281 蛋白表达显著低于对照组、miR⁃203模拟物对照组及miR⁃203抑制剂对照组(A375:q=2.468、3.036、2.319,M14:q=4.654、4.159、2.834,均P<0.05)。miR⁃203抑制剂组A375细胞显著高于对照组、miR⁃203 模拟物对照组及miR⁃203 抑制剂对照组(q=8.495、8.563、8.101,均P<0.05),而miR⁃203 抑制剂组M14细胞与对照组、miR⁃203模拟物对照组、miR⁃203抑制剂对照组差异无统计学意义(q = 2.173、1.482、2.101,均P >0.05)。见表1、图3。

图4 miR⁃203 与ZNF281 的靶向关系 miR⁃203 与ZNF281 存在15 个结合位点,在靶向位点连续结合的10 个位点建立ZNF⁃281突变序列(ZNF⁃281⁃MUT)
7.初步分析miR⁃203与ZNF281的靶向关系:TargetScan初步预测发现,miR⁃203 与ZNF281 之间存在靶位点见图4。根据靶向位点连续结合的10个位点建立ZNF⁃281突变型。荧光素酶实验验证二者的靶向关系显示,miR⁃203 NC+3′UTR⁃WT 组(1.00±0.17)、miR⁃203模拟物+3′UTR⁃WT 组(0.48 ± 0.06)、miR⁃203 NC + 3′UTR⁃MUT 组(0.96 ±0.13)、miR⁃203 模拟物+ 3′UTR⁃MUT 组荧光素酶活性(0.98 ± 0.15)差异有统计学意义(F = 20.950,P < 0.001)。与miR⁃203 NC + 3′UTR⁃WT 组相比,miR⁃203 模拟物+ 3′UTR⁃WT组细胞荧光素酶活性下降(q=7.065,P<0.05)。
三、讨论
目前,治疗恶性黑素瘤的常用方法为手术治疗,无法进行手术治疗的部分患者多采用放化疗,但效果不佳且有不良反应,因此寻找安全、有效的治疗方法是当前的临床热点。miR⁃203存在于染色体的不稳定脆性区域,是近年来发现的第一个皮肤特异性miRNA,其在转移性黑素瘤及黑素瘤细胞系中低表达,过表达miR⁃203 可抑制黑素瘤细胞运动、集落形成以及血管生成诱导能力;在体内,miR⁃203还抑制异种移植肿瘤生长,并减少淋巴结和肺转移;可作为黑素瘤的有效抑制剂[4]。本研究发现,黑素瘤细胞系A375、M14、SK⁃MEL⁃28、SK⁃MEL⁃2中miR⁃203表达水平显著低于血管内皮细胞系ECV304,提示miR⁃203水平降低可能与恶性黑素瘤发生发展有关;A375、M14 细胞中,上调miR⁃203表达可降低细胞增殖活性及细胞迁移数量,下调其表达可增加细胞增殖活性及细胞迁移数量,表明miR⁃203 可调控A375、M14细胞增殖及迁移过程,抑制其表达可降低黑素瘤细胞增殖及迁移活性。
ZNF可通过促进细胞增殖、迁移、侵袭、血管生成,抑制细胞凋亡、自噬及溶酶体生成等,介导肿瘤发生发展[5]。ZNF217高表达于结直肠癌组织中,且与结直肠癌患者的低生存率有关,而miR⁃203可通过抑制ZNF217表达降低结直肠癌细胞增殖、迁移及侵袭活性,从而缓解癌症进展[3]。抑制ZNF281 基因表达可降低直肠癌细胞活力并诱导细胞凋亡,且可增加及氟尿嘧啶化疗敏感性[6]。环状RNA circAGFG1 可与miR⁃203 竞争性地调控ZNF281 表达,通过circAGFG1/miR⁃203/ZNF281轴促进非小细胞肺癌的上皮间充质转化和转移[7]。ZNF281作为DNA结合蛋白,在肿瘤中研究较少,目前尚未见ZNF281在黑素瘤中的相关报道。本研究显示,黑素瘤细胞系A375、M14、SK⁃MEL⁃28、SK⁃MEL⁃2中ZNF281 蛋白表达显著高于血管内皮细胞系ECV304,提示ZNF281可能与黑素瘤的发生发展有关。下调A375、M14细胞miR⁃203 表达,可引起ZNF281 蛋白表达、细胞增殖活性及迁移细胞数均降低;上调A375细胞miR⁃203表达,引起ZNF281 蛋白表达、细胞增殖活性及迁移细胞数增加,提示miR⁃203 可能通过调控ZNF281 蛋白表达,影响黑素瘤细胞的增殖和迁移。M14细胞中,上调miR⁃203表达可引起细胞增殖活性升高、迁移细胞数增加,但ZNF281 蛋白表达未见明显变化,可能与ZNF281蛋白受多种调控及不同黑素瘤细胞系的特性有关。进一步采用双荧光素酶鉴定miR⁃203与ZNF281的靶向关系显示,miR⁃203与ZNF281之间存在靶位点,miR⁃203 可能直接调控ZNF281。本研究只初步研究了两个黑素瘤细胞系中miR⁃203 与ZNF281 的关系及其对细胞增殖、迁移的影响,还应进一步通过上调或下调ZNF281表达进行验证,以进一步探索miR⁃203 调控恶性黑素瘤发生发展的机制。
利益冲突所有作者均声明不存在利益冲突
